超重孕妇的肠道菌群与妊娠期糖尿病的关系*
2021-11-20徐先明
苏 尧,陈 莉,徐先明
(上海交通大学附属上海市第一人民医院妇产科 上海交通大学医学院,上海 200080)
妊娠期糖尿病(gestational diabetes mellitus,GDM)是妊娠期常见并发症之一,被美国糖尿病协会定义为“妊娠前无糖尿病,在妊娠中晚期诊断为糖尿病的人”[1]。随着饮食结构和生活环境的改变,GDM发病率呈逐年增长的趋势,我国GDM发病率约为14.8%[2]。积极干预GDM的发生有利于减少围产期的不良妊娠结局,包括流产、巨大胎儿和新生儿窒息[3]等。GDM病因复杂,发病机制尚未明确。目前研究证明,胰岛素抵抗及胰腺β细胞分泌缺陷[4],以及革兰氏阴性菌的脂多糖介导的代谢性内毒素血症[5]等可能对GDM的发生发展具有重要的作用。肠道菌群作为人体的第十大系统——微生态系统,近年来成为代谢内分泌领域的关注热点。研究表明,厚壁菌门和拟杆菌门作为肠道菌群的优势菌种[6],所占比例约90%,其结构比例的失调是肥胖和2型糖尿病的高危因素。Crusell等[7]通过16SrRNA基因测序分析发现GDM孕妇的肠道菌群与2型糖尿病患者的菌群结构改变相似。因此GDM与肠道菌群的关系也成为研究的热点。本文旨在研究超重和肥胖人群在妊娠中期的肠道菌群构成特征及其与GDM的关系,探讨GDM的发生机制,以期为超重、肥胖孕妇的健康管理提供依据。
1 资料与方法
1.1 研究对象 随机选取2019年11月至2020年6月在上海市第一人民医院产科门诊规律产检的88例孕妇作为研究对象。入选标准:(1)本市常驻居民,上海松江地区普通饮食;(2)孕前未患糖尿病或糖耐量异常。排除标准:(1)多胎;(2)妊娠前患有糖尿病、高血压、甲状腺疾病、胃肠道或心血管疾病等内外科疾病;(3)使用辅助生殖技术;(4)入组前2个月服用抗生素者。本研究经医院伦理委员会审核批准,患者知情同意并签署知情同意书。
1.2 研究方法
1.2.1 临床信息收集 通过查阅门诊电子病历系统收集孕妇的相关临床资料,包括身高、孕前体重、年龄、孕产次、血压等。
1.2.2 标准和分组 孕前BMI=孕前体重/身高2(kg/m2)。依据《中国成人超重和肥胖症预防与控制指南》推荐标准,BMI≥24.0kg/m2和≥28.0kg/m2分别诊断成人超重(24.0kg/m2≤BMI<28.0kg/m2)和肥胖(BMI≥28.0kg/m2)[8]。GDM诊断标准参考2015年美国糖尿病协会发布更新的糖尿病医学诊治标准[9]:空腹血糖(fasting blood glucose,FBG)≥5.1mmol/L(92mg/dL),1h血糖(1-hour postprandial blood glucose,1h PBG)≥10.0mmol/L(180mg/dL),2h血糖(2-hour postprandial blood glucose,2h PBG)≥8.5mmol/L(153mg/dL),出现以上任一血糖值即诊断为GDM。按孕前是否超重或肥胖及是否患GDM分为四组:组1(43例):未超重(孕前BMI<24.0kg/m2)未患GDM组;组2(22例):未超重患GDM组;组3(16例):超重或肥胖(孕前BMI≥24.0kg/m2)未患GDM组;组4(n=7):超重或肥胖(孕前BMI≥24.0kg/m2)患GDM组。
1.2.3 胰岛功能评估 (1)胰岛素抵抗指数(homeostasis model assessment insulin resistance,HOMA-IR):HOMA-IR=空腹血糖水平(FPG,mmol/L)*空腹胰岛素水平(FINS,U/mL)/22.5。(2)胰岛素分泌指数(homeostasis model assessment insulin secretion,HOMA-IS):HOMA-IS=1/HOMA-IR。(3)胰岛β细胞功能指数(homeostasis model assessment beta cell function,HOMA-β):HOMA-β=20×空腹胰岛素水平(FINS,mIU/L)/[空腹血糖水平(FBG,mmol/L)-3.5](%)。
1.2.4 粪便标本采集及粪便DNA提取、扩增、建库及生物信息学分析 行OGTT当天采集新鲜粪便,用采样器采取2~3g或4样品勺与保存液充分混匀,置-80℃保存。
采用Magnetic Fecal DNA Extraction Kit提取粪便标本中总的菌群DNA量,使用ExKubit dsDNA HS分析试剂盒对提取出的DNA进行质量检测,剔除不符合检测标准的样本,利用聚合酶链反应(polymerase chain reaction,PCR)特异性扩增16S rRNA的V3-V4可变区。使用2%琼脂糖凝胶电泳检测PCR产物。利用Illumina Hiseq2500平台对PCR扩增产物进行测序建库,将获得的序列通过Trimmomatic软件,采用RDP classifer贝叶斯算法统计样本的群落组成,并聚类为操作分类单位(operational taxonomic unit,OTU),再与SILVA数据库进行比对,对物种分类信息进行注释。使用Usearch软件平台对样本进行生物信息学分析包括物种的相对丰度、OTUs(物种丰富度)和α多样性(Ace指数、Chao指数、Shannon指数、Simpson指数)。

2 结 果
2.1 四组孕妇的临床资料比较 四组孕妇的年龄、采样孕周、孕次、产次、收缩压及舒张压比较,差异均无统计学意义(P>0.05),见表1。
2.2 四组孕妇肠道菌群的组成和结构变化
2.2.1 四组孕妇肠道菌群门和属水平相对丰度比较 在门水平上,88例孕妇孕中期肠道菌群标本中共发现22个菌门,平均丰度前五位的菌门为厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、疣微菌门(Verrucomicrobia)。在属水平上,88例孕妇肠道菌群标本中共发现315个菌属,平均丰度前八位的菌属为拟杆菌属(Bacteroides)、粪杆菌属(Faecalibacterium)、巨单胞菌属(Megamonas)、瘤胃菌属(Ruminococcaceae_UCG002)、双歧杆菌属(Bifidobacterium)、其他菌属-A(Other_A)、Lachnoclostridiu、EscherichiaShigella。其中组4(孕前BMI≥24kg/m2且患GDM)孕妇厚壁菌门占比36%,明显低于其他3组(54%、58%、56%);拟杆菌门占比约50%,明显高于其他3组(30%、28%、30%);拟杆菌属占比为48%,明显高于其他三组(22%、20%、16%)。
2.2.2 各组之间的肠道菌群构成比差异 (1)组3与组4比较:孕前BMI≥24kg/m2的孕妇中,孕中期发展为GDM的孕妇相较于血糖正常的孕妇厚壁菌门和放线菌门相对丰度明显减少(P2=0.018和P2=0.047),拟杆菌门和属相对丰度均明显增加(P2=0.030和P2=0.018),厚壁菌门/拟杆菌门=3/5。(2)组1与组2比较:孕前BMI<24kg/m2的孕妇中,孕中期发展为GDM的孕妇相较于血糖正常的孕妇巨单胞菌属明显降低(P1=0.044),厚壁菌门和拟杆菌门构成无差异,其中厚壁菌门/拟杆菌门=5/3。(3)组1和组3比较:OGTT正常的孕妇,无论孕前BMI正常还是超重,孕妇的肠道菌群构成在门和属水平均无差异。见表2。

表1 88例孕妇的基本特征

表2 在门、属水平四组研究对象菌群相对丰度比较
2.2.3 肠道菌群的多样性及OTUs比较 无论孕前BMI大小和血糖水平差异,四组孕妇肠道菌群的多样性和OTUs组间差异无统计学意义,见表3。
2.3 四组孕妇胰岛素水平及胰岛素敏感指数比较 超重的两组(组3、组4)孕妇的HOMA-IR、HOMA-IS和HOMA-β均高于孕前BMI正常的两组(组1、组2)孕妇,差异有统计学意义(P0<0.001,P0<0.001和P0=0.0010)。分别比较四组人群HOMA-IR:孕前BMI<24kg/m2时,GDM孕妇与非GDM孕妇的HOMA-IR、HOMA-IS和HOMA-β差异无统计学意义(P>0.05);孕前BMI≥24kg/m2时,GDM孕妇与非GDM孕妇的HOMA-IR、HOMA-IS和HOMA-β差异无统计学意义(P>0.05);非GDM孕妇,孕前BMI≥24kg/m2组HOMA-IR和HOMA-β明显高于孕前BMI<24kg/m2组(P3=0.002和P3=0.022),而HOMA-IS明显降低(P3=0.002);GDM孕妇,孕前BMI≥24kg/m2组较孕前BMI<24kg/m2组的HOMA-β明显升高(P4=0.008),HOMA-IR和HOMA-IS差异无统计学意义(P>0.05)。见表4。
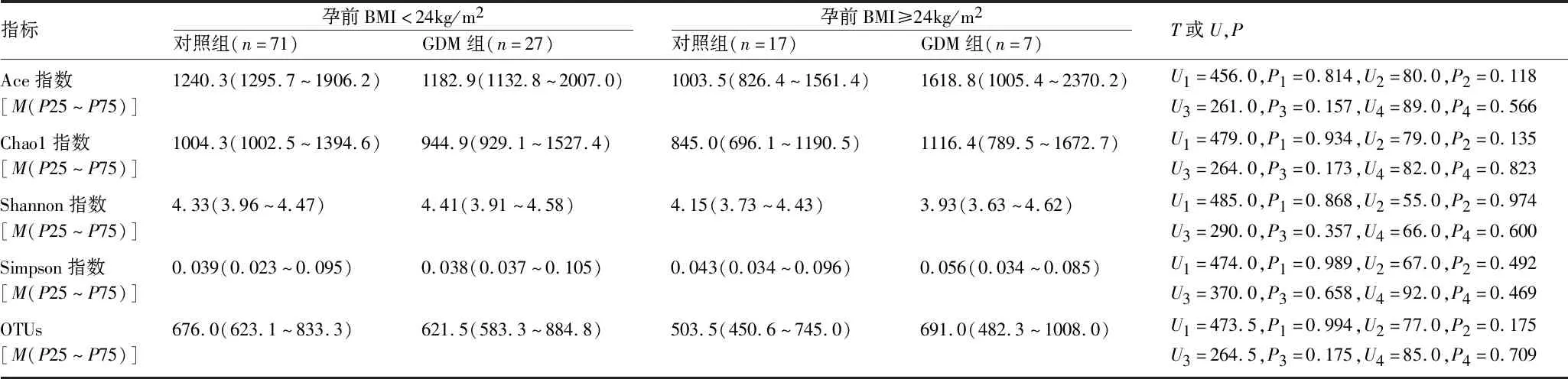
表3 四组研究对象菌群α多样性比较

表4 四组研究对象胰岛素抵抗指数比较
2.4 四组孕妇菌群相对丰度与生化代谢指标的关系 在门水平,厚壁菌门与1h PIN呈负相关(P<0.05,r=-0.219),拟杆菌门与1h PIN和HOMA-β呈正相关(均P<0.05,r=0.260和r=0.246),变形菌门与2h PBG呈正相关(P<0.05,r=0.245),瘤胃菌门与2h PIN和HOMA-β呈正相关(均P<0.05,r=0.229和r=0.248)。在属水平上,拟杆菌属与1h PIN和HOMA-β呈正相关(均P<0.01,r=0.305和r=0.284),而与HOMA-IS呈负相关(P<0.05,r=-0.227),粪杆菌属与1h PIN呈负相关(P<0.05,r=-0.221),其他菌属-A与HOMA-IS呈正相关(P<0.05,r=0.257),Lachnoclostridiu与高密度脂蛋白(high-density lipoprotein,HDL)呈负相关(P<0.05,r=-0.237),而与甘油三酯(triglyceride,TG)呈正相关(P<0.05,r=0.243),见图1。
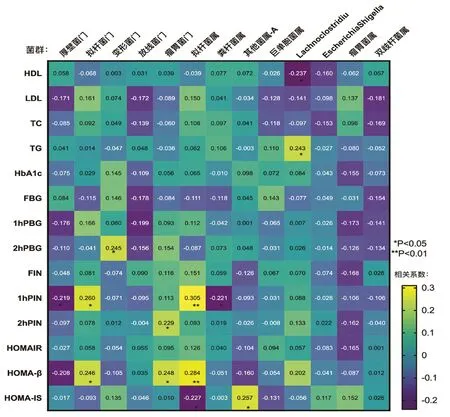
图1 88例孕妇肠道菌群与糖代谢及脂代谢指标相关性的热图
3 讨 论
肠道菌群作为人类机体复杂的共生系统,其基因组的数量庞大,比人类基因组大150倍[10],与宿主共同进化。继Sanger测序的诞生,Sanger等[11]发明了16S rRNA测序,基于高变区(V1-V9)的保守序列来研究细菌类群及其系统发育,揭开了肠道菌群神秘的面纱。人类肠道微生物由细菌、古细菌、真核生物、病毒和寄生虫五类构成[12],但是肠道微环境主要有利于细菌的生长,包括厚壁菌、拟杆菌、放线菌、梭菌、变形杆菌、疣微菌和蓝细菌[13],其中厚壁菌和拟杆菌占90%以上。肠道菌群主要通过四个方面发挥功能:新陈代谢、屏障保护、组织结构和神经系统[14]。肠道菌群具有多种酶,在结肠中,可消化掉摄入食物的10%~30%的能量[15]。研究发现,孕前超重孕妇在孕中期之前肠道中拟杆菌门和属丰度较高,厚壁菌门丰度较低且血糖水平较高。Al-Attas等[16]研究发现,肥胖小鼠的肠道菌群中,厚壁菌门与拟杆菌门的比例出现了明显的改变,前者相对丰度降低了50%,而拟杆菌门的相对丰度增加了50%,这与本研究结论一致。高脂饮食[17](high-fat diet,HFD)是肥胖发生的关键因素。研究发现,HFD导致小鼠肠道中的拟杆菌减少,而变形杆菌增加,其潜在机制可能与能量的收集和储存以及增加了肠道的通透性和炎症反应有关。同样,一项系统评价[18]通过评估0~13岁儿童的肠道菌群和BMI,提出拟杆菌的减少和厚壁菌门的增加可能是肥胖儿童的重要观察指标。
本研究发现,厚壁菌门和拟杆菌门是相对丰度最高的两大优势菌群,与上述文献结果一致。在孕前超重的孕妇中,孕中期发展为GDM的孕妇相较于血糖正常的孕妇拟杆菌门和属丰度增加,厚壁菌门/拟杆菌=3/5;在孕前BMI正常的孕妇中,孕中期发展为GDM的孕妇相较于血糖正常的孕妇巨单胞菌属丰度降低,其中厚壁菌门/拟杆菌=5/3;OGTT正常的孕妇,无论孕前BMI正常还是超重,菌群构成相似,其中厚壁菌门/拟杆菌=5/3。孕中期诊断为GDM的孕妇中,孕前超重的孕妇厚壁菌门与拟杆菌门比例倒置,孕前BMI正常孕妇厚壁菌门与拟杆菌比例正常,巨单胞菌属丰度降低,因此,推断不同体质量指数孕妇导致GDM的菌群变化具有异质性,拟杆菌与血糖水平关系更密切,尤其是拟杆菌的增加和厚壁菌门的减少,对机体血糖代谢水平的影响可能大于单纯肥胖或超重的孕妇。通过分析GDM与非GDM孕妇的肠道菌群[19]发现,拟杆菌的相对丰度与OGTT结果呈明显正相关。拟杆菌[20](革兰氏阴性菌)的细胞壁含有复杂的脂多糖成分(LPS),其脂类部分作为内毒素,可诱导强烈的宿主免疫反应,即代谢性内毒素血症。适度的炎症反应有利于机体抵抗外界的感染,过度的炎症反应则可能导致机体的代谢紊乱,引起胰岛素抵抗、糖尿病和肥胖等疾病。Brugman等[21]利用抗生素治疗BB-DP大鼠(1型糖尿病大鼠模型),观察最终的糖尿病发生率和胰岛素水平以及肠道菌群的情况,发现未患糖尿病的大鼠表现出较低的拟杆菌水平。而在肥胖或超重的人群中,厚壁菌门/拟杆菌门比率(F/B)升高[22],有学者提出,厚壁菌门能更有效地促进热量的储存,而拟杆菌主要参与多糖的酵解作用。
目前研究认为,肠道菌群主要通过以下3方面参与机体的糖代谢和血脂代谢的调控:(1)胰岛素抵抗:肠道菌群失调,革兰氏阴性菌增加时,LPS大量释放进入外周循环系统,通过介导TLR4和MAPK信号通路,诱导机体胰岛素抵抗。(2)短链脂肪酸(short-chain fatty acid butyrate,SCFAs):SCFAs是肠道菌群对膳食纤维的发酵产物,GPRs家族中受体GPR41和GPR43是SCFAs参与糖脂代谢调节的两个关键受体。GPR41通过调节肠道L细胞PYY的分泌,调节宿主的能量摄入;GPR43则通过调节肠道L细胞胞浆中Ca2+的释放,增加胰高血糖素样肽-1(GLP-1)的分泌。当产SCFAs的细菌减少时,上述途径出现障碍,导致糖尿病和肥胖的发生。(3)次级胆汁酸:胆汁酸的转化主要由拟杆菌、真细菌和梭菌属的厌氧细菌进行。肠道菌群利用胆酸盐水解酶和胆固醇7α-羟化酶,将肝脏产生的原胆汁酸转化为脱氧胆酸、熊脱氧胆酸等次级胆汁酸[23],通过活化FXR和TGR5,从而调节能量代谢和胰岛素敏感性[24]。
既往研究表明,肥胖和糖尿病人群容易发生胰岛素抵抗状态,与本研究结果一致。进一步研究发现,无论血糖水平,超重孕妇的HOMI-IR较体重正常孕妇高,β细胞功能指数也较高,胰岛素分泌指数较低;无论BMI大小的情况下,孕中期OGTT正常的孕妇中超重者存在胰岛素抵抗现象。因此推测超重孕妇普遍存在胰岛素抵抗现象,胰岛分泌的胰岛素更多。本研究显示,孕前超重孕妇较BMI正常孕妇的HOMI-IR和HOMA-β指数显著升高,虽然超重的GDM或非GDM孕妇的肠道菌群差异显著,但是两者之间的胰岛素抵抗状态无差异。在孕前BMI正常的人群,GDM组较非GDM组的HOMI-IR和HOMA-β指数升高,HOMA-IS指数降低,表明GDM孕妇的胰岛素抵抗水平明显高于未患GDM的孕妇,但两者肠道菌群构成无差异。因此推测,在孕前体重正常或偏瘦的孕妇中,胰岛素抵抗可能是导致其血糖升高的重要原因,但对于孕前超重或肥胖的孕妇,肠道菌群失调及代谢改变可能是影响GDM发生的重要机制。
本研究回顾性探究了不同BMI孕妇易患GDM的肠道菌群构成,不同BMI的孕妇导致GDM的菌群变化具有异质性,拟杆菌与血糖水平关系更密切,因此对于不同BMI的孕妇可进行个性化的管理。但本研究仍存在不足之处:首先,研究时间只包含孕中期之前,没有涵盖整个孕期,无法得知整个孕期孕妇动态的肠道菌群构成,后续研究应增加对孕早期、孕晚期及新生儿菌群构成的研究;其次,本研究只局限于单一院区,后续研究应进行多中心研究使研究结论更具有科学性。
综上所述,本研究中超重或肥胖且患GDM孕妇的肠道菌群构成明显改变、HOMA-IR较高,厚壁菌门/拟杆菌门的比例(F/B)显著降低,其中拟杆菌门的增加和厚壁菌门的降低可能是孕前BMI偏高孕妇发生GDM的关键因素之一;而在孕前体重正常或偏瘦的孕妇中,拟杆菌和厚壁菌门比例和胰岛功能正常,巨单胞菌属丰度降低。因此,临床上对于孕前超重或肥胖的孕妇在饮食上可注意补充膳食纤维或益生菌和益生元等,以利于菌群平衡尤其是厚壁菌门和拟杆菌们的平衡和正常的血糖水平,对于孕前体重正常或偏瘦的孕妇也应注意饮食均衡和保持平衡的肠道微生态,以期降低人群患GDM的风险。
