蓝圆鲹加工副产物酶促水解制备抗氧化肽的研究
2021-11-20董铮刘婷婷徐新月周文飞
董铮,刘婷婷,徐新月,周文飞
(山东省青岛市即墨区农业农村局,山东 青岛 266200)
统计数据显示,截止2019年底,中国水产品总产量达到6 450万t,占全球总量的61.7%,是全球最大的水产养殖国之一[1]。2019年水产品总量大幅度增长,其中大宗淡水养殖产量为3 013.74 万t[2]。随着水产品市场和消费群体的逐步扩大,水产品贸易和消费量也逐年攀升,水产品加工副产物的高值化利用问题也得到越来越多人的关注。
蓝圆鲹(Decapterusmaruadsi),又名巴浪鱼,属鲈形目鲹科圆鲹属,主要生活在中国的东海、南海附近海域,其不仅富含丰富的氨基酸,营养价值堪比“西洋参”,而且价格低廉[3]。近年来,随着中国渔业迅猛发展,蓝圆鲹的产量与日俱增,平均年产量达13万t以上,约占海洋捕捞量的2/3[4]。蓝圆鲹作为中国水产中的低值鱼类,其加工一直较为落后。伴随着鱼类加工企业生产规模以及产量的扩大,占鱼重50%~80%的鱼肝脏、鱼骨、小鱼等鱼类加工的副产物大量产生。这些副产物或被丢弃,或被制成了咸干制品及饲料鱼粉使用,很少会被深加工,既造成了资源的浪费又对生态环境造成了一定的破坏[5-6]。随着蓝圆鲹产量及出口量的增加,蓝圆鲹加工过程中产生的大量副产品的综合利用显得日益迫切。
随着酶工程技术的不断发展,酶解技术被应用于渔业加工开发等方面,这为食品工业和鱼副产品的发展提供了广阔的开发及应用前景。酶解技术是采用蛋白酶对蛋白质进行酶解后,使蛋白质的内部肽链结构发生变化,并进一步修饰和提升了产物的功能特性、感官性质和物化性质,使得其更易被机体吸收利用的一种技术,因此被广泛应用于不同的领域[6-7]。利用酶解技术制备生物活性肽,不仅可以充分利用优质蛋白质资源,还可带来明显的经济和社会效益[7]。国内外大量研究表明,水产蛋白源生物活性肽在降血压、降血脂、抗肿瘤、抗氧化、抗菌、抗病毒和免疫调节等方面具有较为明显的生理活性作用[8-9]。相关科研人员已从众多海洋生物中分离鉴定出抗氧化活性肽,比如:鱿鱼(TodarodesPacificus)、牡蛎(Ostreagigasthunberg)、金枪鱼(Thunnini)等[10-11]。卢素珍[12]采用二步酶解法制备出了鱼鳞明胶抗氧化肽,并进一步筛选出了活动较强的抗氧化肽;范鸿冰等[13]通过酶解螯合制得鲢(Hypophthalmichthysmolitrix)鱼骨胶原多肽螯合钙;美国学者[14-15]分别以沙丁鱼(Sardine)、鲭(Mackerel)鱼为原料水解制得抗氧化肽,其安全无毒,分子量小、易被消化吸收、易溶解,在食品行业拥有广阔的发展前景。
本研究以蓝圆鲹加工副产物为原料,对碱性蛋白酶酶促水解制备抗氧化肽的工艺进行优化,并对酶解液中高抗氧化活性的肽段进行分离纯化,为开发蓝圆鲹抗氧化肽功能性产品提供理论依据,并为进一步探究和开发蓝圆鲹这一低值鱼的附加价值提供参考。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
蓝圆鲹:购于福建龙岩当地的海鱼市场,捕获于福建莆田海峡;碱性蛋白酶:上海生命科学公司;牛血清白蛋白(BSA):生化纯,国药集团化学试剂有限公司;1,1-二苯基-2-三硝基苯肼(DPPH):上海浩然生物技术有限公司;葡聚糖凝胶Sephadex G-25: 上海浩然生物技术有限公司;Sephacryl S-100 HR丙烯葡聚糖凝胶色谱柱:国药集团化学试剂有限公司;实验中其他试剂均为分析纯。
1.1.2 仪器设备
紫外可见分光光度计(UV1000 型),天美(中国)科学仪器公司;超滤装置,Cole-Parmer中国公司;AKTA Pure 25蛋白质纯化系统(AKTA avant 25型),GE Healthcare Life Science公司。
1.2 实验方法
1.2.1 抗氧化肽制备工艺流程
蓝圆鲹加工副产物→绞碎、脱脂→烘干、粉碎→脱脂鱼粉→确定鱼粉总蛋白含量→酶促水解(单因素试验探究、响应面方法优化)→确定优化后的最佳工艺条件。
1.2.2 酶促水解
称取适量的脱脂鱼粉,选择pH 8.5的50 mmol/L Tris-HCl 缓冲液作为反应体系,加入相应比例的碱性蛋白酶于55 ℃的恒温水浴中水解。水解一定时间后,置于90 ℃水浴高温灭酶10 min,室温下冷却后,8 000 r/min 离心15 min,去除沉淀,收集上清液保存备用,以便进行后续实验。
1.2.3 水解条件的探究与优化
(1)单因素探究试验
利用水解度和抗氧化活性这两个指标,首先通过单因素试验分别探究料液比、酶添加量和水解时间3个因素对蓝圆鲹加工副产物酶解效果的影响,如表1所示。

表1 单因素试验的因素水平表Tab.1 Factor level table of single factor experiment
(2)响应面优化试验
根据Box-Benhnken Design[16-17]的中心组合试验设计原理,通过对单因素试验结果的分析,设计3因素3水平的响应面试验。应用 Design-Expert 8.0.6 软件进行试验设计,通过测定不同条件下制得水解液的水解度和DPPH自由基清除率,确定优化后的最佳条件。
1.2.4 蛋白含量及TCA可溶性短肽含量测定
利用 Folin-Phenol 法[18]测定可溶性蛋白质的含量,根据蛋白含量的标准曲线和稀释倍数计算蛋白及TCA 可溶性短肽含量。
1.2.5 水解度的测定
根据Pericin D等[19]的实验方法稍加修改,取0.5 mL水解液,加入0.5 mL 20%三氯乙酸溶液,混匀后在4 ℃下静置20 min,然后在10 000 r/min的转速下离心15 min,取0.5 mL上清液(按实际需要进行稀释),用Folin-Phenol法测定蛋白质含量。同时用蒸馏水代替水解液重复上述步骤,得到的溶液作为测定蛋白质含量时的空白溶液。
水解度DH(%)=(TCA可溶性
蛋白含量/水溶性总蛋白质含量)× 100%
式(1)
1.2.6 抗氧化活性的测定
以水解液清除DPPH自由基能力来表示抗氧化能力。根据参考文献略作修改[20-21],测定方法如下:将酶解液稀释至0.5 mg/mL,然后移取2 mL酶解液,加入2 mL 0.1 mmol/L DPPH(三组平行实验),置于暗处30 min后在517 nm下测定吸光度,记为Ai,用2 mL酶解液加2 mL无水乙醇调零。用蒸馏水代替酶解液重复以上步骤,测得吸光度记为Aj,用无水乙醇调零。DPPH清除率按以下公式求得:
DPPH自由基清除率(%)=(1-Ai/Aj)×100%
式(2)
1.2.7 抗氧化肽的分级分离纯化
(1) 超滤分离纯化抗氧化肽
利用最优碱性蛋白酶酶解工艺酶解得到蓝圆鲹加工副产物的水解液,经0.22 μm孔径滤膜初滤,除去不溶性杂质,再利用超滤装置对多肽液进行分离、浓缩。采用不同截留分子量(10.0 kDa、5.0 kDa和3.0 kDa)的超滤膜对蓝圆鲹蛋白酶解液分步分离,得到4组分子量不同的组分,选择抗氧化活性最强的组分进行下一步凝胶层析分离纯化。
(2) Sephadex G-25凝胶色谱层析分离纯化抗氧化肽
采用Sephadex G-25作为凝胶填料,将其进行预处理后装于规格为16 mm×400 mm的玻璃层析柱中,并将上步所得的抗氧化活性最高的组分配制成浓度50 mg/mL的溶液,在凝胶层析柱最适条件下进行洗脱,于280 nm处检测并收集各洗脱峰对应的洗脱溶液,选择抗氧化活性最强的组分进行分子量的测定。
(3)凝胶渗透色谱(GPC)测定抗氧化肽分子量
选用GPC凝胶色谱柱对凝胶过滤分离得到的DPPH自由基清除率最高的组分进行分子量的测定。将上步所得组分配制成浓度50 mg/mL的溶液,于280 nm波长下检测洗脱峰,获得样品的洗脱体积,利用标准曲线计算样品分子量的大小。
1.3 数据分析
所有实验均设3个平行,最终数据以“平均值±标准偏差”表示。用Excel软件对实验结果进行统计分析和绘图,用 Design-Expert 8.0.6 软件进行响应面优化分析和绘图。
2 结果与讨论
2.1 响应面优化工艺条件
综合前期单因素试验结果,选择料液比、酶添加量、酶解时间为考察变量,中心点分别为1∶10、8 U/mg、2.5 h,变化步长分别为5.0、2.0及0.5,以Design-Expert 8.0.6软件设计中心组合试验,试验次数为17,其中4个为中心点。试验设计及结果如表2、表3。蓝圆鲹加工副产物酶促水解液的水解度在19.56%~38.00%,DPPH自由基清除率在20.38%~41.89%,而且不同试验设计组之间的差异较明显。因此,本实验通过Box-Behnken Design(BBD)中心组合试验设计原理进行方案设计。
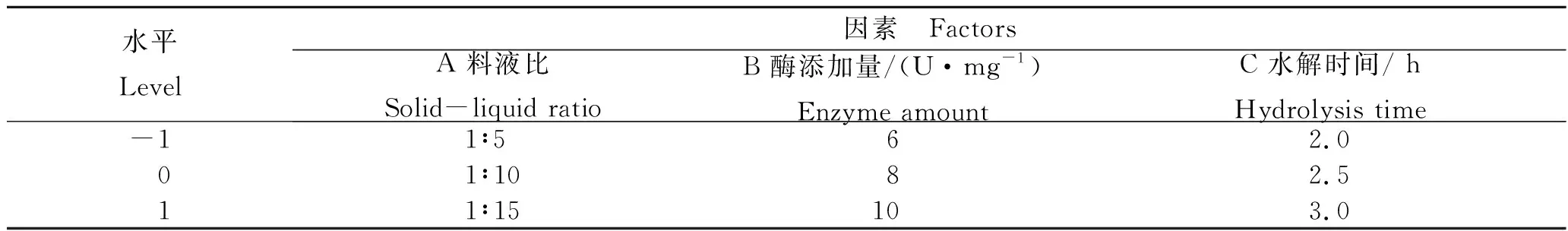
表2 响应面试验的因素水平表Tab.2 Factor level table of response surface method n=3
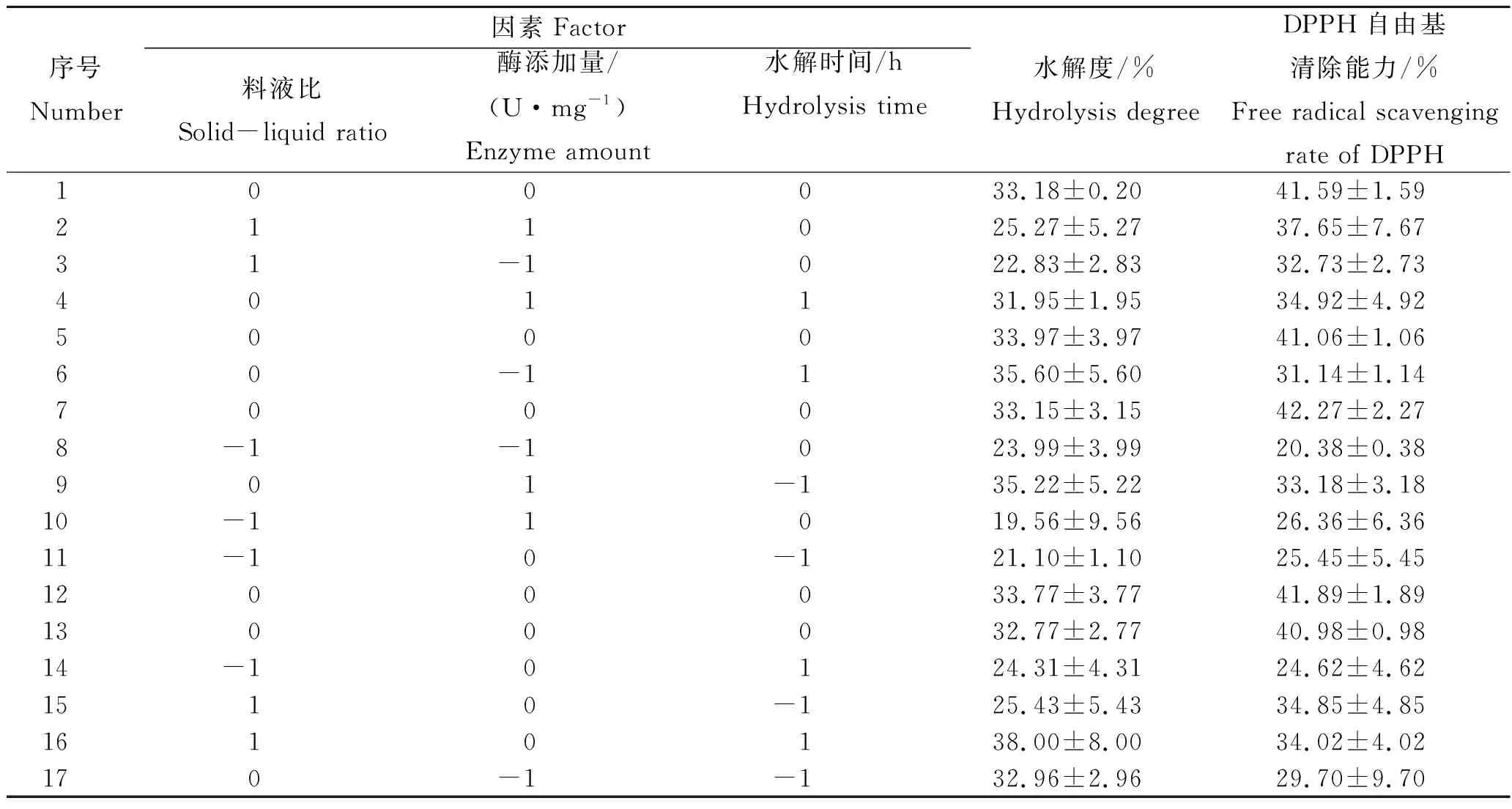
表3 响应面实验设计及相应结果Tab.3 The experimental design and corresponding results of response surface method n=3
2.1.1 以DPPH自由基清除能力为目标的响应面结果分析
本试验研究利用Design-Export 8.0.6软件对表3中的试验数据进行多元回归拟合,最终得到的回归分析结果如下表4中所示。

表4 以 DPPH 清除能力为目标的回归分析结果Tab.4 Regression analysis results aimed at DPPH scavenging activity
在回归模型中,概率值P越小,说明相对应的因素其显著性越高[22]。从表4的回归模型方差分析结果中可知,本模型的P值小于0.000 1,表示该回归模型显著性较好,在试验研究范围内拟合程度较高。复相关系数R2=0.988 1,表明DPPH自由基清除率的实际测定值与模型预测值拟合较好;校正决定系数Adj-R2=0.972 9,表明DPPH自由基清除率的97.29% 的变化可以用该模型进行解释。一般而言,变化系数CV值越小,说明试验的精确度越高,本模型中CV值为3.31,说明该模型的精确度较好。综上所述,该模型可以有效地用DPPH自由基清除率为目标进行碱性蛋白酶酶解工艺的优化。
2.1.2 以水解度为目标的响应面结果分析
本试验研究利用Design-Export 8.0.6软件对表3中的试验数据进行多元回归拟合,最终得到的回归分析结果如下表5中所示。

表5 以水解度为目标的回归分析结果Tab.5 Regression analysis results aimed at the degree of hydrolysis
从表5的回归模型方差分析结果中可知,本模型的P值为0.010 7(<0.05),表示该回归模型显著,在试验研究范围内具有一定的拟合程度。复相关系数R2=0.894 1,说明水解度的实际测定值与模型预测值拟合较好;校正决定系数Adj-R2=0.757 9,表明水解度75.79%的变化可以用该模型进行解释。本模型中CV值为4.67,说明该模型的精确度好。综上所述,该模型基本可以用水解度为目标进行碱性蛋白酶酶解工艺的优化。
2.1.3 碱性蛋白酶最佳酶解工艺条件的确定
根据回归模型的分析,得到以DPPH自由基清除率为目标的各个影响因素的回归方程为:
Y1=41.558+5.305X1+2.270X2+0.190X3-0.265X1X2-2.498X1X3+0.075X2X3-7.389X12-4.889X22-4.434X32
式(3)
以水解度为目标的各个影响因素的回归方程为:
Y2=33.368 00+2.821 25X1-0.422 50X2+1.893 75X3+1.717 50X1X2+2.340 00X1X3-1.477 50X2X3-8.589 00X12-1.866 50X22+2.431 00X32
式(4)
式中X1表示料液比,X2表示酶添加量(U/mg),X3表示水解时间(h)。
根据响应面试验设计的分析结果和多元二次回归方程的分析,以DPPH自由基清除率为优化指标,得到的碱性蛋白酶最佳酶解工艺条件如下:料液比为1∶11.6、酶添加量为9.4 U/mg、水解时间为2.9 h,将此条件代入预测模型,得到在该条件下 DPPH自由基清除率预测值为39.70%,水解度预测值为37.21%。
为了验证模型预测的准确性和响应面优化试验的可信度,在料液比为1∶11.6、酶添加量为9.4 U/mg、水解时间为2.9 h的条件下,设置三组平行试验进行验证,具体结果如表6所示。实际测得的DPPH自由基清除率为40.23%,水解度为36.04%,在模型给出的范围:DPPH自由基清除率38.32%~41.09%,水解度33.66%~40.75%之内,证明该模型的预测分析可行,可用于最佳酶解条件的确定。

表6 最佳酶解工艺条件验证结果Tab.6 Verification results of optimal enzymatic hydrolysis process conditions
2.2 抗氧化肽的分级分离纯化
2.2.1 超滤分离纯化抗氧化肽
由表7可知,经超滤分离后,组分RSH-Ⅳ的DPPH自由基清除活性最强(62.82±0.36)%,表明其抗氧化活性相对较好。同时其他组分也具有一定的抗氧化活性,但各组分的抗氧化活性有所不同,与分子量大小有一定关系,其中低分子量的肽段即组分RSH-Ⅳ的DPPH自由基清除活性均高于其他组分,说明蓝圆鲹蛋白酶解产物中抗氧化活性最强的是小分子肽。
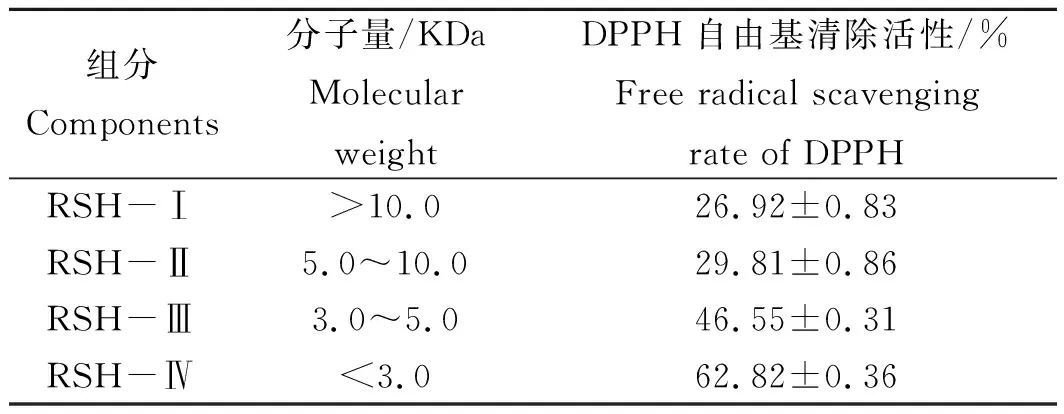
表7 超滤分离的4种组分的抗氧化活性Tab.7 Antioxidant activity of 4 components separated by ultrafiltration n=3
2.2.2 凝胶层析分离纯化抗氧化肽
由超滤实验结果可知,抗氧化活性最高的组分是经3.0 kDa的超滤膜超滤分离得到的组分RSH-Ⅳ,因此选用Sephadex G-25葡聚糖凝胶层析该组分进行进一步的分离纯化。综合考虑柱体积、柱压等相关因素[23],确定本实验的样品浓度控制在50 mg/mL,上样量为1.0 mL。分离结果如图1所示,主要收集到A、B、C和D 4个组分,分别测定各组分的DPPH自由基清除活性,结果如表8所示。

图1 超滤组分RSH-Ⅳ的Sephadex G-25凝胶柱层析分离Fig.1 Sephadex G-25 gel column chromatography separation of RSH-IV
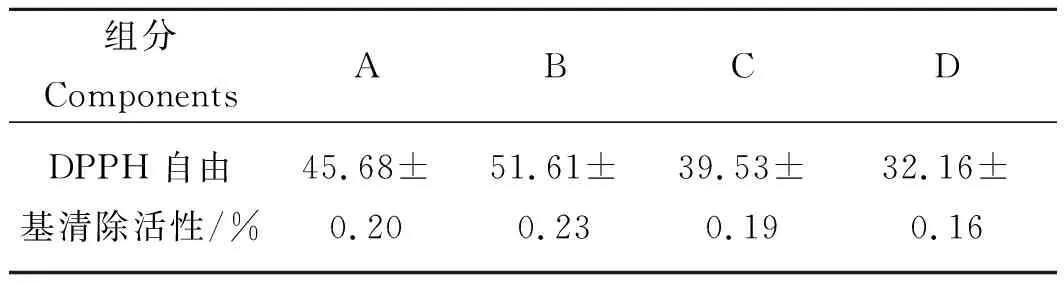
表8 凝胶层析A~D各组分DPPH自由基清除活性Tab.8 DPPH free radical scavenging activity of A, B, C and D components n=3
由表8可知,凝胶层析所得的A、B、C和D 4个组分均表现出不同程度的抗氧化活性,其中组分B的抗氧化活性最强约(51.61±0.23)%,说明酶解产物多肽中可能含有某些与自由基反应的电子供体,从而终止了自由基链式反应[24]。而其他3个组分的DPPH自由基清除能力的强弱顺序依次为A>C>D。因此,选择组分B进行分子量的测定。
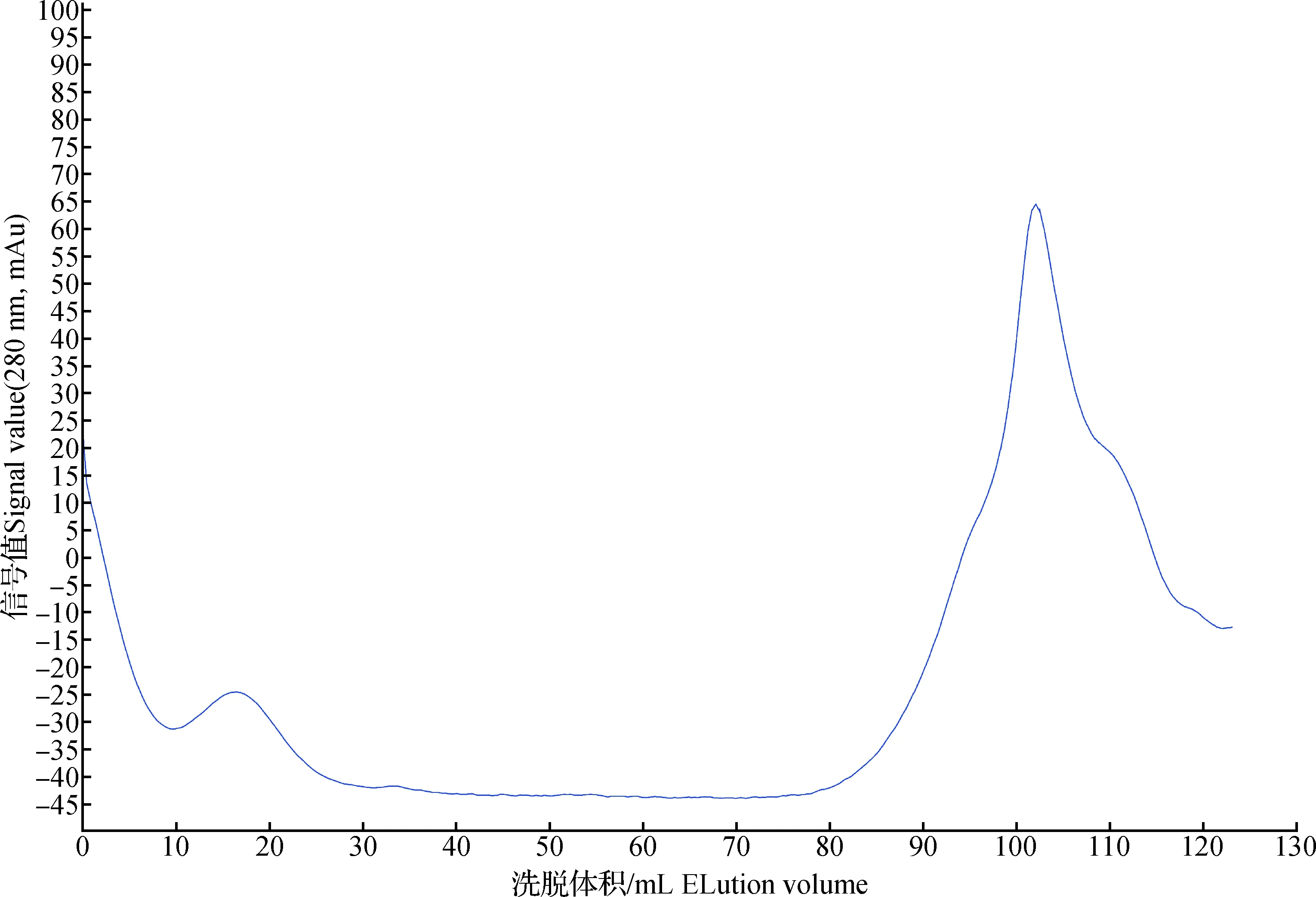
图2 Sephacryl S-100 HR洗脱曲线Fig.2 Elution curve of Sephacryl S-100 HR
2.2.3 GPC凝胶色谱测定抗氧化肽分子量
综合考虑组分B的分子量范围,采用低压GPC凝胶色谱柱(Sephacryl S-100 HR)对组分B进行分子量测定。当标准品的洗脱体积在0~120 mL的范围内时,洗脱体积与分子量的自然对数呈现出较好的线性关系,如图4所示。因此,标准曲线的方程为y=-0.079 5x+ 14.988,相关系数R2= 0.997 7。由图3可以看出,组分B经Sephacryl S-100 HR色谱柱洗脱后,洗脱体积约为105 mL,因此利用标准曲线计算可知,组分B的平均分子量大小为765 Da。说明蓝圆鲹水解产物中分子量处于此分子量附近的多肽具有较强的抗氧化活性。这与Park等[25]报道的分子量处于1 kDa以下的鳕鱼骨蛋白组分的抗氧化活性较强的研究结果相似。

图3 Sephacryl S-100 HR分子量测定标准曲线Fig.3 Standard curve of molecular weight determination for Sephacryl S-100 HR
3 结论
本实验对碱性蛋白酶酶促水解蓝圆鲹加工副产物制备抗氧化肽的酶解工艺进行了优化,确定最佳工艺条件为:料液比为1∶11.6、酶添加量为9.4 U/mg,水解时间为2.9 h。在此条件下,通过分离纯化试验,得到抗氧化活性最高的肽段,其DPPH自由基清除率高达51.61%,同时,测得其平均分子量为765 Da。由此表明,蓝圆鲹蛋白多肽中抗氧化活性较高的组分为小分子肽段,分子量集中在1 kDa以下。
在本实验的基础上,后续还可以对蓝圆鲹加工副产物的蛋白水解液展开更深入的研究。一方面,可以采用RP-HPLC对凝胶层析所得的抗氧化活性较高的肽段进行氨基酸序列分析,确定其氨基酸序列,进一步探究抗氧化活性肽与氨基酸之间的关系;另一方面,还可以利用蛋白水解液制备铁肽螯合物,为制备新型补铁剂提供基础理论研究。
