江苏典型养殖区斑点叉尾鮰中多种药物的残留与膳食暴露评估
2021-11-20徐志华孟勇杨洪生刘崇万耿雪冰葛筱琴朱晓华
徐志华,孟勇,杨洪生,刘崇万,耿雪冰,葛筱琴,朱晓华*
(1.江苏省淡水水产研究所,江苏 南京 210017;2.江苏省渔业产品质量安全重点实验室,江苏 南京 210017)
随着水产养殖规模扩大,高密度集约化养殖程度提高[1],鱼类疾病频繁发生,为防治疾病和促进生长[2],相关从业人员经常会使用磺胺类、四环素类、大环内酯类等抗菌药物,甚至硝基呋喃类、孔雀石绿类、氯霉素类、洛美沙星、培氟沙星、氧氟沙星、诺氟沙星等违禁药物[3-5]。在全球消费的抗生素中,50%以上用于动物,以治疗或防止感染并促进生长[6],2018年中国养殖使用的全部抗菌药总量为29 774 t,动物养殖每生产1 t动物产品使用兽药抗菌药量为140 g[7]。按兽用抗菌药类别计,目前使用量最大的为四环素类、β-内酰胺及抑制剂类、大环内酯类、酰胺醇类等。水产养殖中,投入的抗生素有20%~30%被鱼类等水产品吸收[8-10],通过走访发现部分养殖户滥用药物和不遵守休药期等现象时有发生,从而导致动物性食品中药物残留问题不断增多,鱼类作为人体的主要食物蛋白源,其体内富集的有害物质最终会通过食物链进入人体,进而危害人体健康[11],给消费者的食品安全带来安全隐患。
目前国内研究主要集中在水源地、养殖物及沉积物中抗生素残留的监测[12-15],对某个养殖区水产品兽药残留全年监测的少有报道。2019年,江苏斑点叉尾鮰(Ictaluruspunctatu)主养区的池塘精养面积约66.67 km2,产量达到1 400 t[16],本研究以江苏斑点叉尾鮰为研究对象,选取5个典型的养殖区(养殖面积大于1.67 km2),在一年内分3次(3月、7月及10月)选取1~2个池塘抽取鮰样品,跟踪监测6类37种药物残留,采用膳食暴露评估模型[17]对斑点叉尾鮰食用安全进行健康风险评价,为评价养殖区其产品的食用安全健康风险,受污染程度提供数据支撑。
1 材料与方法
1.1 仪器与设备
液质联用仪(QTRAP 4500,美国SCIEX公司;液相色谱 1290A,美国安捷伦);匀浆机(T18,德国IKA公司);离心机(AllegraTM,美国BECKMAN公司);浓缩工作站(Turbo Vap 瑞典Biotage公司);甲醇、乙腈(色谱纯,德国Merck公司);乙酸铵、甲酸、乙酸(色谱纯,美国ROE公司);乙二胺四乙酸二钠(分析纯,国药集团化学试剂有限公司);实验用水为Millipore系统超纯水;其他标准品及配制方法见表1。

表1 标准品及内标Tab.1 Standard substances and internal standard
1.2 样品采集、制备及前处理
1.2.1 样品采集
选取5个示范基地(见表2),根据苗种、成长期、成鱼期的生长周期分3次(3月、7月和10月)抽取同一池塘产品,每个养殖场根据池塘数采集具有代表性的样品,具体抽样信息见表2。
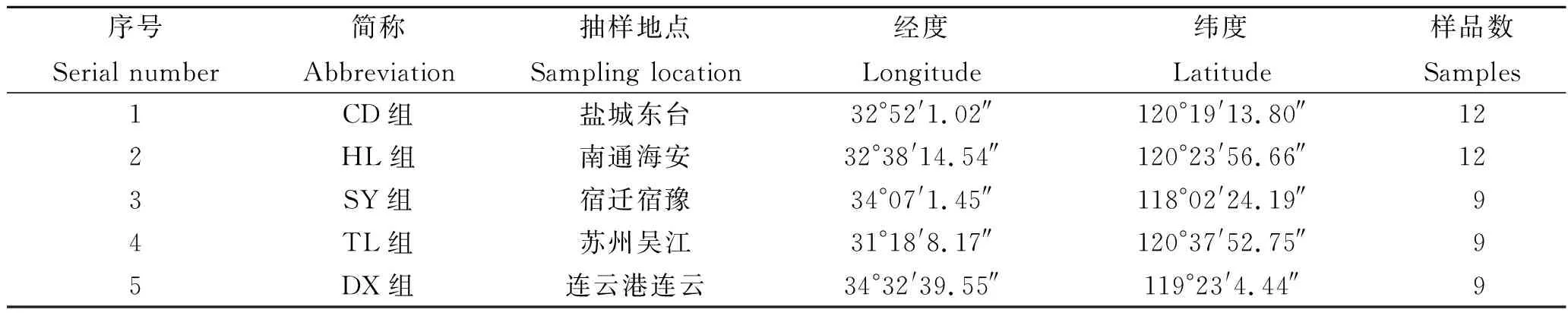
表2 抽样地点及经纬度Tab. 2 Sampling location and corresponding longitude and latitude
1.2.2 样品制备
每个点位抽取斑点叉尾鮰3条,取可食部分,用高速万能粉碎机打成匀浆,置于-20 ℃冰箱中冷冻贮存, 测定前将其室温解冻以供前处理使用。
1.2.3 样品前处理
大环内酯类前处理方法参照GB 31660.1—2019[18];氯霉素类前处理方法参照GB/T 20756—2006[19];硝基呋喃代谢物类前处理方法参照农业部783号公告—1—2006[20];孔雀石绿前处理方法参照GB/T 19857—2005[21]。
磺胺喹诺酮类前处理方法:称取2.0 g样品至50 mL离心管中,加入1.0 mg/L混合内标溶液50 μL,漩涡混合30 s。加入10 mL 0.1%甲酸-乙腈(9∶1,V/V)和0.1 g乙二胺四乙酸二钠,涡旋振荡、5 000 r/min离心10 min,取上清液。残渣中加入10 mL 0.1%甲酸-乙腈,用玻璃棒捣碎组织,重复提取一次,合并提取液。提取液用氮气吹干,残渣用1 mL的0.1%甲酸-乙腈溶解,加入2 mL正己烷,涡旋振荡、5 000 r/min离心10 min,然后移取下层溶液离心,取上清液经0.22 μm滤膜后上机测定。
1.3 仪器工作条件
喹诺酮类:色谱分析柱Agilent Poroshell EC-C18(100.0 mm×2.1 mm,2.7 μm);流动相为0.1%甲酸溶液(A)和0.1%甲酸乙腈溶液(B);柱温35 ℃;流速为0.3 mL/min;进样量10 μL。梯度洗脱程序:0~1 min,96% A;1~2 min,96%~85 %A;2~9 min,85%~75%A;9~15 min,75%~45 %A;15~16 min,45%~97 %A;16~20 min,97%A。电喷雾正离子电离模式(ESI+),sMRM-IDA-EPI检测模式;离子化电压5 500 V;离子源温度500 ℃;气帘气0.21 MPa;雾化气0.41 MPa;辅助加热气0.41 MPa。母离子、子离子、保留时间及去簇电压和碰撞能量等质谱参数见文献[22],方法灵敏度、准确度和精密度等参见文献[23]。其余仪器工作参数条件参照2.2相对应国标。
1.4 膳食暴露评估方法
本研究膳食暴露评估采用日允许摄入量(acceptable daily intake,ADI),通过食用水产品途径估算该抗生素的每日摄入量(estimated daily intake,EDI),并将EDI与ADI标准值比较(EDI /ADI),以此评估残留抗生素的膳食暴露风险。当EDI/ADI值≤1时,认为对人群膳食暴露评估风险水平在可接受范围内;EDI/ADI值>1,则说明存在不可接受的风险[17, 24-25]。EDI 可由式(1)计算得出:
式(1)
式中:C为水产品中某种抗生素残留量,μg/kg;C0为每天的人均消费量,kg;B为成年人平均体重,kg。
2 结果与分析
2.1 斑点叉尾鮰体内药物残留情况
在5个主要养殖区的鮰样品中筛查了6类目标物,分别为3种酰胺醇类、10种大环内酯类、6种喹诺酮类、12种磺胺类和4种硝基呋喃代谢物类、2种孔雀石绿类(具体参数见1.1)。根据农业农村部250号公告、2292号公告、GB 31650—2019,孔雀石绿类(孔雀石绿和隐色孔雀石绿)、硝基呋喃代谢物(呋喃它酮代谢物及呋喃妥因代谢物、呋喃西林代谢物及呋喃唑酮代谢物)、喹诺酮类(洛美沙星及培氟沙星、氧氟沙星及诺氟沙星)为停止使用的药物,其余几类目标物最大残留限量(maximum residue limit, MRL)和日允许摄入量见下表3,根据残留量,以MRL来判断该项目是否合格。

表3 水产品部分抗生素最大残留限量(MRL)和日允许摄入量(ADI)Tab. 3 Maximum residue limits (MRLs) and acceptable daily intake (ADI) values of some antibiotics in aquatic products
结果发现5个斑点叉尾鮰养殖区6类37种药物最大残留量总体合格率91.7%,硝基呋喃类代谢物、磺胺类及大环内酯类均未检出(小于检出限,视为未检出)。
酰胺醇类中氯霉素均未检出;甲砜霉素检出率8.33%,含量在ND~6.32 μg/kg,仅在CD组7月份检出,其余组均未检出,合格率100%,详见表4;氟苯尼考含量为ND~269.5 μg/kg(详见图1),根据表2,含量均在允许使用最大残留限量以下,合格率100%。分析5个组别氟苯尼考使用规律,在7月份5个组别鮰体内氟苯尼考均有检出,个别组别3月、10月份也有检出,检出率54.2%。从2002年开始所有可被人类食用的动物都禁止使用氯霉素,甲砜霉素、氟苯尼考作为氯霉素的衍生物,尤其作为安全高效杀菌剂药物在国内外畜牧和水产上迅速获得广泛应用[26],据王荣华等[27]近年来在预防和治疗斑点叉尾鮰肠道败血症时采用内服恩诺沙星和氟苯尼考的方法取得较好效果。结合养殖实际情况与查阅相关文献资料,该病的流行具有明显的季节性,每年的5~6月和9~10月是其流行季节[27-30],因此本次监测结果也印证了养殖户使用了此类药物,防治相关疾病。

表4 5个养殖区斑点叉尾鮰中6类药物(酰胺醇类、大环内酯类、喹诺酮类、磺胺类、硝基呋喃代谢物类和孔雀石绿类)合格率与检出率Tab. 4 Qualification rate and detection rate of six kinds of drugs (amide alcohols, macrolides, quinolones, sulfonamides, nitrofuran metabolites and malachite green) in Ictalurus punctatus from five aquaculture areas
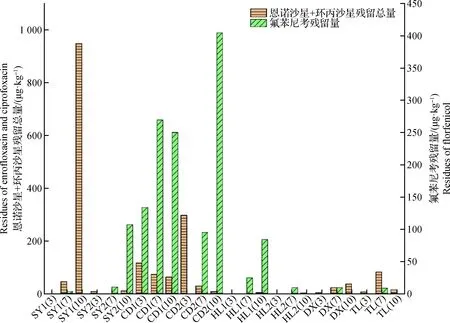
图1 5个养殖区斑点叉尾鮰中恩诺沙星和环丙沙星残留总量、氟苯尼考残留量注:SY1(3)表示养殖区SY1点位3月份,下同。Fig.1 Residues of enrofloxacin and ciprofloxacin and residues of florfenicol in Ictalurus punctatus from five aquaculture areasNote: SY1(3) means that the SY1 point in the breeding area is in March, the same below.
洛美沙星、培氟沙星、氧氟沙星及诺氟沙星4种停止使用药物均未检出,仅有恩诺沙星与环丙沙星被检出,含量范围在ND~948.0 μg/kg,其中恩诺沙星检出率75.0%,环丙沙星检出率25.0%,恩诺沙星及其代谢物环丙沙星仅在两个检测点SY1,CD2检测出,且超过最大残留限量100.0 μg/kg,分析C、D 两点为3月份检测出,在10月份最后一次未监测到,不影响成鱼上市。仅有SY1在10月份监测中检测超标,含量为948.0 μg/kg,说明养殖户使用了相关药物,该药物对动物感染性细菌疾病有良好的防治效果,广泛应用于水生动物疾病的预防和治疗[31]。根据盘家永等[32]对恩诺沙星在斑点叉尾鮰中的降解规律研究,表明斑点叉尾鲴对恩诺沙星的个体代谢能力极其显著,但是建议用药后一般需经过20 d 以上的休药期才能上市,以确保食用安全性。
2.2 膳食暴露评估
本试验中,由于只有喹诺酮类中恩诺沙星和环丙沙星、酰胺醇类中甲砜霉素和氟苯尼考检出,参照2.4计算公式,结合文献资料,B选用江苏成人体重为61.5 kg[33],C0根据江苏省统计局2019统计年鉴[34],取值5.38×10-3kg/d。经计算见表5,发现喹诺酮类EDI在0~8.29×10-2、EDI/ADI为0~1.34×10-2;甲砜霉素EDI为 0~5.35×10-4、EDI/ADI为0~1.07×10-4;氟苯尼考EDI 为0~3.54×10-2、EDI/ADI为0~1.18×10-2。3种抗生素EDI/ADI值均远远小于1,认为对人群膳食暴露评估风险水平在可接受范围内,说明几个养殖区养殖人员具有一定的科学用药意识,风险控制在可接受水平。但是需要注意此次健康风险评价,是根据消费者对食用鱼肉量来评估风险,但是日常生活中丰富的膳食结构,消费者在其他食物中也有可能摄入部分抗生素,如周偏偏等[35]研究发现某地鸡蛋样品中检出6种四环素,鸡肉样品中检出11种四环素。抗生素残留不仅对人体健康造成危险,在养殖环境中暴露及其潜在生态风险,也成为不可忽视的环境问题[14]。因此,与其他污染物产生的协同效应对生态环境的影响仍然需要被重视。下一步需加强对养殖环境污染的监测如养殖水、底泥,建立区域监测网络,从源头加大药物使用管理力度,评估食物链中的抗生素和耐药菌问题,降低风险,为引导消费和科学监管提供数据参考和科学依据,也为进一步推动斑点叉尾鮰养殖产业的健康绿色发展提供动力。

表5 5个养殖区斑点叉尾中喹诺酮类和酰胺醇类EDI及EDI/ADI值Tab.5 EDI and ADI values of quinolones and amide alcohols in Ictalurus punctatus from five aquaculture areas
3 结论
根据生长周期分3次(3月、7月和10月)对5个养殖区鮰样品中的6类药物(共37种)的残留状况进行了全年监控,仅有喹诺酮(恩诺沙星与环丙沙星)、酰胺醇类(甲砜霉素和氟苯尼考)检出,其余33种药物均未检出,合格率91.7%。甲砜霉素检出率8.33%,含量在ND~6.32 μg/kg;氟苯尼考含量范围ND~269.5 μg/kg,检出率54.2%,两种抗生素含量均在允许使用范围内。两个检测点位SY1、CD2恩诺沙星与环丙沙星总量超过限量要求,其余点位均合格,为确保食用安全性,建议SY1点位需经过20 d 以上的休药期再上市。
通过膳食暴露评估,喹诺酮类(恩诺沙星和环丙沙星)EDI/ADI为0~1.34×10-2;甲砜霉素为0~1.07×10-4;氟苯尼考0~1.18×10-2。3种抗生素EDI/ADI值均远远小于1,认为对人群膳食暴露评估风险水平在可接受范围内,说明几个养殖区养殖人员,具有一定的科学用药意识,风险控制在可接受水平。
