铁蛋白-AHLL纳米颗粒的稳定性及肠吸收研究
2021-11-19张韵晨方旭波李莹夏伟荣柴智冯进陈小娥
张韵晨 方旭波 李莹 夏伟荣 柴智 冯进 陈小娥

摘要:使用马脾铁蛋白包封降血压活性肽AHLL,通过紫外、荧光和圆二光谱研究AHLL荷载对HSF结构的影响。在此基础上,研究铁蛋白包封对AHLL稳定性以及体外胃肠道消化过程中血管紧张素转化酶(ACE)抑制活性的影响作用,并开展复合纳米颗粒(HSF-AHLL)的细胞转运试验。结果表明,AHLL载运显著降低了HSF的α-螺旋结构和β-转角结构,而β-折叠结构含量和无规卷曲含量增加,另外,包埋后HSF四重轴通道上的色氨酸微环境被改变。HSF-AHLL的热稳定性、pH稳定性和紫外稳定性明显高于游离AHLL。在模拟胃消化过程中,结合态与游离态AHLL的ACE抑制活性在胃液中下降明显,而在肠液中变化不明显。HSF-AHLL在Caco-2细胞上的转运试验具有一定方向性。吸收(AP→BL)大于外排(BL→AP),HSF-AHLL在Caco-2细胞单层膜上以细胞旁路转运为主,内吞抑制剂和肽载体抑制剂对HSF-AHLL的转运没有明显影响,而脱氧胆酸钠能打开细胞间通路促进其转运;HSF-AHLL的转运与多药耐药蛋白抑制剂形成竞争性抑制,HSF-AHLL的转运对温度具有一定的依赖性,属于能量依赖型转运。
关键词:马脾脱铁铁蛋白,血管紧张素转化酶抑制肽;纳米粒;Caco-2细胞模型;转运
中图分类号:S188 文献标志码: A
文章编号:1002-1302(2021)20-0194-07
收稿日期:2020-12-12
基金项目:食品科学与技术国家重点实验室开放课题(编号:SKLF-KF-201712)。
作者简介:张韵晨(1996—),女,新疆克拉玛依人,硕士研究生,研究方向为水产品加工与贮藏。E-mail:rhymezyc@163.com。
通信作者:方旭波,博士,教授,主要从事水产品加工与贮藏研究,E-mail:fxb70@163.com;李 莹,博士,副研究员,主要从事食品营养与健康研究,E-mail:hijoly@163.com。
本試验所用的ACE抑制肽AHLL在前期的研究中已证明发现它可以有效抑制ACE活性,在原发性高血压大鼠上具有一定降血压效果[1]。但由于AHLL较不稳定,容易被消化道里的胃蛋白酶、胰蛋白酶降解,从而影响ACE的抑制活性[2],机体对活性肽AHLL的吸收随之也受到影响。铁蛋白结构中包含氢键、盐桥和疏水作用力[3],但是,单独用作纳米载体时易受外界环境、pH值和温度变化等影响。以往对铁蛋白的研究中,它作为纳米载体对铁蛋白表面进行修饰,利用其特有的结构广泛应用在材料学、纳米学[4-5]等方面,铁蛋白经过脱铁处理后可包裹特定的活性负载物并对活性负载物起到靶向输送的作用,这一方法已经在生物医药领域得到应用[6]。铁蛋白脱铁后变化为特殊的空腔结构,小分子物质可以通过自由扩散的形式进入空腔,通过非共价键结合的作用力附和在铁蛋白的空腔里。铁蛋白包埋技术已经很成熟,但由于对包载物质的分子量有要求,因此包埋率较低。铁蛋白壳具有高度保守的二级结构和三级结构,80 ℃高温都不能使之变性的特性,亚基之间的氢键和疏水作用力可以维持三、四级结构的稳定,运用可调控手段,使其解散又重组为铁蛋白分子纳米[7]。蛋白载体在胃酸大环境和胃蛋白酶的作用下会被降解[8],完整的运载体系在小肠吸收完成前就会被破坏,蛋白质载体的稳定性受到多种因素的制约。若运用多肽对蛋白载体进行修饰使其形成较稳定的复合纳米体系,能够稳定蛋白本身在不定pH和温度范围内的溶解性,抑制蛋白质出现大量聚集沉淀和失去稳定变性的现象[9]。另外,在胃酸的酸性大环境下,多肽通过包埋和静电吸引作用包被于铁蛋白的内部空腔结构中,阻止胃蛋白酶对其降解,进入小肠后,蛋白载体完成有效吸收,因此多肽和蛋白质可形成双重结构,协同改善运载药物的稳定性、吸收性和生物活性的长效发挥[10]。
1 材料与方法
1.1 材料与试剂
ACE抑制肽AHLL(纯度>99%),上海强耀生物科技有限公司;马脾铁蛋白,美国Sigma Aldrich公司;MOPS缓冲液,美国Amresco公司;27 mmol/L透析袋(分子量为14 000),美国biosharp公司;乙腈(分析纯),江苏汉邦公司;三氟乙酸,上海源叶生物科技有限公司;Transwel1细胞培养板(聚碳酯膜直径12 mm,孔径0.4 μm )、25 cm2卡氏细胞培养瓶,美国Corning公司;维拉帕米,MK-571,氧化苯胂,脱氧胆酸钠,美国Sigma公司;DMEM培养基(4.5 g/L D-葡萄糖)、胎牛血清、磷酸盐缓冲液、Hanks平衡盐溶液,美国Gibco公司。
1.2 主要仪器与设备
TGL-50WS型大容量高速离心机,巩义市宏华仪器设备工贸有限公司;FRQ系列小型超声波清洗机,杭州法兰特超声波科技有限公司;1260Infinity高效液相色谱仪,美国Agilent 公司;GI20体外模拟消化系统,澳大利亚Nutriscan公司;JASCO-810 圆二色谱仪,日本JASCO公司;Alpha-1900Plus紫外分光光度计,上海普元仪器有限公司;F-7000荧光分光光度计,日本Hitachi 公司;500型精密电子天平,意大利BEL公司;DK-8D电子恒温水浴槽,上海精宏实验设备有限公司;SpectraMax M5/M5e多功能酶标仪,美谷分子仪器(上海)有限公司;PLUS-E2-20TJ 实验级超纯水机,南京易普易达科技发展有限公司;二氧化碳恒温培养箱,日本SANYO公司;BHC-1300ⅡA/B2型微生物洁净安全柜,江苏净化设备有限公司;Millicell ERS-2电阻仪,美国Millipore公司。
1.3 试验方法
1.3.1 根据前期研究得出纳米粒的最优制备条件[11] 准确称取20 mg 的AHLL标品制得浓度为20 mg/mL的AHLL母液,放置于4 ℃保存。取 2 mL 浓度为2 μmol/L的蛋白溶液(5 mmol/L MOPS,pH值为7.0),用1 mol/L HCl调节溶液pH值至2.0,在室温环境下搅拌20~30 min,使蛋白逐步解离成单个亚基状态,放置于磁力搅拌器上一边搅拌一边缓慢滴加20 μL AHLL母液(20 mg/mL),使其终浓度为200 μg/mL,此时蛋白和AHLL的物质量之比为1 ∶200。在室温环境下搅拌20~30 min 后,用1 mol/L NaOH将溶液pH值调至7.4后立即放置于4 ℃层析冷柜中搅拌2 h以上。搅拌完成后用孔径为12 000~14 000 u的透析袋置于pH值为7.4的5 mmol/L MOPS溶液里进行透析处理,以除去游离泥鳅源高活性降压肽AHLL,透析期间每隔 4 h 换1次透析液,以此制得HSF-AHLL复合纳米粒。经检测空壳的HSF的粒径为19.62 nm,粒径分布均匀。载入ACE抑制肽后,HSF-AHLL纳米粒粒径增大至28.19 nm,HSF-AHLL和HSF表面都带负电荷,HSF的电位为-39.9 mV,HSF-AHLL的电位约-34 mV,载体铁蛋白浓度在1~2 μmol/L 之间,AHLL的终浓度在100~200 μg/mL范围内,可制备出包封率20.94%的稳定纳米粒体系。
1.3.2 圆二色谱分析 调节样品蛋白终浓度为1.2 μg/mL,扫描波长范围为200~280 nm,扫描温度25 ℃,每点扫描时间2.5 μs,样品池光程为10 mm,扫描速率是200 nm/min,扫描步长为0.5 nm[12]。平均扫描3次。
1.3.3 荧光光谱分析 调节纳米粒载体蛋白的终浓度为1.2 μg/mL。激发波长为280 nm,发射波长为285~500 nm,激发缝1 nm,发射狭缝5 nm[13]。对AHLL、HSF-AHLL进行全波长扫描[14]。
1.3.4 紫外光谱测定 控制纳米粒载体的蛋白终浓度为1.2 μg/mL。使用UV-6300紫外可见分光光度计对HSF、HSF-AHLL进行全波长扫描。
1.3.5 复合纳米粒温度稳定性的测定 将制备好的HSF、HSF-AHLL纳米粒溶液分别置于不同温度(60、70、80、90、100 ℃)的水浴锅中孵育1 h后取样,对照为游离的AHLL溶液。取样后用高效液相法测定AHLL的剩余含量。
1.3.6 复合纳米粒pH值稳定性的测定 调节HSF、HSF-AHLL纳米粒溶液pH值(2.0、4.0、5.0、6.0、7.0、7.4、8.0),磁力搅拌60 min和90 min后,用高效液相法测定AHLL的剩余量。
1.3.7 复合纳米粒紫外稳定性的测定[7] 将纳米粒溶液经紫外灯(20 W)照射24 h,期间每4 h取样,选用游离的AHLL溶液作对照。用高效液相法测定AHLL的剩余量。
1.3.8 复合纳米粒体外模拟胃肠消化反应 模拟胃消化[15],用盐酸(0.1 mol/L)将AHLL、HSF-AHLL溶液pH值调至2.0,水浴加热至37 ℃后,加入胃蛋白酶(加量比AHLL ∶胃蛋白酶=1 ∶20)在GI20体外模拟消化系统上恒温酶解2 h。模拟胃消化总时长120 min,于胃消化开始后30 min取样,取样间隔时间30 min,取样后立即放入沸水浴中灭酶10 min,测定经过模拟胃消化后的ACE抑制活性变化。模拟肠消化[16]:样品经过模拟胃消化2 h后,用NaHCO3(1.0 mol/L)调节体系的pH值至7.0。继续加热至37 ℃,加入胰蛋白酶(加量比AHLL ∶胰蛋白酶=1 ∶20),在GI20体外模拟消化系统上恒温酶解 2 h。在肠消化期间每隔1 h取样1次于沸水浴中灭酶10 min,测定样品的ACE抑制活性在肠消化结束后的变化情况。
1.3.9 ACE抑制活性测定方法[2,11] 取10 μL ACE溶液和10 μL样品不混合地加入96孔板中,然后加入150 μL预热过的底物(1.0 mmol/L FAPGG溶解于50 mmol/L Tris-HCl,pH值为7.5,包含 0.3 mol/L NaCl),使其開始反应。酶标仪升温至 37 ℃ 后立即放入96孔板,于340 nm检测吸光度,检测时间间隔为1 min,检测时长为20 min。空白对照为10 μL缓冲液(50 mmol/L Tris-HCl,pH值为7.5,包含 0.3 mol/L NaCl)。以吸光度(D340 min)为横坐标,检测时间为纵坐标绘制标准曲线,取10~20 min的斜率计算。
ACE抑制率=1-(D抑制剂/D空白)×100%。
1.3.10 探究HSF-AHLL在Caco-2细胞上的转运途径 当Transwell板上的Caco-2细胞的跨膜电阻>600 Ω·cm2、荧光黄表观渗透系数Papp<1.0×10-6 cm/s时,可进行细胞转运试验[7,17]。选用纳米粒HSF-AHLL(100-200 μg/mL)作为供液,HBSS(pH值=7.4)溶液作为接收液,考察 10 μmol/L Gly-Pro[18](肽转运载体竞争性抑制剂)、25 μmol/L氧化苯胂(内吞抑制剂)和 100 μmol/L 脱氧胆酸钠[19](旁路转运促进剂),对HSF-AHLL转运途径的影响。对于AP→BL转运:将0.5 mL样品加入AP侧作为供给池,同时BL侧加入1.5 mL空白HBSS作为接收池;对于BL→AP的转运:将1.5 mL样品加入BL侧作为供给池,AP侧加0.5 mL空白HBSS作为接收池,抑制剂加样量200 μL,每次取样150 μL,同时相应地补加 37 ℃ 150 μL空白HBSS溶液,转运时长为 120 min,所有试验都3次平行。样品中AHLL含量用高效液相法测定。
1.3.11 不同外排抑制剂对HSF-AHLL在Caco-2细胞上的转运影响 选用100 μmol/LP-糖蛋白抑制剂维拉帕米[20],50 μmol/L多药耐药蛋白转运时取AP侧转运液,测定转运液中的药物浓度。计算表观渗透参数(Papp)和PDR值。
根据以下公式计算表观渗透系数:
Papp=ΔQ/(Δt×A×C0) (cm/s)。
式中:ΔQ是累积转运量,为Δt内的转运量,单位mg;A是Transwell膜表面积,单位cm2;C0为加入Caco-2细胞模型的样品初始质量浓度,单位μg/mL。
表观渗透系数比PDR=Papp(BtoA)/Papp(AtoB)。
1.3.12 不同温度对复合纳米粒转运的影响:对于Caco-2细胞的转运试验同“1.3.10”节,分别于 4、37 ℃培养,计算AP→BL和BL→AP的表观渗透参数(Papp),分析温度对转运的影响。
2 结果与分析
2.1 HSF-AHLL纳米粒的结构表征
2.1.1 圆二色谱分析
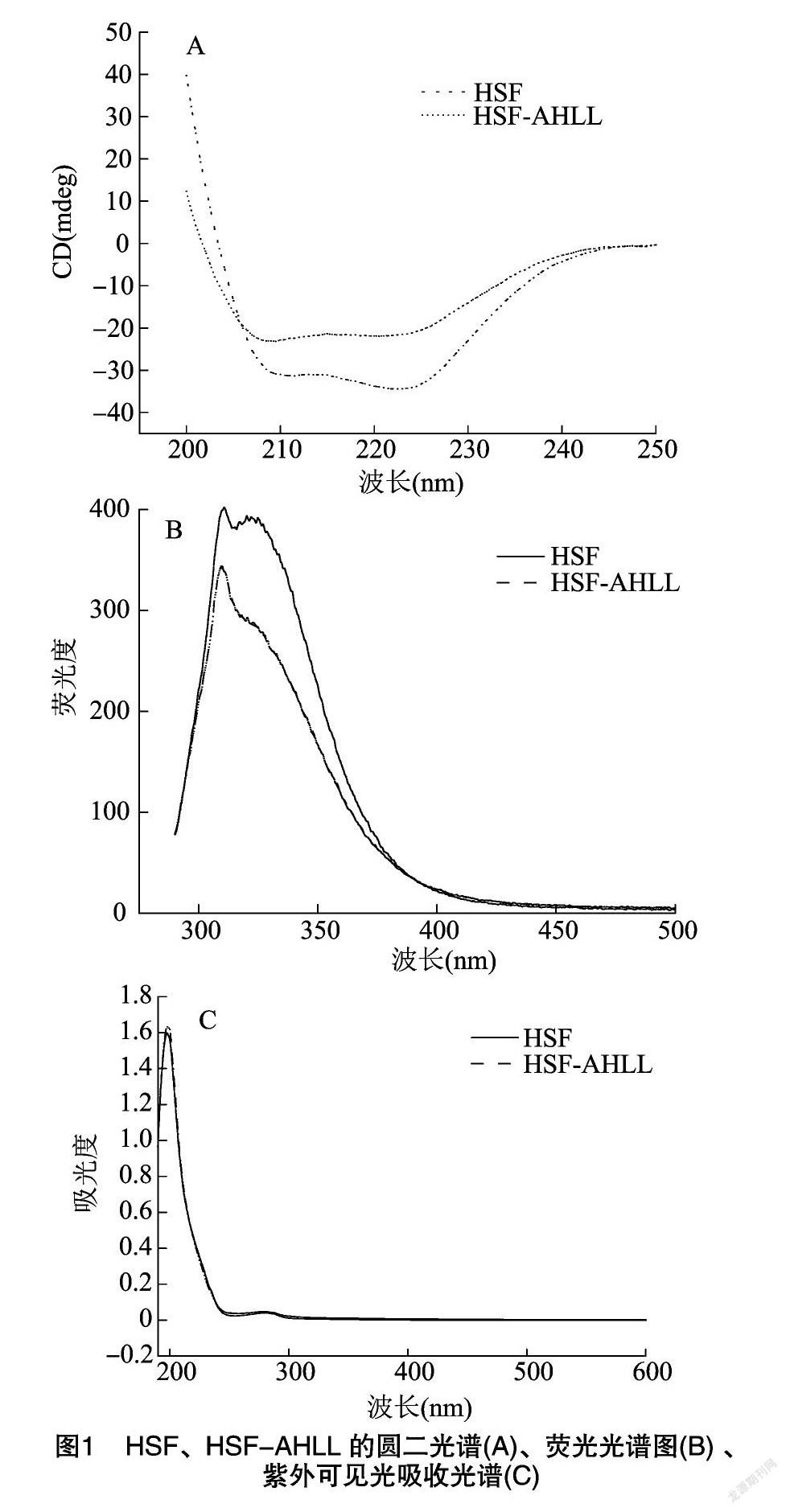
通过圆二色谱仪测定光谱区域范围在200~280 nm内的复合纳米载体的二级结构,以铁蛋白在此光谱区域的数值作对比,观察其变化情况。如图1-A可观察到HSF和HSF-AHLL在209.5 nm和218.5 nm有负的肩峰谱带;复合纳米粒HSF-AHLL在240~280 nm范围内的圆二光谱曲线与铁蛋白的光谱曲线几乎重叠在一起,说明AHLL通过静电吸引力作用被包埋进HSF的空腔内形成了复合纳米粒,包埋过程对铁蛋白的二级结构没有影响,HSF-AHLL纳米粒的圆二色谱特征肩峰谱带[21]在222 nm 和208 nm 处有出峰更能证明HSF-AHLL纳米粒具有α-螺旋结构,但与铁蛋白的二级结构存在差异。
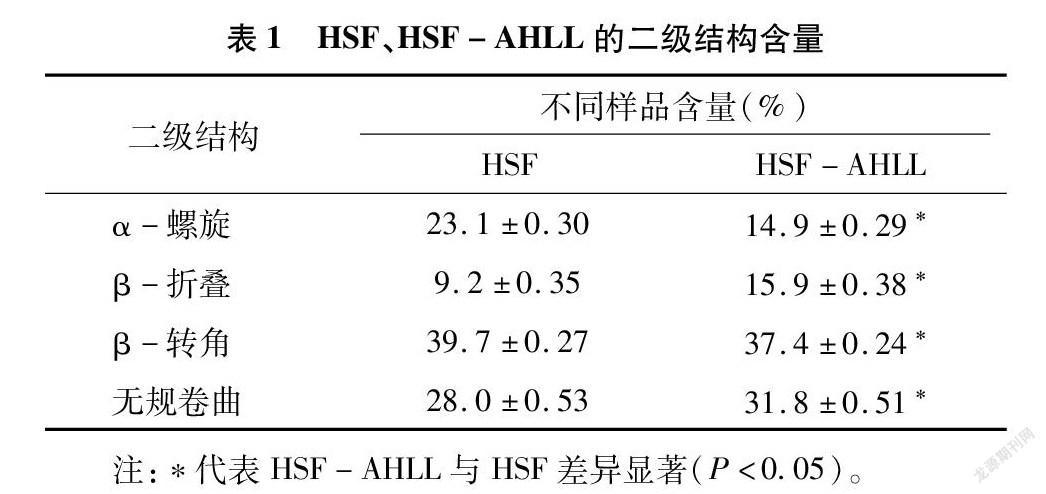
从表1可知,HSF-AHLL复合纳米粒的α-螺旋结构和β-转角结构含量比HFS有所降低,但 β-折叠结构含量和无规卷曲含量较HFS又有所增长。蛋白质分子α-螺旋结构的降低和 β-折叠结构的升高意味着蛋白质结构由规整向松散转化[22]。出现这种情况可能是因为经过包埋处理后蛋白质空间结构发生了一定的变化[11],蛋白的结构较包埋前更加延展。α-螺旋结构包含数量较多的氢键,整体紧密且没有空腔,而β-折叠结构较为无序,蛋白质结构的有序性与其某些功能性质是相关联的,β-折叠含量的增加有利于发挥蛋白质的某些功能性质[23],例如有利于增强蛋白质的柔韧性和扩展性。经过包埋处理后的HSF二级结构出现以上的变化,标志着HSF的整体分子构象从有序转化为无序,与之相对应的功能也随着分子构象的改变而变化。
2.1.2 荧光光谱分析
在以往研究中得知,色氨酸的典型发射曲线在激发波长为280 nm时出现[24]。利用荧光光谱分析复合纳米粒,如图1-B所示,在310 nm波长处附近产生内源荧光,由此可以推测铁蛋白中有色氨酸和络氨酸的存在。图1-B中复合纳米粒HSF-AHLL的内源荧光光谱强度在310 nm处发生了明显的变化,可能是发生了淬灭现象,可以推测,由于包埋处理导致铁蛋白四重轴通道上的色氨酸微环境有所改变。多肽AHLL与铁蛋白的静电结合,对铁蛋白的分子结构也存在些许影响。
2.1.3 紫外光谱分析
图1-C反映的是HSF、HSF-AHLL的紫外可见光吸收光谱。它们在近紫外区(190~350 nm)的紫外光谱几乎重叠,表现出相似的光谱特征。与文献[25]记载的最大吸收峰波长的出峰时间(212 nm和280 nm)基本一致。这种吸收峰的出现是由于铁蛋白中存在带有芳环的氨基酸残基而造成的,吸收峰的强度与蛋白的浓度变化成正比。根据光谱变化可以确定,复合纳米粒HSF-AHLL具有和铁蛋白类似的大分子共轭结构,并且AHLL通过包埋处理进入铁蛋白的空腔中,铁蛋白的表面性质没有受到改变。
2.2 HSF-AHLL纳米粒的稳定性分析
2.2.1 AHLL纳米粒的温度稳定性 由图2可知,
在不同温度下处理60 min,80 ℃处游离的AHLL降解了78.30%,而HSF-AHLL中的AHLL只降解了51.34%,其稳定性提高了26.96百分点。80 ℃之后游离的AHLL降解率变化有所缓和,但包埋处理后的复合纳米粒HSF-AHLL的降解率较AHLL而言普遍偏低。这一现象反映出复合纳米粒HSF-AHLL的热稳定性明显提高。由于铁蛋白具有非常稳定的结构,在中性条件下加热至80 ℃也不易变性[26],ACE抑制肽AHLL通过疏水作用力或范德华力与铁蛋白内部空腔结构中的氨基酸残基稳定结合,形成了HSF-AHLL复合物[11],铁蛋白的外壳相当于一层坚固的壁垒,起到隔绝温度和保护的作用,其空腔内部包裹着AHLL,在复杂的食品体系中可以减少AHLL与铁蛋白外部的小分子发生反应的概率,使AHLL更加稳定。
2.2.2 AHLL纳米粒的pH稳定性的影响
将制备好的HSF-AHLL纳米粒分别调pH值至2.0、4.0、5.0、6.0、7.0、8.0,置于磁力搅拌器上分别反应 30 min 和60 min,再将pH值还原至7.4,在反应期间取样测定AHLL含量变化。由图3可知,包封率在酸性和碱性环境下的变化明显,但在中性环境下相对稳定,可以推测中性环境最适于HSF-AHLL纳米粒的保存。出现此种现象的原因是铁蛋白自身特殊的结构特点,铁蛋白在极酸或极碱性环境下极易变性,发生变性的蛋白会逐个解离成单个亚基的状态,当pH值由极酸或极碱还原成中性时,铁蛋白会随之变化,恢复成稳定的球形结构。
2.2.3 AHLL纳米粒的紫外稳定性
如图4所示,AHLL和HSF-AHLL经过紫外照射后,24 h内游离的AHLL降解了87.28%,而HSF-AHLL包埋物中的AHLL降解了51.45%,其稳定性分别提高了35.83百分点。所以,经包埋处理后的复合纳米粒HSF-AHLL受紫外辐照后的降解率明显降低。
2.2.4 AHLL纳米粒的体外消化
图5所显示的是,AHLL和HSF-AHLL經过模拟体外胃消化1~3 h后进入肠消化4~6 h,产物的ACE抑制活性变化。在胃部消化过程中,游离AHLL的ACE抑制活性明显高于HSF包封的AHLL。一个可能的原因是,HSF将AHLL与外界环境阻隔,从而降低了其抑制活性。两者的ACE抑制活性在2 h后明显下降,预示AHLL在酸性环境下发生了降解,且游离态AHLL的下降幅度高于包封AHLL,可能与HSF的稳态化保护效果有关。当转移到肠液中后,两者的ACE抑制活性变化幅度不明显。
2.3 HSF-AHLL纳米粒在Caco-2细胞模型中的吸收机制
2.3.1 不同抑制剂处理HSF-AHLL在Caco-2细胞上的转运分析
细胞旁路转运、跨膜转运和肽载体介导的主动转运是物质跨肠上皮细胞转运的常见途径。本试验采用肽转运载体竞争性抑制剂Gly-Pro[18]、内吞抑制剂氧化苯胂和旁路转运促进剂脱氧胆酸钠[19]探讨HSF-AHLL的转运途径。从图6中可以看出,HSF-AHLL在经过Gly-Pro对肽转运载体竞争性的抑制和氧化苯胂对胞吞转运的抑制120 min后,浓度变化与空白组对照相比差异并不明显,而经过促进剂脱氧胆酸钠处理的AHLL和HSF-AHLL的含量较高,说明复合纳米粒 HSF-AHLL 在Caco-2细胞单层膜上的主要转运方式是旁路转运,脱氧胆酸钠属于胆酸盐类的细胞旁路转运促进剂,对溶解磷脂相对有效,有利于旁路转运[27]。当HSF-AHLL在Caco-2细胞单层上进行跨膜转运时,能有效地打开细胞通路从而促进其在Caco-2细胞单层的转运。
在AP侧或BL侧分别加入P-糖蛋白抑制剂维拉帕米[21]、多药耐药蛋白抑制剂MK-571[28]。Caco-2细胞AP侧存在2种主要的外排蛋白[11],即 P-糖蛋白和多药耐药蛋白,其主要功能是通过抑制消耗能量,把细胞中的营养物质排到细胞外,从而影响细胞自身对营养物质吸收。转运120 min后,加入维拉帕米的Papp(AtoB)值为(27.12±0.54)×10-6 cm/s,PDR为0.23。说明AHLL是P-糖蛋白的外排底物。加入MK-571的Papp(AtoB)值升高,Papp(BtoA)值没有明显的差异(图7),PDR值降低10%,证明HSF-AHLL的转运与多药耐药蛋白抑制剂形成竞争性抑制。
2.3.2 不同温度对复合纳米粒转运的影响
当转运温度从4 ℃变化为37 ℃时,复合纳米粒HSF-AHLL在Caco-2细胞单层的双向吸收变化情况如图8所示。转运温度为37 ℃时AP→BL和BL→AP 2个方向的AHLL浓度相较4 ℃时有所增加,Papp(AtoB)从(6.75±0.34)×10-6 cm/s上升到(25.29±0.63)×10-6 cm/s,Papp(BtoA)从(2.18±0.11)×10-6 cm/s 上升到(6.27±0.27)×10-6 cm/s,温度上升对HSF-AHLL在Caco-2细胞单层的转运起到了促进作用。温度扮演着能量依赖转运抑制剂的角色,温度降低减少了细胞代谢,反之温度升高细胞代谢也会增强,可以推测说明HSF-AHLL的转运对温度具有一定的依赖性,属于能量依赖型转运。
3 讨论与结论
从圆二色谱结果可知,经过包埋处理后AHLL通过静电吸引力作用被包埋进HSF的空腔内形成了复合纳米粒,包埋过程对铁蛋白的二级结构没有影响,蛋白质空间结构发生了些许的变化;紫外光谱结果说明复合纳米粒HSF-AHLL具有和铁蛋白类似的大分子共轭结构,并且AHLL通过包埋处理进入铁蛋白的空腔中,铁蛋白的表面性质没有受到改变;荧光光谱结果说明包埋处理改变了铁蛋白在四重轴通道上的色氨酸微环境。
不同温度处理60 min,HSF-AHLL中的AHLL只降解了51.34%,其稳定性提高了26.96%,HSF-AHLLL 较游离的AHLL热稳定性明显提高,HSF-AHLL纳米粒在中性环境的稳定性最好。
模拟体外胃肠消化说明,在胃酸的大环境下铁蛋白的亚基会打开,复合纳米粒HSF-AHLL进入消化系统后,ACE抑制率低于游离的AHLL经过体外消化后的抑制率;复合纳米粒HSF-AHLL在肠道的中性条件下能够稳定地保持继而被有效地吸收,ACE抑制活性明显提高。
HSF-AHLL在Caco-2细胞单层膜上以细胞旁路转运为主,内吞抑制剂和肽载体抑制剂对其转运没有明显影响,而脱氧胆酸钠能打开细胞间通路促进其转运。
HSF-AHLL的转运与多药耐药蛋白抑制剂形成竞争性抑制,HSF-AHLL的转运对温度具有一定的依赖性,属于能量依赖型转运。
参考文献:
[1]李 莹,曾晓雄,周剑忠,等. 泥鳅ACE抑制肽的体外活性研究[J]. 食品工业科技,2012,33(17):127-130.
[2]李 莹. 泥鳅蛋白源ACE抑制肽的酶法制备及其降压活性研究[D]. 南京:南京农业大学,2012.
[3]权 静,管增东. 马脾铁蛋白的应用研究[J]. 科技资讯,2015,13(24):214-215.
[4]Bradley J M,le Brun N E,Moore G R. Ferritins:Furnishing proteins with iron[J]. Journal of Biological Inorganic Chemistry,2016,21(1):13-28.
[5]Zhen Z,Tang W,Guo C,et al. Ferritin nanocages to encapsulate and deliver photosensitizers for efficient photodynamic therapy against cancer[J]. ACS Nano,2013,7(8):6988-6996.
[6]杨彩云,曹长乾,蔡 垚,等. 铁蛋白表面修饰及其应用[J]. 化学进展,2016,28(1):91-102.
[7]夏伟荣. 铁蛋白——海藻酸钠包埋ACE抑制肽及细胞吸收机制的研究[D]. 舟山:浙江海洋大学,2019.
[8]王 兴,黄忠明,王 莉,等. 苦荞蛋白模拟消化产物抗氧化活性及组成研究[J]. 中国食品学报,2009,9(6):10-15.
[9]Mounsey J S,OKennedy B T,Fenelon M A,et al. The effect of heating on β-lactoglobulin-chitosan mixtures as influenced by pH and ionic strength[J]. Food Hydrocolloids,2007,22(1):65-73.
[10]牛广财,朱 丹,王憲青,等. 南瓜籽油微胶囊稳定性与缓释性能的研究[J]. 粮油加工,2009(12):80-82.
[11]夏伟荣,李 莹,柴 智,等. 铁蛋白-海藻酸钠纳米包埋ACE抑制肽[J]. 食品科学,2020,41(8):77-82.
[12]杨 伟. 乳铁蛋白、EGCG和果胶三元复合物的形成机制及结构表征[D]. 北京:中国农业大学,2015.
[13]杨 瑞,田 婧,刘玉茜,等. 基于铁蛋白-壳聚糖制备芦丁纳米复合物及芦丁稳定性研究[J]. 中国食品学报,2017,17(9):58-65.
[14]吕凤娇,吴 洪,许小平. 荧光色谱测定纳米粒体系中阿霉素含量[J]. 宜春学院学报,2013,35(9):121-124.
[15]Cinq-Mars C D,Hu C,Kitts D D,et al. Investigations into inhibitor type and mode,simulated gastrointestinal digestion,and cell transport of the angiotensin I-converting enzyme-inhibitory peptides in Pacific hake (Merluccius productus) fillet hydrolysate[J]. Journal of Agricultural and Food Chemistry,2008,56(2):410-419.
[16]游丽君. 泥鳅蛋白抗氧化肽的分离纯化及抗疲劳、抗癌功效研究[D]. 广州:华南理工大学,2010.
[17]祝 倩,郭宇星,潘道东,等. Caco-2细胞模型构建及抗高血压肽VPP和IPP小肠吸收机制研究[J]. 食品科学,2014,35(15):226-231.
[18]Enjoh M,Hashimoto K,Arai S,et al. Inhibitory effect of arphamenine A on intestinal dipeptide transport[J]. Bioscience Biotechnology and Biochemistry,1996,60(11):1893-1895.
[19]Lo Y L,Huang J D. Effects of Sodium deoxycholate and Sodium caprate on the transport of epirubicin in human intestinal epithelial Caco-2 cell layers and everted gut sacs of rats[J]. Biochemical Pharmacology,2000,59(6):665-672.
[20]Nakagami T,Yasui-Furukori N,Saito M,et al. Effect of verapamil on pharmacokinetics and pharmacodynamics of risperidone:in vivo evidence of involvement of P-glycoprotein in risperidone disposition[J]. Clinical Pharmacology and Therapeutics,2005,78(1):43-51.
[21]Swift J,Wehbi W A,Kelly B D,et al. Design of functional ferritin-like proteins with hydrophobic cavities[J]. Journal of the American Chemical Society,2006,128(20):6611-6619.
[22]王明波,馮庆玲,佘振定,等. PLGA微球包埋药物的稳定性及释放研究的新进展[J]. 功能材料,2011,42(增刊4):591-595.
[23]李 晨. 基于糖基化反应的花生蛋白成膜性及其风味缓释效应的研究[D]. 无锡:江南大学,2015.
[24]李 青,梁艳红,孙 娟,等. 槲皮素与转铁蛋白相互作用的荧光光谱法研究[J]. 河北师范大学学报(自然科学版),2010,34(2):187-191.
[25]Xing R,Wang X,Zhang C,et al. Characterization and cellular uptake of platinum anticancer drugs encapsulated in apoferritin[J]. Journal of Inorganic Biochemistry,2009,103(7):1039-1044.
[26]Stefanini M,Fawcett H,Botta E,et al. Genetic analysis of twenty-two patients with Cockayne syndrome[J]. Human Genetics,1996,97(4):418-423.
[27]文爱东,蒋永培. 吸收促进剂在口服制剂中增强药物生物利用度的作用[J]. 国外医学(药学分册),2000(6):354-357.
[28]Haimeur A,Conseil G,Deeley R G,et al. The MRP-related and BCRP/ABCG2 multidrug resistance proteins:biology,substrate specificity and regulation[J]. Current Drug Metabolism,2004,5(1):21-53.
