波谱光照效应对西花蓟马趋光响应变化的影响
2021-11-19刘启航曹进军付晓伟武予清
刘启航 曹进军 付晓伟 武予清

摘要:为明确光致西花蓟马视响应效应特征及光致影响效应,获得蓟马光生物响应效应的致变因素,研制蓟马类害虫光推拉防控机具,在光源能量相同及增强条件下,测试西花蓟马对560、520、405、365 nm单光及其组合光的视响应变化,分析蓟马视响应效应变化的光照因素,探讨蓟马光响应影响机制。结果表明,单波长及组合波长光传导特异性光照强度(光照度及光能量),诱发趋光响应蓟马产生光适性、视趋性光行为特征,源于蓟马生物响应的光异质调控差异性,且波谱的光能刺激效应的影响性显著。光源能量相同,单光中蓟马对365 nm光的视响应敏感性最强而视滞敏感性最弱,组合光中蓟马对365 nm与520 nm光的视响应敏感性最强而对365 nm与560 nm光的视滞性相对最弱,单光中365 nm而组合光中365 nm与560 nm的光致视趋敏感性最优。光源能量增强,蓟马视响应及视滞敏感性单波谱光照强度发生变化,而组合光抑制蓟马视响应及视滞敏感性,560 nm光显著抑制而其余光增强蓟马视趋敏感性,且单光中365 nm光和组合光中365 nm与405 nm光增效性最强。光致蓟马的趋光性视响应中,35 mW/cm2下365 nm与520 nm光中敏感性最强、70 mW/cm2下365 nm光中次之,光致蓟马生物效应变化产生的应激效应引起光适性,且 140 mW/cm2 下365 nm与405 nm光调控性最弱而560 nm光致性最强,但发光生热效应是蓟马产生光趋近行为的诱因,且140 mW/cm2下365 nm光中蓟马趋近敏感性最强、365 nm与560 nm光中次之,源于波谱发光生热效应差异及光致蓟马生物效应的行为调节差异。本研究结果可为害虫灯光防控机具研制及昆虫趋光影响机制确定提供理论支撑。
关键词:西花蓟马;趋光生物响应;光致变化;波谱光能;调控影响
中图分类号: S763.37;S433.89 文献标志码: A
文章编号:1002-1302(2021)20-0124-08
收稿日期:2021-02-05
基金项目:河南省科技攻关项目(编号:212102110139);国家现代农业产业体系建设专项(编号:CARS-03)。
作者简介:刘启航(1978—),男,河南周口人,博士,副教授,主要从事农业害虫光机电一体化绿色防控技术研究。E-mail:bjliuqihang@163.com。
通信作者:武予清,博士,研究员,主要从事麦吸浆虫的物理防控技术研究。E-mail:yuqingwu36@hotmail.com。
西花蓟马(Frankliniella occidentalis)属缨翅目(Thysanoptera)蓟马科(Thripidae)花蓟马属(Frankliniella),是严重危害蔬菜、花卉等作物的入侵害虫[1]。西花蓟马个体微小,隐蔽性强,化学农药喷洒很难有效遏制其发生和蔓延,且易于引起其抗药性和对农药的适应,危害生态环境[2]。利用昆虫对敏感色谱的趋性,“黏虫板”技术已应用于蓟马害虫防治[3],但蓟马“色觉”从本质上讲是一种趋光性,相应促进了蓟马对波谱光照趋光响应效应的研究[4],以获得蓟马灯光防控技术。
在西花蓟马对色谱的敏感性研究中,Willem等研究认为,西花蓟马在选择开花植物时,花色而不是气味是主导因素;Teulon等验证了该结论[5-6]。Moffitt研究发现,西花蓟马对白色的趋性显著强于黄色[7],吴青君等测定表明,波长为438.2~506.6 nm 的海蓝色对西花蓟马的诱集效果最好[8]。因此,西花蓟马对色谱的适应性强、选择范围广。Matteson等依据在400~620 nm波段内测定的视网膜电位峰值显示,推测蓟马成虫光感受器类型包括绿、蓝和紫外3种[9]。但西花蓟马的趋光响应研究表明,它对特定的色光具有偏好选择性[10]。范凡等发现,西花蓟马趋光率较高的单色光波长为380、498、524 nm[11]。同时,西花蓟马对光的反应随光强增强而增强,日光低于1 000 lx或高于10 000 lx时无成虫活动[12],表明蓟马复眼对光强度有较强的自调节及适应机制,色光感受能力给其行为提供了良好的视觉保障[13],表明在短距离内西花蓟马对色光应激趋性的可操控性。另外,研究发现蓟马复眼中的感光细胞对紫外光谱波段(200~400 nm)敏感,并对400~405 nm紫光比较敏感,且紫外滤光膜抑制蓟马的生物活性[14-15],暗示了西花蓟马对紫外光的趋光敏感活性。然而,目前研究多集中于蓟马对黄、绿光照度的趨光响应性,而蓟马趋光敏感光照因素不明确,且波谱光照能量对蓟马趋光行为的调控效应鲜见报道。研究波谱光照能量对西花蓟马视响应的影响效应,具有害虫趋光本质研究的理论意义和灯光防控机具研制应用的实用价值。
本研究利用LED黄、绿、紫、紫外波谱光照和自制的蓟马视行为响应装置,测试光照能量下西花蓟马对单波谱及耦合波谱光照的视响应效应,确定西花蓟马光致特异性视响应影响因素,获得蓟马光行为调控性视敏参数,探讨光调控蓟马视响应效应的光致变影响机制,以期为蓟马类害虫视行为本质研究及害虫灯光诱导机具研制提供理论支撑。
1 材料与方法
1.1 试虫
西花蓟马采自河南省农业科学院蔬菜花卉示范基地内繁殖3~4代且羽化1~2日龄的健壮成虫。当天采集的雌成虫30头为1组,置于饲养小室(直径3.5 cm、高3.5 cm)内四季豆(Phaseolus vulgaris L.)叶片上,备多组并于试验前暗适应 30 min 作为试虫。针对雌成虫群体,2020年7月6—16日,在河南省农业科学院植物保护研究所天敌虫害研究室暗室内,于每天20:00—22:00时进行试验。试验温度为(27±1) ℃,相对湿度为(65±2.5)%。试虫每天采集,直至试验完成。
1.2 试验光源
购置3 W的LED共4颗,其峰值波长分别为 520 nm(绿)、560 nm(黄)、405 nm(紫)、365 nm(紫外)。由辐照计(型号:FZ-A,分辨率:±5%)标定光源辐照能量为35、70、140 mW/cm2。
1.3 试验方法
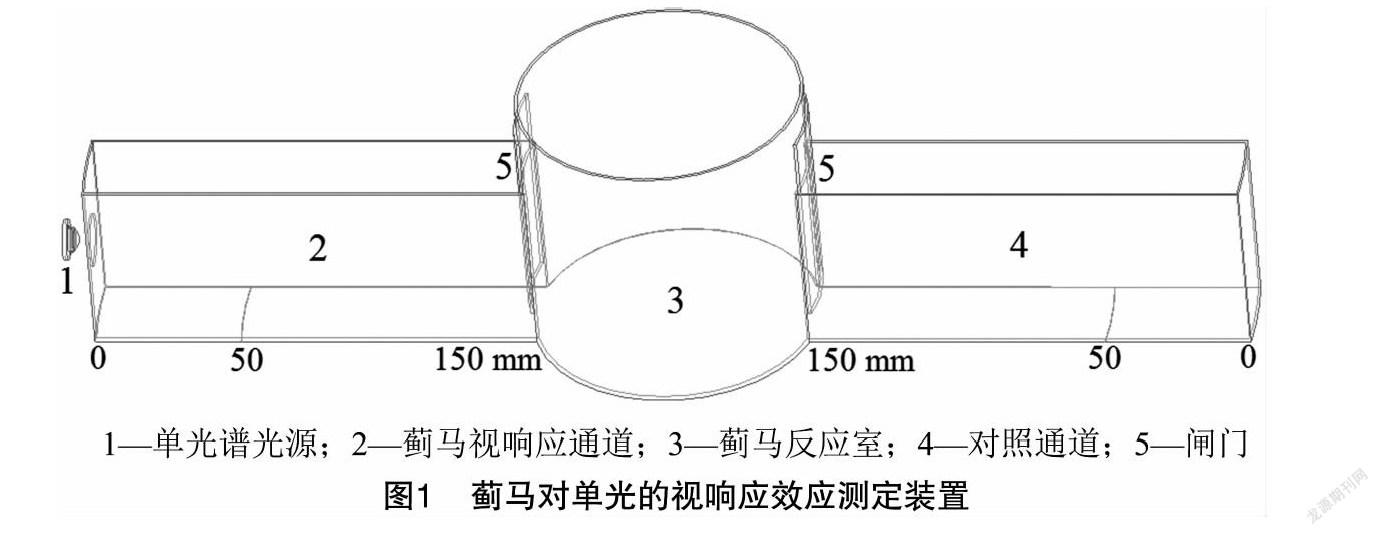
利用行为响应装置(图1),测试西花蓟马对单波谱光照的视响应效应。
装置由反应室(直径100 mm、高80 mm)以及与其连通的蓟马视响应通道和对照通道(二者长 150 mm×宽40 mm×高60 mm)组成,且通道与反应室由启闭闸门隔开。光源置于视响应通道前端,其照射光由中心孔入射通道内。通道区段(图2),分析蓟马的视响应变化效应。
针对每一波谱对应的每一辐照能量,各备3组(30头/组)试虫。试验前,布置光源并标定光参数,用毛笔刷引接30头试虫于反应室内。试验时,开启光源及闸门,针对3组试虫,依次测试每组试虫对相同波谱单一辐照能量的视响应效应。利用相同方法,测试完成每一波谱每一辐照能量对应的每3组试虫视响应效应试验。试验后,关闭光源及闸门,开启室内光源统计虫数,试验处理间隔及试验光照时长均设定为10 min。
利用行为响应装置(图2),测试西花蓟马对组合波谱光照的视响应效应。装置中,视响应通道(长100 mm×宽40 mm×高60 mm)和对照通道(长150 mm×宽40 mm×高60 mm)与反应室(直径100 mm、高80 mm)相连通,闸门隔开。视响应通道前端伸出夹角为30°的两臂,形成视选择通道1和2(长50 mm×宽40 mm×高60 mm)。2个光源置于两臂前端(光源辐照能量相同:35、70、140 mW/cm2),其光照各自由中心孔入射于视选择通道1和2中,并在视响应通道中形成耦合光照,且图示区段标示,以分析视响应蓟马的视敏变化效应。光源1与光源2的“V”形组合波谱为:黄与绿、黄与紫、黄与紫外、绿与紫、绿与紫外、紫与紫外。
针对每2组合波谱对应的每一辐照能量,各备3组(30头/组)试虫。利用试验1相同试验方法进行试验。试验处理间隔及统计记录同试验1。
1.4 数据处理与分析
利用视响应率(%)、趋近率(%)分别反映各波谱光照下3组蓟马在视响应通道0~150mm、0~50 mm内的分布均值与30头蓟马的百分比,分析各波谱光照中蓟马视响应敏感性、视趋敏感性(试验2中,分布均值分别为视选择通道1和2与视响应通道5内、视选择通道1和2内的均值)。计算视响应率与趋近率差值,取二者差值与视响应率的比值,利用滞留率(%)反映各波谱光照中视响应蓟马在50~150 mm内的视滞敏感性。试验2中,利用趋近选择对比率(%)反映3组蓟马在视选择通道1和视选择通道2中分布均值差与30头蓟马的百分比,分析视响应蓟马的趋近选择敏感性。利用辐照计及光照度计(Model:TES-1335,Resolving power:001 lx)测试视响应通道中50、150 mm 处的光照度(光照能量及光照度),计算 50~150 mm内的衰减差值及光源的电热(U×I×t),分析光参数及光源电热对蓟马视响应效应的调控影响。采用一般线性模型分析蓟马对各波谱光照的视响应效应(视响应敏感性、视滞敏感性、视趋敏感性、视选择敏感性),并采用差异水平α=0.05的LSD试验进行多重分析。试验数据采用 Excel 软件和 SPSS 16.0 数据处理系统进行统计分析。
2 结果与分析
2.1 西花蓟马对波谱光照的视响应敏感性
蓟马对单及组合光的视响应敏感性见图3,单及组合光源在150 mm处光照参数见表1、表2。
光源能量相同,单波长不同,150 mm处,365 nm光致能量最强、520 nm最弱(表1),且365 nm光中蓟马视响应率最高而520 nm光中最低(P<0.05:F35 mW/cm2=137.778;F70 mW/cm2=244.167;F140 mW/cm2=100.00)(图3-a),表明波谱光致能量强度显著影响蓟马视响应敏感性。单波长相同,光源能量不同,蓟马视响应率不同(P<0.05:F560 nm=26.60,F520 nm=11.40,F365 nm=9.00;F405 nm=18.20,P<0.05),且560 nm及520 nm 光中140 mW/cm2下蓟马视响应敏感性最强,405 nm及365 nm 光中35 mW/cm2下最弱、70 mW/cm2下最强(图3-a),源于560 nm及520 nm光照强度、405 nm及365 nm光致能量变化强度对蓟马感应敏感性的调控差异(表1),且 365 nm 光中 70 mW/cm2 下蓟马视响应敏感性最强(69.58%)。
光源能量相同,组合波谱不同,150 mm处,560 nm 与520 nm光致能量最弱而光照度最强,365 nm 与 405 nm 光相反(表2),而365 nm与 520 nm 光中蓟马视响应率最高,520 nm与560 nm光中最低、365 nm与405 nm光中次差(P<0.05:F35 mW/cm2=18.227;F70 mW/cm2=23.251;F140 mW/cm2=51.397)(图3-b),则组合波谱光照耦合强度差异抑制蓟马视响应敏感性。光源能量增至140 mW/cm2,組合波长相同,405 nm与560 nm及365 nm与 405 nm 光在150 mm处光照强度变化最强,而蓟马视响应率降低(P<0.05:F520 and 560 nm=7.80,F405 and 520 nm=7.01,F365 and 520 nm=10.86;P<0.05:F405 and 560 nm=18.20,F365 and 405 nm=25.73;P>0.05:F365 and 560 nm=1.88),且405 nm与 560 nm 及365 nm与405 nm光中,其差异性最显著(图3-b、表2),则蓟马视响应抑制程度与组合波谱光照强度变化程度有关,且365 nm与520 nm光中 35 mW/cm2 下蓟马视响应敏感性最强(71.81%)。
2.2 西花蓟马对波谱光照的趋近选择及视趋敏感性
单及组合光源在50 mm处的光照参数见表3、表4,蓟马对波谱光的趋近选择及视趋敏感性见图4。
光源能量相同,单波长不同,50 mm处,560 nm光照度最强、520 nm光次之,365 nm光致能量及光源电热最强(表3),而35 mW/cm2下520 nm光中、70及140 mW/cm2下560 nm光中趋近率最低,365 nm 光中最高(P<0.05:F35 mW/cm2=128.667;F70 mW/cm2=138.792;F140 mW/cm2=292.40)(图4-a)。光源能量增至140 mW/cm2,520 nm光照度、405 nm及365 nm光致能量强度变化较强(表3),而560 nm光中蓟马趋近率降低(P<0.01,F=31.857),其余光中提高(P<0.05:F520 nm=13.00;P<0.05:F405 nm=48.20,F365 nm=65.40)(图4-a),光源电热增强,加剧波谱属性的作用效果。结果显示,520 nm光照度抑制、405 nm及365 nm光能量强化蓟马视趋敏感性,经对比,140 mW/cm2下365 nm光中蓟马视趋敏感性最优(50.10%)。
光源能量相同及增强,两波谱耦合光照中,视响应蓟马对短波长光的趋近选择敏感性强于长波长,且35 mW/cm2下365 nm与520 nm光中、70 mW/cm2 及140 mW/cm2 下365 nm与560 nm光中对比率最高,两单光源电热及50 mm处光能量差别最大,而365 nm与405 nm光中对比率最低,光源电热及50mm处辐照能量差别最小(图4-b,表3),则蓟马在耦合光中的趋近选择敏感性与光源电热及波谱能量强度有关。
组合波谱不同,35 mW/cm2下365 nm与 520 nm、70 mW/cm2及140 mW/cm2下365 nm与560 nm光中趋近率最高且50 mm处能量均最强,520 nm与560 nm光中最低且50 mm处能量最弱(P<0.05:F35 mW/cm2=43.20;F70 mW/cm2=35.575;F140 mW/cm2=118.66)(图4-c、表4),且35 mW/cm2及140 mW/cm2下365 nm与560 nm、70 mW/cm2下365 nm与520 nm光源电热最高,则组合波谱能量强度决定蓟马趋近敏感性,而光源电热的调控增效性显著。光源能量增至140 mW/cm2,蓟马趋近率提高(P<0.05:F520 and 560 nm=20.46,F405 and 520 nm=12.20,F365 and 520 nm=18.60;P<0.05:F405 and 560 nm=195.0,F365 and 560 nm=158.33,F365 and 405 nm=195.0),且365 nm与405 nm光的增效性最强(19.49%)、365 nm 与560 nm光次之(13.91%)(图4-c),源于组合波谱光照强度耦合变化效应对蓟马趋近敏感性的调控差异(表4),而140 mW/cm2下365 nm与560 nm及365 nm与 405 nm 光中蓟马趋近敏感性较强(46.00%)。
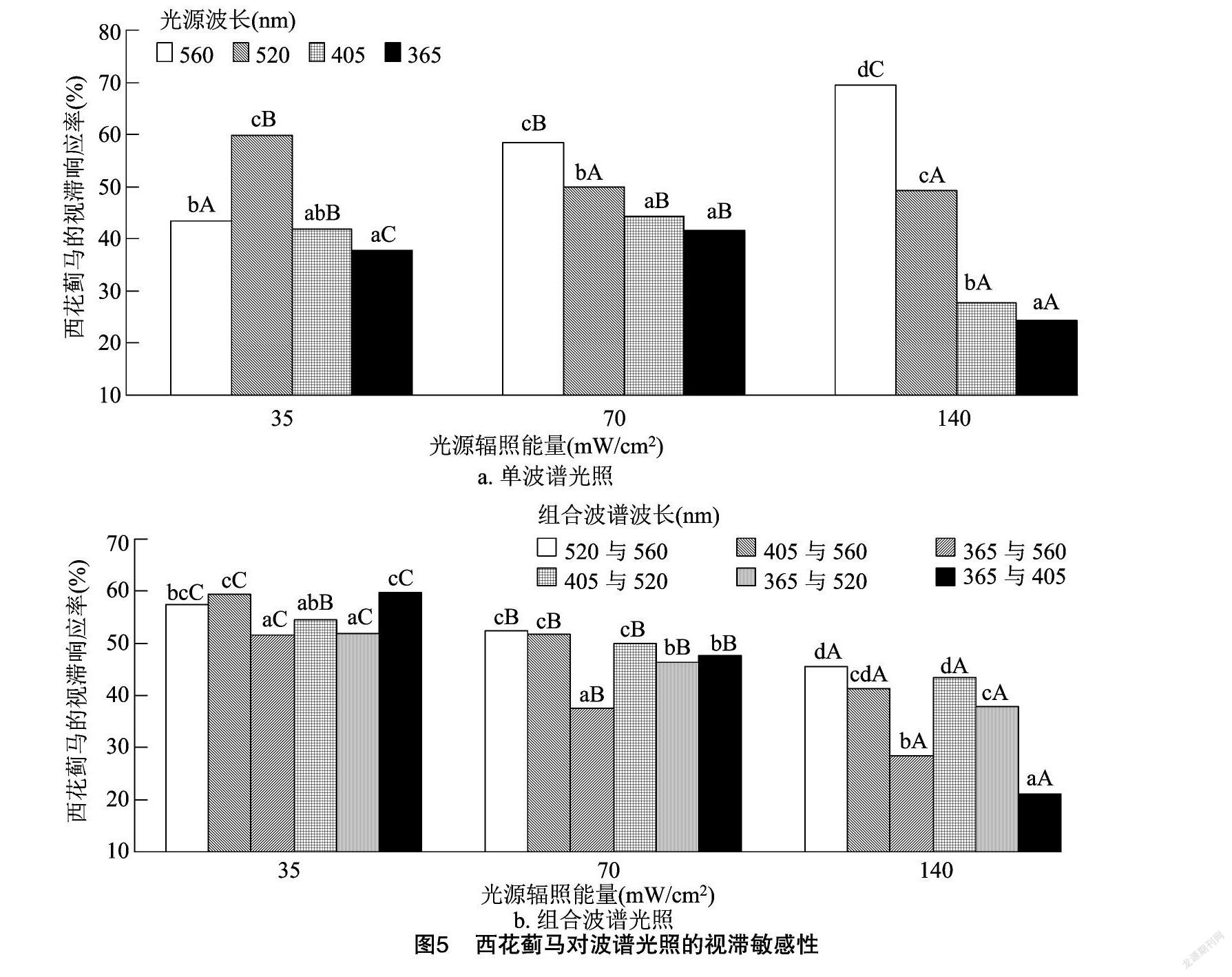
2.3 西花蓟马对单、组合波谱光照的视滞敏感性
单及组合光源在150 mm处的光照變化参数见表5、表6,蓟马对波谱光的视滞敏感性见图5。
波长不同,35 mW/cm2下520 nm、70 mW/cm2及 140 mW/cm2 下560 nm光中蓟马滞留率最高而光能变化最弱,365 nm光中滞留率最低且光能变化最强(P<0.05:F35 mW/cm2=28.547;F140 mW/cm2=141766;P<0.05:F70 mW/cm2=13.755)(图5-a、表5),则蓟马视滞敏感性与波谱光能变化强度有关。光源能量增至140 mW/cm2,560 nm光中滞留率增强(P<0.05,F=29.649)、520 nm光中降低(P<005,F=6.962)、405 nm及365 nm光中先增后降,源于波谱光照强度衰减变化差异,且140 mW/cm2下365 nm光中蓟马视滞性最弱(24.36%)。
组合波谱不同,35 mW/cm2及70 mW/cm2下365 nm与 560 nm 光中蓟马滞留率最低且其光能量变化最强、140 mW/cm2下365 nm与405 nm光中最低且其光照度变化最弱,而365 nm与560 nm光中滞留率相对最高且其光照度变化最强(P<0.05,F35 mW/cm2=10.213;P<0.05:F70 mW/cm2=11.794;F140 mW/cm2=67.22)。光源能量增至140 mW/cm2,蓟马滞留率降低,而365与405 nm光中降低最显著(P<0.05)且其光照度变化最强(图5-b、表6)。由此可知,组合波谱光照度、光能量传播变化强度分别强化、弱化蓟马视滞敏感性,经对比,140 mW/cm2 下365 nm与 405 nm 光中蓟马视滞性最弱(21.15%)。
3 结论与讨论
昆虫通过视觉系统接受光刺激后的活动行为类别和强度,取决于光信息的类型及其质和量[16]。
研究表明,色光强度影响西花蓟马的色觉选择敏感性,且LED波谱发光强度可使其产生特定的趋光响应活动[17]。本研究发现,LED波谱光照强度(光照度和光能量)的梯度变化效应影响西花蓟马光响应的视敏属性,对揭示昆虫趋光活动本质具有重要意义,为研发害虫防控新技术提供了理论基础。
利用光源防控害虫,目前侧重于光波长和光强度对昆虫视响应敏感性的调控效应,很少涉及波谱光照强度的光致影响效应[18]。本研究发现,光照能量相同,单光中365 nm光致敏感性最强且 150 mm 处光能量最强而光照度最弱,组合光中365 nm与520 nm光致敏感性最强、 520 nm与560 nm光致敏感性最弱且150 mm处光照度最强而光能量最弱,表明单波谱光能强度和组合波谱耦合属性影响蓟马视响应敏感性。光照能量增强,蓟马视响应敏感性与黄及绿光照度、紫及紫外光能量的调控性有关,并导致组合光抑制蓟马视响应敏感性。研究指出,昆虫应答光刺激作出的行为响应,与波谱光能刺激昆虫视觉系统产生的视反应电位强度有关,且UV敏感性和色光强度对抗性的作用显著[19],因此,35 mW/cm2下365 nm与520 nm光中蓟马视响应敏感性最强、70 mW/cm2下365 nm光中次之,表明紫外强度影响蓟马对520 nm及560 nm光的响应敏感性,源于单光与组合光的光致调控性生物光电效应差异。
已有研究从环境因素、光强度、昆虫生理状态探讨影响害虫趋光及上灯的原因[20]。本研究发现,波谱光照强度导致趋光蓟马产生视滞光适性、视趋上灯性行为变化响应,但光的调控作用导致蓟马视敏波谱选择性光照特性发生变化,其与昆虫行为反应中的光波长、光强度选择机制略有不同[21],可能是因为光照度与光能量的差异刺激效应,引起的光生物响应变化调节效应。蓟马视滞光适性结果显示,光照能量由35 mW/cm2增至70 mW/cm2,单光中520 nm光显著抑制蓟马视滞性且光照度变化最强,由70 mW/cm2增至140 mW/cm2,365 nm光抑制性最显著且光能变化最强,表明单光抑制程度与波谱光致性能量变化强度有关,而组合光中,365 nm与405 nm光抑制性最显著,560 nm与520 nm光中蓟马视滞性最强,其与两波谱耦合性光强度有关。
研究表明,昆虫光响应适应性功能与光致昆虫复眼变化效应、内源神经调控性自身状态有关,源于机体内部自发的调节变化或生理需要,导致昆虫对光产生自我调节适应性[22],因而,光致生物体产生的应激调控效应引起蓟马产生视滞光适性。但蓟马滞留视光性接受光照刺激将引起视状态、光能量在体内积累及体色素变化,能量流动将诱发蓟马产生光胁迫性生物效应变化性补偿响应。研究指出,光能够引起昆虫生物学特性发生变化[23],因此,蓟马视滞敏感性与光致蓟马生物效应变化的波谱光能强度调控性相关,140 mW/cm2下365 nm与 405 nm 光中最弱而560 nm光中最强,该结果与紫外光线强化蓟马光生物活性而黄光抑制昆虫生物学特性结果[24]相符。
蓟马视趋性结果显示,单光中,光源光照能量相同,波谱不同,光源电热(发光生热效应)及 50 mm 处光能量不同,且二者越强,蓟马视趋敏感性越强,表明波谱发光生热效应及光能影响蓟马视趋敏感性,而光照能量增强,560 nm光对蓟马视趋敏感性的抑制性最显著,365 nm光的强化性最显著。组合光中,光照能量增强,蓟马视趋敏感性增强,但相对365 nm光,组合光抑制性显著,且 520 nm 与560 nm光抑制性最显著,其光源电热及光致能量最弱而光照度最强,相对520 nm及560 nm光,组合光强化性显著,且405 nm与365 nm光强化性最显著,其光源电热及光能量最强而光照度最弱,表明组合波谱光照变化效应影响蓟马视趋敏感性。但 140 mW/cm2 下365 nm光中蓟马趋近敏感性最强、365 nm与560 nm及365 nm与405 nm光中次之,源自蓟马对组合光的趋近对比性视选择效应。
相关研究表明,热效应增效昆虫的光行为及生理生化响应活性[25]。本研究结果表明,光源光照能量越强,热效应越强,蓟马视趋敏感性越强,表明波谱光电热转换效应影响蓟马视趋敏感性。蓟马的视趋效应源自蓟马感应波谱光热因素产生的光趋近行为,但不同波谱耦合光照调控蓟马视状态产生的视敏辨识生物活性效应,影响蓟马的视趋活动强度。因此,波谱光致性光电热效应对蓟马光生物活性效应的调控性影响蓟马视趋敏感性。
参考文献:
[1]韩 云,唐良德,吴建辉. 蓟马类害虫综合治理研究进展[J]. 中国农学通报,2015,31(22):163-174.
[2]Wang Z H,Gong Y J,Jin G H,et al. Field-evolved resistance to insecticides in the invasive western flower thrips Frankliniella occidentalis (Pergande) (Thysanoptera:Thripidae) in China[J]. Pest Manag Sci,72(7):1440-1444.
[3]Kirk W D J.The aggregation pheromones of thrips (Thysanoptera) and their potential for pest management[J]. International Journal of Tropical Insect Science,2017,37(2):41-49.
[4]Shimoda M,Honda K I. Insect reactions to light and its applications to pest management[J]. Applied Entomology and Zoology,2013,48:13-21.
[5]Willem J K,Elisabeth H K. Thrips responses to plant odours. The 7th international symposium on Thysanoptera[C]. Reggio Calabria,2002,189-190.
[6]Teulon D A J,Hollister B,Butler R C,et al. Colour and odour responses off lying western flower thrips:wind tunnel and green house experiments[J]. Entomologia Experimentaliset Applicata,2010,93(1):9-19.
[7]Moffitt H R. A color preference of the western flower thrips,Frankliniella occidentalis[J]. Journal of Economic Entomology,1964,57:604-605.
[8]吳青君,徐宝云,张友军,等. 西花蓟马对不同颜色的趋性及蓝色粘板的田间效果评价[J]. 植物保护,2007,33(4):103-105.
[9]Rodriguez-Saona C R,Polavarapu S,Barry J D,et al. Color preference,seasonality,spatial distribution and species composition of thrips (Thysanoptera:Thripidae) in northern highbush blueberries[J]. Crop Protection,2010,29(11):1331-1440.
[10]Matteson N,Terry I,Ascoli-Christensen A,et al. Spectral efficiency of the western flower thrips,Frankliniella occidentalis[J]. Journal of Insect Physiology,1992,38(6):453-459.
[11]Kishi M,Wakakuwa M,Kansako M,et al. Action spectrum of phototactic behavior and compound eye spectral sensitivity in the yellow tea trips,Scirtothrips dorsalis Hood (Tysanoptera:Tripidae)[J]. Applied Entomology and Zoology,2014,58:13-16.
[12]范 凡,任红敏,吕利华,等. 光谱和光强度对西花蓟马雌虫趋光行为的影响[J]. 生态学报,2012,32(6):1790-1795.
[13]李江涛,邓建华,刘忠善,等. 不同颜色色板对西花蓟马的诱集效果比较[J]. 植物检疫,2008,22(6):360-363.
[14]Murata M,Hariyama T,Yamahama Y,et al. Effects of the range of light wavelengths on the phototactic behavior and biological traits in the melon thrips,Thrips palmi Karny (Thysanoptera:Thripidae)[J]. Ethology Ecology & Evolution,2018,30(2),101-113
[15]Yang J Y,Sung B K,Lee H S. Phototactic behavior 8:phototactic behavioral responses of western flower thrips,Frankliniella occidentalis Pergande (Thysanoptera:Thripidae),to light-emitting diodes[J]. J Korean Soc Appl Biol Chem,2015,24(2):15-20.
[16]Kigathi R,Poehling H M. UV-absorbing films and nets affect the dispersal of western flower thrips,Frankliniella occidentalis (Thysanoptera:Thripidae)[J]. Journal of Economic Entomology,2012,136(10):761-771.
[17]Kim K N,Huang Q Y,Lei C L. Advances in insect phototaxis and applicationtopestmanagement:Areview[J].PestManageScience,2019,7(28):118-126
[18]Liu Q H,Jiang Y L,Miao J,et al. Visual response effects of western flower thrips manipulated by different light spectra[J]. Int J Agric & Biol Eng,2019,12(5):110-116.
[19]Münch T A,Silveira R A D,Siegert S,et al. Approach sensitivity in the retina processed by a multifunctional neural circuit[J]. Nature Neuroscience,2009,12(10):1308-1316.
[20]Cao Y,Zhi J R,Li C,et al. Behavioral responses of Frankliniella occidentalis to floral volatiles combined with different background visual cues[J]. Arthropod-Plant Interactions,2018,12:31-39.
[21]Kleef J V,Berry R,Stange G.Directional selectivity in the simple eye of an insect[J]. Neuroscience,2008,28(11):2845-2855.
[22]Otani Y,Wakakuwa M,Arikawa K. Relationship between action spectrum and spectral sensitivity of compound eyes relating phototactic behavior of the western flower trips,Frankliniella occidentalis[J]. Applied Entomology and Zoology,2014,58:177-185.
[23]李 娜,范 凡,韓 慧,等. 不同波长LED光源对韭菜迟眼蕈蚊生殖行为的影响[J]. 昆虫学报,2016,59(5):546-551.
[24]Vorobyev M,Brandt R,Peitsch D,et al. Colour thresholds and receptor noise:behaviour and physiology compared[J]. Vision Research,2001,41:639-653.
[25]Liu Q H,Xin Z,Zhou Q. Visual reaction effects induced and stimulated by different lights on phototactic bio-behaviors in Locusta migratoria manilensis[J]. Int J Agric & Biol Eng,2017,10(4):173-181.
