玉米大斑病抗病QTL的鉴定与效应分析
2021-11-19田志强李志敏贾琳李雪迎赵萧笛杜文杰李政白磊
田志强 李志敏 贾琳 李雪迎 赵萧笛 杜文杰 李政 白磊
摘要:玉米大斑病是一种重要的真菌性病害,开展玉米大斑病的抗性遗传研究,对玉米抗病育种有重要的意义。以热带种质的抗病自交系CIMBL29为供体亲本,感病自交系GEMS41为轮回亲本,构建了含有179个家系的BC2F4群体。对该群体和亲本進行了2个环境的抗性表型鉴定,并结合高密度的分子标记遗传连锁图谱,对玉米大斑病抗性进行了QTL分析。结果表明,玉米大斑病抗性在群体家系间表现出广泛的变异;在2个环境条件下共鉴定了9个大斑病抗病QTL,分别位于第1、第2、第4、第5、第7、第9染色体上,可以解释5.2%~16.2%的抗性遗传变异。其中位于第1和第5染色体上的位点(qNLB1-1和qNLB5)在2个环境条件下均可以被检测到,可以认为是稳定的抗病位点。
关键词:玉米;大斑病;QTL;SNP
中图分类号:S435.13 文献标志码: A
文章编号:1002-1302(2021)20-0070-04
收稿日期:2021-07-22
基金项目:河南省教育厅高等学校重点项目(编号:20A210005、20A210019)。
作者简介:田志强(1976—),男,河南安阳人,博士,助理研究员,主要从事玉米抗病机制研究。E-mail:tt973@126.com。
通信作者:李志敏,博士,高级实验师,主要从事玉米抗病育种研究。E-mail:lzmzdb@126.com。
玉米大斑病是由大斑刚毛球腔菌Setosphaeria turcica引起的一种叶部病害。在自然条件下苗期很少发病,玉米抽雄后发病逐渐加重,严重时不仅可以侵染玉米的叶片,还可以危害玉米的苞叶和叶鞘,影响玉米的产量和品质[1]。在玉米生产上,抗病品种的推广和使用是有效控制玉米大斑病最经济有效的途径[2]。然而,近年来,随着耕作制度改变和病原菌小种变异等因素的影响,玉米大斑病的发生在我国又有回升之势,尤其在东北、华北北部等我国玉米主产区和西南高海拔地区冷凉山区较为严重,感病品种一般减产20%左右,严重时可减产50%以上[3]。
解析抗病遗传规律是进行抗病育种的基础。自20世纪60年代以来,国内外多个课题组开展了玉米大斑病抗病遗传基础研究,并鉴定出多个抗病基因位点。其中,已经报道的质量抗性基因包括Ht1、Ht2、Ht3、Htn1、Htm1、HtP、NNc和St等,这些抗病基因以显性单基因的方式,对特定病原菌小种产生专化抗性[4-5]。对这些抗病基因的进一步研究表明,Ht2、Ht3、Htn1均位于第8染色体上,3个抗病基因紧密连锁或属于同一抗病位点的不同抗病单倍型[6-7]。此外,还鉴定出质量性状抗病基因ht4和rt等,这些抗病基因以隐性抗病的遗传方式控制玉米大斑病的抗病性[8-9]。
与质量性状相比较,数量性状抗病性属水平抗性,可能对多个生理小种均有抗性。随着大斑病的病原菌生理小种分化变异[10-12],近年来,越来越多的数量性状抗性位点被鉴定出来[13]。采用连锁分析的方法,Nelson课题组在玉米第1染色体上鉴定到2个主效抗病位点(qNLB1.02和qNLB1.06)[14],以及玉米第8染色体的主效QTL(qNLB8.06)[15]。国内也有课题组鉴定出主效抗病位点的报道。这些抗病位点包括从抗病自交系Qi319中鉴定到的qNCLB7.02[16],以及从K22中鉴定到的qNCLB5.04等[17]。此外,利用巢式关联作图群体,Poland等共鉴定出29个QTL[18]。
近年来,含有热带亚热带血缘的材料在玉米抗病性的改良上日益受到抗病育种工作者的重视。本研究选用1份来自国际小麦玉米改良中心(CIMMYT)的热带玉米自交系CIMBL29为基础,解析其抗玉米大斑病的遗传机理,鉴定玉米大斑病的抗病位点,以期为抗病分子育种提供参考。
1 材料与方法
1.1 供试材料
本试验供试材料包括来自CIMMYT的热带抗病自交系CIMBL29和感病自交系GEMS41,以及以CIMBL29为供体亲本,GEMS41为轮回亲本,经过2次回交3次自交发展的包含179个家系的BC2F4群体。
1.2 田间试验设计
2017年在大斑病发病严重的吉林省榆树市(126.55°E、44.83°N),以及2018年在梨树县(12433°E、43.32°N)分别种植179个BC2F4群体家系和亲本。大田试验采用随机区组设计,2次重复。田间种植采用起垄单粒穴播方法,行长3 m,株距20 cm,行距为80 cm,每行种植14株,田间管理按照常规的生产管理方法进行。
1.3 抗病性鉴定
大田自然发病条件下,在玉米乳熟期后期调查叶片的发病程度。按照1~9级的分级标准对群体家系和亲本的大斑病抗性进行鉴定。其中,1级:高抗,几乎无病斑,仅有零星病斑,占叶面积小于 5%;3级:抗病,有少量病斑,面积小于10%;5级:中抗,叶片上病斑较多,相接连,占整株叶面积 11%~30%;7级:感病,叶片有大量病斑,占叶面积比在 31%~70%;9级:高感,整个植株叶片大于70%有病斑,枯死或整株枯死。
1.4 分子标记连锁图谱的构建和QTL作图
在玉米幼苗期,用CTAB法[19]提取179个群体家系和亲本的新鲜叶片总DNA。采用中玉金标记(北京)生物技术股份有限公司开发的9.4 k SNP芯片对群体家系和亲本基因型进行检测,筛选出在亲本和群体家系间表现出多态性的SNP标记;删除杂合度高(>10%)、缺失率高(>10%)的标记。然后利用完备区间作图IciMapping软件[20]进行遗传连锁图谱构建。操作步骤如下:用基因型“0”表示亲本CIMBL29的纯合带型;基因型“1”表示杂合带型;基因型“2”表示亲本GEMS41的纯合带型。采用IciMapping软件的“group”命令对标记进行分组,然后用“order”命令对每组标记进行排序,用“ripple”命令确定标记在染色体上的最优排列顺序。最后用IciMapping软件中的加性效应模型(ICIM-ADD)对群体效应进行评估并判定其显著性。
1.5 数据统计分析
对亲本和群体家系表型数据,采用SPSS 20.0软件进行统计分析,计算亲本和群体家系的平均值和标准差;大斑病抗性在所有环境下总变异按变异来源可分为环境变异和基因型变异。广义遗传力计算公式:H2=σ2g/(σ2g+σ2ge/n+σ2e/nr),式中:σ2g为基因型方差;σ2ge为基因型与环境互作的方差;σ2e为误差项方差;r为重复数;n为环境个数。
2 结果与分析
2.1 遗传连锁图谱的构建
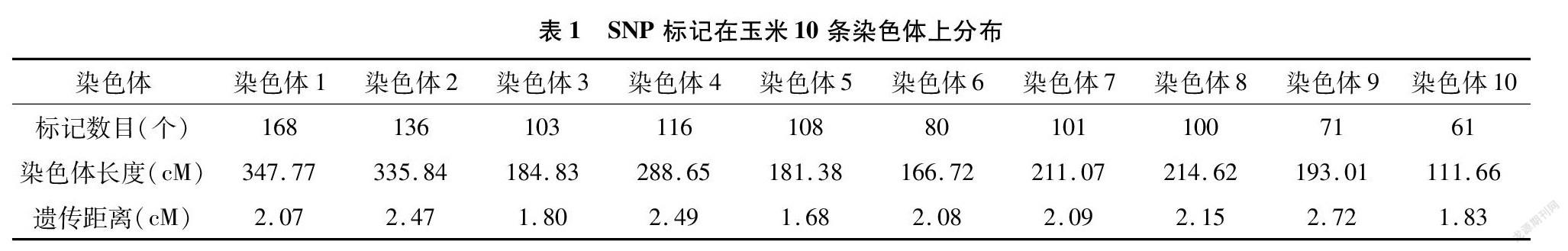
利用中玉金标记(北京)生物技术股份有限公司开发的9.4 k SNP芯片对作图群体179个家系和亲本基因型进行基因型检测,共筛选1 044个在亲本和群体家系间均表现出多态性的SNP标记。利用IciMapping作图软件进行了分子标记遗传连锁图谱的构建。由表1可见,1 044个标记分成10个连锁群,覆盖玉米10条染色体;遗传连锁图谱总的长度为2 235.55 cM,SNP标记间的平均间距为 2.14 cM。其中,第4染色体的SNP标记间的平均遗传距离最大,为2.49 cM;第5染色体的分子标记间平均遗传距离最小,为1.68 cM。从10条染色体上的标记数量来看,第1染色体上包含有最多的分子标记(168个);第10染色体上包含的分子标记最少(61个)。高密度遗传图谱的构建,为进一步开展抗病基因定位奠定了基础。
2.2 亲本和作图群体家系的大斑病抗性表型分析
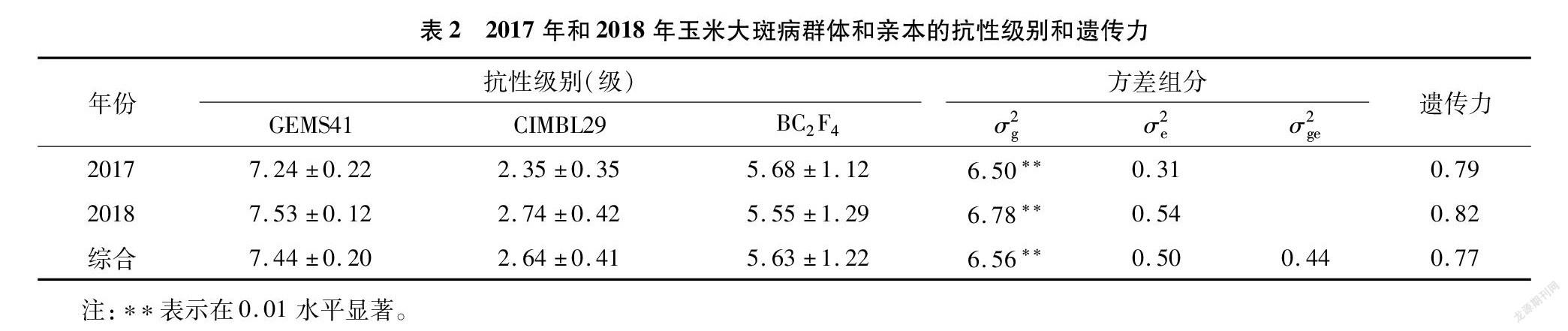
由表2可知,亲本GEMS41和CIMBL29在玉米大斑病抗性上呈现广泛变异。亲本CIMBL29 表现为高抗大斑病,在2017年和2018年的抗性级别分别为2.35级和2.74级,2年环境下的平均抗性级别为2.64级;而亲本GEMS41则表现为高感玉米大斑病,在2017年和2018年的抗性级别分别为7.24级和753级,2年环境下的平均抗性级别为7.44级。作图群体的179个BC2F4家系在大斑病抗性上也呈现广泛的变异,对2年的抗性表型做方差分析,结果表明,基因型对群体大斑病抗性的影响均达到极显著水平,基因型×环境互作对大斑病抗性的影响没有达到显著水平。2017年和2018年大斑病抗性的遗传力分别为0.79和0.82,2个年份的大斑病抗性的遗传力为0.77。BC2F4群体家系较高的遗传力,说明大斑病的遗传变异是由遗传控制的,为进一步开展抗病QTL定位奠定了基础。
2.3 玉米大斑病抗性QTL定位及基因效应分析
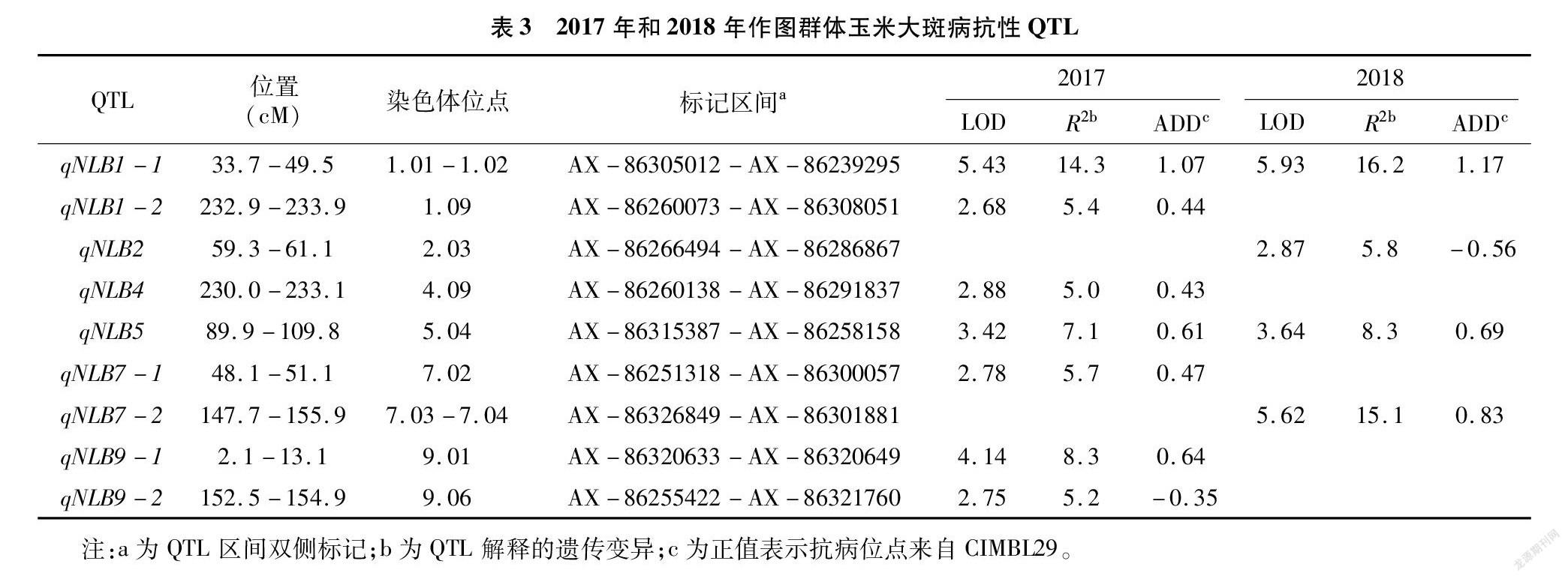
由表3可知,在2017年,共检测到7个抗病位点,分别位于玉米第1、第4、第5、第7和第9染色体上。其中第1染色体bin1.01-1.02区间检测到的抗性QTL(qNLB1-1)贡献率最大,可以解释14.3%的表型遗传变异,抗性效应为1.07。除了第9染色体上的qNLB9-2外,抗性位点均来自抗病亲本CIMBL29。在2018年,共检测到4个抗病位点,分别位于玉米第1、第2、第5和第7 染色体上。其中第1染色体的抗性QTL(qNLB1-1)有最大表型贡献率,可以解释16.2%的表型遗传变异,抗性效应为1.17。在所有检测到的QTL中,除了第2染色体上的qNLB2外,抗性位点均来自抗病亲本CIMBL29。
对2个环境综合分析发现,2个环境条件均在第1和第5染色体上检测到了抗性QTL(qNLB1-1和qNLB5)(图1),这2个QTL可以认为是稳定的大斑病抗性QTL。
3 讨论与结论
本研究采用BC2F4作图群体对玉米大斑病的抗病QTL进行了分析。相对于传统的重组近交系群体,BC2F4作图群体的开花期表型变异小,减少了开花期差异对抗性鉴定的干扰,保证了抗性表型数据采集的一致性和可靠性,为抗病QTL的定位奠定了良好的基础。此外,本研究利用高密度SNP标记构建的连锁图谱对玉米大斑病抗性进行研究,图谱标记密度高,作图分辨率高,提高了QTL作图的精度,并为后续的抗病基因精细定位奠定了很好的基础。
本研究在玉米第1、第2、第4、第5、第7、第9 染色体上共检测到9个大斑病抗性QTL,单个QTL的表型贡献率为5.2%~16.2%。其中,在第1和第5染色體上检测到稳定的抗性位点(qNLB1-1和qNLB5)。与前人结果相比,本研究结果有很多与其一致的地方, 如在第1染色体检测到稳定的抗性位点(qNLB1-1),Jamann等在此区域内发现1个编码植物抗病相关蛋白remorin基因(ZmREM6.3)[21]。本研究在第5染色体鉴定到稳定的抗性位点(qNLB5),Chen等在此区间定位到1个主效抗病位点[17];本研究在bin7.02及其相邻bin7.03-7.04区间检测到抗性QTL,Wang等在第7染色体 bin7.02 区间检测到稳定的主效QTL并对其进行了验证[16]。这些与前人研究结果一致的位点,说明了其大斑病抗性的稳定性,可以作为下一步精细定位和分子育种的重要位点。值得注意的是,本研究还在第1染色体bin1.09区间、第2染色体bin2.03区间、第4染色体bin4.09区间和第9染色体的不同区间分别检测到了抗性QTL,这些QTL位置与前人的研究结果不同,可以认为是新的玉米大斑病抗性位点。
参考文献:
[1]孙 滨. 玉米大斑病的发生及其综合防控[J]. 辽宁农业科学,2014(1):89-90.
[2]杨继良,王 斌. 玉米大斑病抗性遗传的研究进展[J]. 遗传,2002,24(4):501-506.
[3]弓 雪,陈 坤,刘亚利,等,玉米大斑病抗性机制及抗病育种研究进展[J]. 分子植物育种,2020(10):1-17.
[4]Welz H G,Geiger H H. Genes for resistance to northern corn leaf blight in diverse maize populations[J]. Plant Breeding,2000,119(1):1-14.
[5]Ogliari J B,Guimares M A,Geraldi I O,et al. New resistance genes in the Zea mays:Exserohilum turcicum pathosystem[J]. Genetics and Molecular Biology,2005,28(3):435-439.
[6]Yang P,Scheuermann D,Kessel B,et al. Alleles of a wall-associated kinase gene account for three of the major northern corn leaf blight resistance loci in maize[J]. The Plant Journal,2021,106(2):526-535.
[7]Hurni S,Scheuermann D,Krattinger S G,et al. The maize disease resistance gene Htn1 against northern corn leaf blight encodes a wall-associated receptor-like kinase[J]. Proceedings of the National Academy of Sciences of the United States of America,2015,112(28):8780-8785.
[8]Ogliari J B,Guimares M A,Camargo L E A.Chromosomal locations of the maize (Zea mays L.) HtP and rt genes that confer resistance to Exserohilum turcicum[J]. Genetics and Molecular Biology,2007,30(3):630-634.
[9]Carson M L.A new gene in maize conferring the “chlorotic halo” reaction to infection by Exserohilum turcicum[J]. Plant Disease,1995,79(7):717.
[10]張秀霞,高增贵,周晓锟,等. 东北地区玉米大斑病菌生理分化研究[J]. 华北农学报,2012,27(3):227-230.
[11]张明会,徐秀德,刘可杰,等. 我国玉米大斑病菌生理分化及小种分布研究[J]. 玉米科学,2011,19(4):138-141.
[12]王玉萍,王晓鸣,马 青. 我国玉米大斑病菌生理小种组成变异研究[J]. 玉米科学,2007,15(2):123-126.
[13]Pratt R C,Gordon S G.Breeding for resistance to maize foliar pathogens[J]. Plant Breeding Reviews,2006,27:119.
[14]Chung C L,Longfellow J M,Walsh E K,et al. Resistance loci affecting distinct stages of fungal pathogenesis:use of introgression lines for QTL mapping and characterization in the maize-Setosphaeria turcica pathosystem[J]. BMC Plant Biology,2010,10:103.
[15]Chung C L,Jamann T,Longfellow J,et al. Characterization and fine-mapping of a resistance locus for northern leaf blight in maize bin 806[J]. Theoretical and Applied Genetics,2010,121(2):205-227.
[16]Wang J J,Xu Z N,Yang J,et al. qNCLB7.02,a novel QTL for resistance to northern corn leaf blight in maize[J]. Molecular Breeding,2018,38(5):1-12.
[17]Chen G S,Wang X M,Long S S,et al. Mapping of QTL conferring resistance to northern corn leaf blight using high-density SNPs in maize[J]. Molecular Breeding,2015,36(1):1-9.
[18]Poland J A,Bradbury P J,Buckler E S,et al. Genome-wide nested association mapping of quantitative resistance to northern leaf blight in maize[J]. PNAS,2011,108(17):6893-6898.
[19]闫苗苗,魏光成,潘效红,等. 一种适用于动物与植物总DNA提取的方法——改良CTAB法[J]. 安徽农业科学,2008,36(20):8488,8558.
[20]Meng L,Li H H,Zhang L Y,et al. QTL IciMapping:Integrated software for genetic linkage map construction and quantitative trait locus mapping in biparental populations[J]. The Crop Journal,2015,3(3):269-283.
[21]Jamann T M,Luo X Y,Morales L,et al. A remorin gene is implicated in quantitative disease resistance in maize[J]. Theoretical and Applied Genetics,2016,129(3):591-602.
