被动游泳运动对小鼠抑郁样行为及其肠道菌群组成的影响
2021-11-19陈文迪张诗琪王亚楠李咏贤徐宏伟
陈文迪,张诗琪,王亚楠,李咏贤,刘 颖,徐宏伟*
(1.青岛大学医学部 临床检验技术专业,山东 青岛 266071;2.青岛大学医学部 基础医学院细胞与分子生物学实验室,山东 青岛 266071)
抑郁症是一种常见的精神障碍性疾病,我国的发病率约为4%[1]。该病患者具有极强的自杀倾向,给个人、家庭及社会均带来巨大压力和沉重负担[2]。因此,对抑郁症的深入研究成为人们关注的焦点之一[3]。被动游泳可诱发小鼠抑郁样行为[4],与酒精戒断、慢性不可预知轻度应激(CUMS)等诱导抑郁样行为的建模原理及方式不同,该模型属于“行为绝望”抑郁模型,对实验动物造成的损伤更为温和,与人类慢性、低水平应激源导致抑郁症的机理更为接近,因此成为抑郁症发病机理及药物防治理想的研究工具和实验手段[5-6]。研究显示,对于被动游泳小鼠,水温及持续时间等环境因素的改变对其抑郁样行为的形成产生重要影响[7];水质的不同也成为相关动物实验影响因素之一[8]。近年来的动物实验及人群研究均表明,“肠道微生物群-大脑轴”已作为一种潜在的脑功能失调病理生理机制参与自闭症、抑郁症、焦虑症等中枢神经系统疾病的发生发展[9-10]。因此,本研究拟通过在不同条件下的被进行游泳运动获得抑郁样小鼠模型;同时,采用16S rDNA高通量测序技术及实时荧光定量PCR(FQ-PCR)技术对小鼠肠道菌群进行系统的分子生态学分析,观察抑郁样行为小鼠肠道菌群结构及组成的特征性改变,并进一步探讨抑郁样行为严重程度与肠道菌群组成的关系。
1 材料与方法
1.1 材料
1.1.1 实验动物 SPF级6周龄雄性C57BL/6J小鼠由北京维通利华实验动物技术有限公司提供(SCXK(京)2016-0006),体质量约20 g,遗传背景明确。小鼠饲养于青岛大学附属医院实验动物中心(SYXK(鲁)2015-0003),各组小鼠自由进食和饮水,鼠房环境保持温度(22±2)℃,相对湿度50%~60%,12 h光照/黑暗交替。本研究获得青岛大学实验动物伦理委员会的批准(2018 审字第 02),并按实验动物使用的3R原则给予人道主义关怀。
1.1.2 主要试剂与仪器 蔗糖购自国药集团化学试剂有限公司(分析纯);脆弱拟杆菌(Bacteroidesfragilis,ATCC 25285)及嗜酸乳杆菌(Lactobacillusacidophilus,ATCC 11073)标准菌株冻干粉购自广东环凯微生物科技有限公司,4 ℃保存。粪便基因组DNA提取试剂盒、细菌基因组提取试剂盒及实时荧光定量PCR(FQ-PCR)检测试剂盒均购自QIAgen;Agarose Gel DNA Purification Kit Ver.2.0购自TaKaRa;淡水取自新鲜自来水;海水取自青岛沿岸近海海域,经4层滤纸过滤去除水中漂浮物。将自来水及经过滤处理的海水行0.22 μm滤膜过滤,作为小鼠游泳实验用水。玻璃泳槽(70 cm×50 cm×50 cm);紫外微量分光光度计(NanoDrop 2000,美国Thermo);PCR扩增仪(T100,美国Bio-Rad);电泳仪(DYY-6C,北京六一仪器厂);凝胶成像分析系统(UVP,美国);实时荧光定量PCR仪(Realplex4,德国Eppendorf)。16S rDNA高通量测序分析委托上海锐翌生物科技有限公司完成。
1.2 方法
1.2.1 模型建立与分组 35只6周龄雄性C57BL/6J小鼠,适应性喂养2周后,按体质量随机分为7组(n=5),包括正常对照组(A组)、室温(22±2)℃淡水15 min组(B组)、室温淡水5 min组(C组)、室温海水15 min组(D组)、室温海水5 min组(E组)、低温(8±2)℃淡水5 min组(F组)及低温海水5 min组(G组)。每日18:00时按以下方法对小鼠实施游泳运动:A组不游泳;B组于室温淡水中游泳15 min;C组于室温淡水中游泳5 min;D组于室温海水中游泳15 min;E组于室温海水中游泳5 min;F组于低温淡水中游泳5 min;G组于低温海水中游泳5 min。实验期间,用玻璃棒驱赶小鼠在玻璃泳槽中不停歇地游泳。实验结束后捞出小鼠并将其拭干(海水游泳小鼠采用淡水喷淋后拭干),放回饲养笼中。每周更换新鲜自来水及海水。实验持续16周,每周记录小鼠体质量变化。于16周末留取小鼠粪便,-80 ℃冻存,用于肠道菌群分子生态学检测;同时对各组小鼠进行行为学测试。
1.2.2 糖水偏爱实验 于实验第0周和第16周末分别进行糖水偏爱实验。本研究参照文献[11]报道的糖水偏爱实验方法并做了部分改进。为了消除小鼠对蔗糖溶液的恐惧,在正式实验开始之前,为每只小鼠提供2瓶0.8%(质量分数)的蔗糖溶液,持续饮用24 h。随后,随机将其中一瓶蔗糖溶液替换为自来水,继续饮用24 h。禁食禁水24 h后,进行糖水偏爱实验,即向每只小鼠分别提供1瓶0.8%(质量分数)的蔗糖溶液和1瓶自来水自由饮用12 h,并分别记录其初始瓶质量及第12小时末瓶质量。期间,于饮用第0.5小时和第6小时交换一次水瓶位置,以消除小鼠因位置偏好对实验结果的影响。
小鼠糖水偏爱度(%)=
1.2.3 强迫游泳实验 于实验第16周末进行强迫游泳实验。早7:00时将小鼠引入行为学检测实验室,以适应其安静且视野较暗的环境,2 h后开始强迫游泳实验,并在3 h内完成。将小鼠置于25 cm(高)×10 cm(直径)的圆柱形泳槽中,水深10 cm,水温(22±2)℃。实验持续6 min,记录最后4 min“不动”时间,即小鼠停止挣扎,仅靠四肢的轻微运动保持头部漂浮在水面以上的时间。本研究采用 SMART v3.0 软件,将小鼠“不动”的判定标准设置为运动速度小于 0.6 cm2/s,每隔 0.5 s记录一次。每次实验前,更换新鲜自来水,消除其对实验结果的影响。实验结束后捞出小鼠并将其拭干,放回饲养笼中。
1.2.4 粪便肠道菌群16S rDNA 高通量测序 称取小鼠粪便样品200 mg,采用粪便基因组DNA提取试剂盒获得肠道菌群基因组DNA,通过NanoDrop 2000紫外微量分光光度计和1% 琼脂糖凝胶电泳对其进行浓度及纯度质量检测。以质检合格的基因组DNA为模板,使用通用引物341F(5′-CCTACGGGRSGCAG CAG-3′)和806R(5′-GGACTACVVGGGTATCTAATC-3′),对其16S rDNA V3~V4区域进行PCR扩增,最终获得425 bp左右扩增片段。采用2%琼脂糖凝胶电泳分离PCR产物,切胶回收,并进行质检和定量。随后,通过Illumina Hiseq PE250平台对PCR产物进行多重测序,获得250×2 bp双端序列。采用PANDAseq软件组装原始序列,并按照以下质量控制标准进行过滤:原始序列长度在220~500 bp之间;最小平均质量值为20(Q20),最大含N碱基数为3。使用Usearch软件将上述优化序列中具有97%以上相似度的核苷酸序列进行聚类和嵌合体过滤,得到用于物种分类的操作分类单元(OTUs)。所有样本随机抽样至均匀深度后,提取各OTUs代表序列,通过RDP数据库进行比对,从而在门、纲、目、科、属水平对每个OTU进行物种归类和丰度分析,最小置信阈值为0.8;采用QIIME软件进行PCoA菌群多样性分析;采用LEfSe方法筛选具有显著差异(LDA>2)的关键物种。
1.2.5 粪便中拟杆菌及乳杆菌定量分析 ①引物设计与合成:参照Bernhard 等[12]报道的方法及脆弱拟杆菌和嗜酸乳杆菌 16S rDNA基因序列设计拟杆菌属及乳杆菌属特异性16S rDNA 片段PCR引物,并通过NCBI BLAST 基因库对引物序列特异性进行比对评价。各菌属16S rDNA PCR扩增片段特异性引物序列、产物长度及退火温度见表1。引物合成委托上海生工生物工程有限公司完成。②标准菌株基因组DNA提取:分别准确称取脆弱拟杆菌及嗜酸乳杆菌标准品50 mg,采用细菌基因组提取试剂盒提取基因组DNA,严格按照说明书操作,-20 ℃保存。③标准曲线制作:以上述脆弱拟杆菌及嗜酸乳杆菌标准菌株基因组DNA为模板,进行常规PCR反应,获得16S rDNA PCR片段扩增产物。反应条件:95 ℃预变性5 min;95 ℃变性30 s,最佳退火温度30 s,72 ℃延伸30 s,共30个循环;72 ℃ 延伸 10 min。以PCR产物进行1.0%琼脂糖凝胶电泳(电压80 V,电泳40 min)。将目的条带切胶、回收、纯化后,以紫外微量分光光度计测定其浓度,并换算为各标准品1 μL拷贝数的对数。将纯化的脆弱拟杆菌及嗜酸乳杆菌标准品16S rDNA PCR片段扩增产物做10倍系列稀释,使成为l×109~1×102拷贝/μL。以此为模板,在SYBR Green荧光染料的作用下,对各标准品进行实时荧光定量PCR(FQ-PCR)检测。反应条件:95 ℃预变性15 min;95 ℃变性10 s,最佳退火温度20 s,72 ℃延伸30 s,共50个循环。实验同时以ddH2O代替DNA模板作为阴性对照,标准品均设2个平行复孔。反应结束后,根据读取的荧光数据,由系统软件Eppendorf Mastercycler ep realplex自动分析各标准品初始循环数(Ct值),以此作为纵坐标,以各标准品初始拷贝数的对数作为横坐标,生成标准曲线。④大鼠肠道菌群中拟杆菌属及乳杆菌属定量检测:调整上述各组大鼠肠道菌群基因组DNA浓度为50~80 ng/μL,以此为模板,进行拟杆菌属及乳杆菌属16S rDNA实时荧光定量PCR反应。实验以标准品及ddH2O代替DNA模板作为阳性和阴性对照,每个样品均设2个平行复孔。获得Ct值后,通过上述标准曲线计算各样品拟杆菌属及乳杆菌属拷贝数。反应体系和反应条件与标准曲线制作相同。
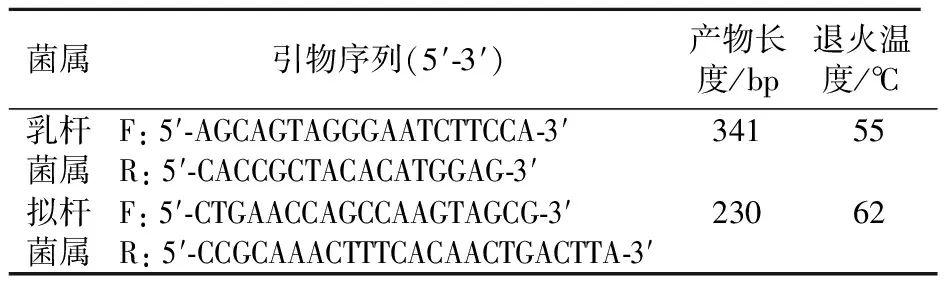
表1 各菌属16S rDNA PCR扩增片段特异性引物序列及退火温度

2 结果与分析
2.1 游泳运动对小鼠体质量的影响
结果显示,第1周至第8周,各组小鼠体质量均呈不同程度上升趋势;第8周开始至第16周,各模型组体质量均较正常对照组逐渐下降。D组小鼠的体质量下降最为明显,第16周末达到(20.5±1.6)g,较正常对照组(23.9±2.3)g下降了14.2百分点,差异具有统计学意义(P<0.05),见图1。

图1 各组小鼠体质量变化
2.2 游泳运动对小鼠行为学的影响
2.2.1 糖水偏好实验 结果显示,游泳运动之前,各组小鼠糖水偏爱度没有显著性差异(P>0.05)。游泳运动16周后,各模型组小鼠糖水偏爱度普遍降低,与正常对照组(A组,(80.4±8.3)%)比较,分别下降了6.3百分点(B组)、9.3百分点(C组)、20.1百分点(D组)、12.4百分点(E组)、9.4百分点(F组)及11.7百分点(G组)。其中D、F、G组糖水偏爱度与正常对照组比较,均具有显著性差异,尤其是D组小鼠糖水偏爱度降低幅度最大,且较F组具有显著性差异(P<0.05),见图2。
2.2.2 强迫游泳实验 结果显示,模型组小鼠不动时间分别较正常对照组(117.2±35.3)s延长了8.7百分点(B组)、14.6百分点(C组)、50.5百分点(D组)、24.7百分点(E组)、21.8百分点(F组)及27.4百分点(G组)。其中,D、E、F、G组不动时间与正常对照组比较具有显著性差异,且D组小鼠在各模型组中不动时间最长(P<0.05),见图3。
2.3 游泳运动对小鼠肠道菌群分子生态学的影响
2.3.1 粪便肠道菌群16S rDNA 高通量测序 ①Alpha多样性:采用Alpha多样性指数对小鼠肠道菌群测序深度、丰度和均匀度进行评估。物种累计曲线及goods coverage指数用于反映菌群测序深度,Chao 指数用于反映菌群丰度;Shannon指数则用于反映菌群均匀度。结果显示,物种累计曲线趋于平稳,同时各组样品goods coverage均超过99%,提示样品中绝大部分物种均被检测到,可用于后续分析。同时,各组间Chao指数及Shannon指数具有显著性差异(P<0.05),提示游泳运动使小鼠肠道菌群丰度及均匀度发生改变。见图4Ⅰ~Ⅳ。②Beta多样性:使用主坐标分析(Principal Coordinates Analysis,PCoA)展示各组样品间结构和组成方面的多样性差异。两个样品距离越近,则表示这两个样品的物种组成越相近,差异越小。结果显示,模型组小鼠与正常对照组之间物种多样性存在显著差异(P=0.014),同时Anosim相似性分析结果也显示,各组间菌群组成明显不同(R=0.332,P=0.001),提示游泳运动对小鼠肠道菌群多样性产生显著影响。见图4Ⅴ~Ⅵ。③物种组成分析:结果显示,各模型组小鼠肠道菌群从门水平到属水平的多个物种丰度较正常对照组具有显著差异。其中,室温海水游泳15 min小鼠(D组)肠道菌群的变化最为明显。如:与正常对照组比较,D组小鼠肠道菌群中拟杆菌在门(Bacteroidetes)、纲(Bacteroidia)、目(Bacteroidales)、科(Bacteroidaceae)、属(Bacteroides)水平的丰度分别增加了68.3百分点、67.5百分点、67.4百分点、34.9倍和14.2倍(P<0.05)。此外,普雷沃氏菌科(Prevotellaceae)及普雷沃氏菌属(Prevotella)丰度分别较正常对照组增加了4.5倍和6.1倍。而D组厚壁菌门(Firmicutes)、梭状芽胞杆菌纲(Clostridia)、梭状芽胞杆菌目(Clostridiales)、紫单胞菌科(Porphyromonadaceae)及乳杆菌属(Lactobacillus)丰度则较正常对照组分别显著减少了50.5百分点、53.9百分点、54.0百分点、39.4百分点和61.8百分点(P<0.05),见图5Ⅰ~Ⅴ。LDA EffectSize(LEfSe)分析结果进一步显示,模型组小鼠在门、纲、目、科、属水平有多个物种丰度与正常对照组存在显著差异(LDA>2),提示游泳运动使小鼠肠道菌群结构和组成发生特征性改变。其中,室温海水游泳15 min小鼠(D组)具有显著差异的物种最多,从门水平到属水平共有1个菌门、4个菌纲、4个菌目、7个菌科及10个菌属在该组富集。见图6。

图4 各组小鼠肠道菌群Alpha及 Beta多样性分析

图5 各组小鼠肠道菌群物种组成分析

图6 各组小鼠肠道菌群LEfSe分析图
2.3.2 粪便中拟杆菌及乳杆菌实时荧光定量分析 根据拟杆菌标准菌株Ct值及初始拷贝数获得拟杆菌属标准曲线回归方程为y=-4.007x+44.63(R2=0.998);乳杆菌属标准曲线回归方程为y=-3.112x+40.21(R2=0.988)。与正常对照组比较,模型组粪便中拟杆菌含量呈不同程度升高,而乳杆菌含量均较正常对照组减少。其中,D组拟杆菌及乳杆菌含量均较正常对照组具有显著性差异(P<0.01),见图7。
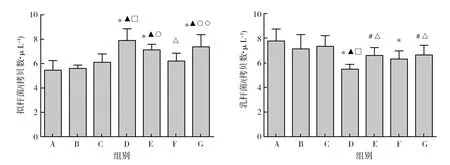
图7 各组小鼠肠道中拟杆菌属及乳杆菌属定量分析
3 讨 论
糖水偏好实验和强迫游泳实验是目前评价实验动物抑郁样行为最常用的方法之一[13-14]。本研究结果显示,对C57BL/6J小鼠实施被动游泳运动之前,各组小鼠体质量及糖水偏爱度均无明显差别。但被动游泳16周后,各模型组小鼠体质量及糖水偏爱度均较正常对照组小鼠有不同程度降低,且强迫游泳实验中不动时间均较正常对照组明显延长,表明已成功建立小鼠抑郁样行为模型[11,15]。
本研究通过不同水质、不同温度及不同游泳时间,观察被动游泳运动对小鼠抑郁样行为的影响。结果发现,采用室温海水进行游泳运动15 min的小鼠,其体质量及糖水偏爱度下降均最为明显,不动时间也最长,提示上述环境条件可能更易诱发小鼠抑郁样行为。这可能与海水含盐量较高(约为30‰,为淡水含盐量的10倍),小鼠意外呛入海水后受到的不良刺激较淡水更大有关;同时,小鼠互相撕咬造成皮肤破口,海水浸泡也可加重实验动物不适感及氧化应激损伤[16]。同时,本研究也发现,进行被动游泳运动时间越长,越易诱发小鼠抑郁样行为。更加值得关注的是,室温游泳较低温游泳更易诱发小鼠抑郁样行为。其原因可能与适当的寒冷刺激通过对神经内分泌系统的调节,提高了机体的兴奋性及适应能力有关;同时,寒冷刺激促使机体,尤其是脑组织血液循环量增大、红细胞携氧量提高[17],也在一定程度上缓解了小鼠抑郁情绪的产生。
研究显示,被动运动可引发肠道菌群的改变[18],同时,近年来的大量研究也表明,肠道菌群与抑郁障碍密切相关[19]。因此,本研究进一步对被动游泳小鼠粪便中肠道菌群进行16S rDNA高通量测序和实时荧光定量PCR实验,以观察具有抑郁样行为的小鼠肠道菌群结构和组成的特征性变化。
研究显示,重度抑郁症患者肠道菌群中厚壁菌门(Firmicutes)比例明显降低,而拟杆菌门(Bacteroidetes)、变形菌门(Proteobacteria)丰度则显著升高,其所属50多个物种的丰度均较对照组有显著差异[20]。Aizawa等[21]对43例重度抑郁患者粪便样本进行检测后也发现,重度抑郁患者较健康人更易出现双歧杆菌及乳杆菌等有益菌含量计数较低的个体。抑郁障碍动物模型中也同样发现了肠道菌群紊乱现象。Jiang等[22]采用酒精戒断的方式成功建立抑郁样小鼠模型,在对其肠道菌群结构和组成进行系统分析后发现,具有抑郁样行为的小鼠肠道中普氏菌属(Prevotella)及拟杆菌属(Bacterdies)等多个菌属丰度与对照组相比均明显不同。该研究进一步通过粪菌移植实验将抑郁障碍小鼠肠道菌群移植给受体小鼠,发现它们表现出与供体小鼠一致的抑郁样行为。Huang等[23]的研究则显示,放线菌门(Actinobacteria)拟普雷沃菌属(Alloprevotella)丰度的改变可能是抑郁障碍及抗抑郁效果评价潜在的生物标志物。本研究16S rDNA高通量测序结果发现,模型组小鼠肠道菌群的丰度和多样性与正常对照组小鼠相比均发生了明显变化,从菌门到菌属水平也存在多个物种丰度的显著改变。值得关注的是,室温海水游泳15 min的小鼠拟杆菌门(Bacteroidetes)及其所属的拟杆菌属(Bacteroides)丰度明显增加,而厚壁菌门(Firmicutes)及其所属的乳杆菌属(Lactobacillus)丰度则普遍下降,同时,该组小鼠存在普氏菌属(Prevotella)等多个条件致病菌在该组富集的现象;针对拟杆菌属及乳杆菌属所做的实时荧光定量PCR实验也得到了与16S rDNA高通量测序较为一致的结果。研究认为,拟杆菌的过度增殖与神经系统功能紊乱和抑郁症的发生发展密切相关[10,24]。Liu 等[25]通过对100名受试者粪便肠道菌群高通量测序分析也发现,抑郁症患者肠道菌群中存在大量拟杆菌及普氏菌。而乳杆菌作为一种益生菌,在调节肠道菌群结构[26]及抑郁症防治等方面也起到良好的改善效果。Slykerman等[27]募集423名14~16周的妊娠妇女,采用鼠李糖乳杆菌进行孕期和产后干预,发现接受乳杆菌补充的产妇,其产后抑郁和焦虑得分明显较低。以上这些研究均表明,肠道菌群结构和组成的变化,尤其是某些菌属丰度的改变可能参与抑郁症的发生发展并发挥关键作用。其作用机制可能是肠道菌群更易受到外界环境应激源的影响,导致菌群紊乱。肠道中有害菌的过度增殖及益生菌的缺失,使得肠道内有害物质增多,从而影响肠道内神经、内分泌、免疫及代谢系统,进一步对中枢神经系统产生影响[28-29],引发抑郁情绪。也有学者认为,对脑组织中环状RNA-HIPK2表达的抑制作用及其对星形胶质细胞功能障碍的调节作用,可能是肠道菌群参与机体抑郁样行为的另一重要途径和作用方式[30]。但它们究竟如何实现对大脑生理、行为、情绪和认知的影响,其作用机制尚未完全阐明,有待进一步研究探索。
综上所述,具有抑郁样行为的小鼠,其肠道菌群组成发生特征性改变,并随抑郁样行为的严重程度有所变化,这为今后以肠道菌群为靶点进行抑郁症防治研究提供参考。
