水稻白穗突变体wp8的表型鉴定及候选基因定位和功能分析
2021-11-19刘林朱泽王致远刘世家田云录周时荣江玲刘玲珑万建民
刘林,朱泽,王致远,刘世家,田云录,周时荣,江玲,刘玲珑,万建民
(南京农业大学作物遗传与种质创新国家重点实验室/江苏省植物基因工程技术研究中心,江苏 南京210095)
水稻(Oryzasativa)是重要的粮食作物,也是一种单子叶模式植物。叶绿体是水稻中唯一可以进行光合作用的器官。叶绿体通过叶绿素将光能转化为化学能。叶绿体能否正常形成、发育和发挥功能,对高产水稻的育种起决定性作用。叶色突变体是研究叶绿素合成、叶绿体发育和光合作用分子机制的理想遗传材料[1]。到目前为止,已经鉴定出许多与叶绿体生物合成和发育有关的基因[2]。
水稻植株呈现的颜色涉及多个途径调控,其分子生物学机制较为复杂。在水稻中发现很多叶色突变体,包括purpleleaf6(pl6)[3]、thermo-sensitivechlorophyll-deficient33(tcd33)[4]、zebraleaf15(z15)[5]等。然而,目前关于幼穗中控制颖壳颜色的研究较少,至今报道的突变体仅有whitepanicle1(wp1)[6]、whitepanicle2(wp2)[7]、whitepanicle(t)[wp(t)][8]、whitestripedleafandwhitepanicle(wslwp)[9]、whiteleafandpanicles1(wlp1)[10]、stripeleafandwhitepanicle(slwp)[11]、stripewhiteleafandwhitepanicle(st-wp)[12]等。其中wp1突变体呈现2种表型,严重时植株白化并死亡,轻微时整个生长时期叶片均呈现白条纹性状,抽穗期幼穗白化。WP1基因编码一个缬氨酸-tRNA合成酶,主要在叶绿体中核糖体发育的调控途径起作用[6]。最近报道的wp2是由硫氧还蛋白Z基因(拟南芥AtTRXz的同源基因)突变所引起;幼苗表现出高温敏感的白化表型。硫氧还蛋白Z通过控制质体多细胞器RNA编辑因子的氧化还原状态来调节植物叶绿体RNA编辑[7]。这些研究表明水稻叶片和颖壳颜色形成的分子机制很复杂,尚需挖掘新的基因,为阐明叶片和颖壳颜色形成的调控网络奠定基础。
本研究从粳稻品种‘宁粳6号’诱变突变体库筛选到一个白条纹白穗的突变体wp8。考察wp8突变体叶色表型及农艺性状,图位克隆WP8基因,分析WP8基因在叶绿素合成和叶绿体发育中的功能,为解析叶片和颖壳颜色形成机制提供参考。
1 材料与方法
1.1 试验材料和农艺性状调查
水稻白穗突变体whitepanicle8(wp8)来自水稻品种‘宁粳6号’甲基磺酸乙酯(EMS)诱变突变体库。将突变体wp8与籼稻品种‘N22’配置杂交组合,并利用其F2代分离群体进行遗传分析和基因定位。水稻均种植于南京农业大学土桥基地(119°5′E,31°56′N)和海南省陵水县南京农业大学科研基地(110°3′E,18°30′N)。采用常规的田间种植和栽培管理模式[13]。在野生型和wp8成熟后,调查株高、分蘖数、穗长以及剑叶长和宽等。在种子收获期,调查枝梗数、结实率、每穗粒数、粒长、粒宽、千粒重等农艺性状。利用便携式光合仪(Li6400XT,美国LI-COR公司)和超便携式调制叶绿素荧光仪(MINI-PAM,德国WALZ公司)测定最大分蘖期的野生型和突变体wp8的剑叶光合速率和其他光合作用指标。每个性状调查20株,取平均值。
1.2 叶绿体显微结构观察
取野生型和wp8植株4叶期第3片叶与抽穗期剑叶进行叶绿体显微结构的透射电镜观察。参考王致远等[13]的方法,采用Hitachi H-7650透射电镜对样品进行观察和拍照。
1.3 光合色素含量测定
野生型和wp8植株生长至4叶期后测量叶片叶绿素含量;植株抽穗时取完全伸展但未结实小穗拍照并测定其叶绿素含量,同时测定剑叶叶绿素含量。参照Lichtenthaler[14]的方法进行样品处理。取叶片或小穗约0.03 g,剪碎后浸入5 mL 95%乙醇中,避光放置48 h。离心收集上清液,使用分光光度计(Beckman DU800 USA)测定665、649和470 nm处上清液光密度值,重复3次。光合色素含量计算公式如下:Ca=13.95D665-6.88D640;Cb=24.96D649-7.32D665;Cx=(1 000D470-2.05Ca-114Cb)/245。式中:Ca为叶绿素a含量;Cb为叶绿素b含量;Cx为类胡萝卜素含量。最后换算单位质量的叶绿素含量。
1.4 遗传分析与基因定位
wp8与‘N22’杂交得到F1,F1种子自交获得F2代种子,于正季将F2代种子种植于南京农业大学土桥实验基地。在抽穗期调查wp8/N22分离群体中正常和白条纹叶白穗表型的单株数,对分离比进行卡方测验,验证白条纹叶和白穗表型是否由单个隐性核基因控制。
将在F2分离群体中挑选的276个与wp8表型一致的单株用于基因定位。使用CTAB方法提取叶片中基因组DNA[13]。从本实验室的SSR和InDel引物库中筛选均匀分布于水稻12条染色体,且多态性良好的147对引物,用于初定位。选取10个与wp8表型一致的单株进行初步连锁分析,将目的基因定位于RM279和I6-5之间,根据Gramene(http://www.gramene.org/)数据库的‘日本晴’和‘93-11’序列,利用NCBI(https://www.ncbi.nlm. nih.gov/)设计分子标记,将剩余的极端单株用于精细定位。所用精细定位引物序列见表1。

表1 WP8基因定位的分子标记Table 1 The developed molecular markers for WP8 gene mapping
1.5 活性氧物质(ROS)分析

1.6 序列分析和蛋白三维结构预测
通过NCBI网站(https://www.ncbi.nlm.nih.gov/)下载WP8以及同源蛋白的氨基酸序列并搜索其功能结构域;利用RGAP网站(http://rice.plantbiology.msu.edu/)对基因的功能进行预测。采用Bioedit(v7.0.9.0)软件进行同源比对。
1.7 Real-time PCR分析
剪取水稻4叶期幼苗第3片叶,使用RNAprep pure Plant Kit(天根生化有限公司)提取叶片总RNA。RNA反转录和定量RT-PCR均采用TaKaRa公司SuperScript Ⅱ反转录试剂盒和SYBR®PremixExTaqTMKit,以及ABI prism 7500定量RT-PCR系统。反应体系:模板DNA 5 μL(<100 ng),5 μmol·L-1前、后引物各2.5 μL,SYBRPremixExTaqⅡ 10 μL,总体积20 μL。定量反应程序:95 ℃ 30 s;95 ℃ 5 s,60 ℃ 34 s,循环数为40;95 ℃ 15 s,60 ℃ 1 min,95 ℃ 15 s。
UBQ5(Ubiquitin)基因作为内参,每个样品3次重复,采用2-ΔΔCT法[15]进行数据分析处理。相关基因引物参照文献[16]。
2 结果与分析
2.1 突变体wp8的表型观察
从表2可见:相比野生型,wp8的株高降低9.5%,分蘖数减少18%,穗长下降8.5%,剑叶长下降16%,剑叶宽下降6.6%,结实率增加5.9%,千粒重减少3.3%,且这些性状与野生型均差异显著。相比野生型,wp8在整个生育期均表现出明显的纵向白条纹表型;随着植株生长,突变体新生叶白条纹表型变弱,直至成熟期,部分叶片颜色恢复正常绿色(图1-A、B、C、D、F)。移栽后2周,wp8的白条纹表型变弱(图1-C)。抽穗期,wp8颖壳相比于野生型有明显的白化;随着籽粒成熟,颖壳逐渐恢复正常(图1-E、G)。

图1 WT和突变体wp8的表型特征Fig.1 Morphological characteristics of the WT and wp8 mutantA. 田间条件下4叶期的野生型(左)和wp8(右)的整体植株表型;B. 田间条件下4叶期的野生型(左)和wp8(右)的单株植株表型,比例尺为5 cm;C.田间移栽后2周的野生型(左)和wp8(右)的植株表型;D. 田间条件下抽穗期野生型(左)和wp8(右)的植株表型,比例尺为10 cm,右上角为野生型(左)和wp8(右)叶片放大图;E.抽穗期野生型(左)和wp8(右)的穗部,比例尺为2 cm;F. 田间条件下成熟期野生型(左)和wp8(右)的植株表型,比例尺为10 cm,虚线框内为野生型(左)和wp8(右)叶片放大图;G. 成熟期野生型(左)、wp8(右)的穗部,比例尺为2 cm。A. The overall plant phenotype of wild type(left)and wp8(right)at the four-leaf stage under field conditions;B. The single plant phenotype of wild type(left)and wp8(right)at the four-leaf stage under field conditions,bar=5 cm;C. The phenotype of wild type(left)and wp8(right)plants at two weeks after being transplanted in the field;D. The phenotype of wild type(left)and wp8(right)plants at heading stage under field conditions,bar=10 cm,and the top right corner shows enlarged wild type(left)and wp8(right)leaves;E. Spikes of wild type(left)and wp8(right)at heading stage,bar=2 cm;F. The phenotype of wild type(left)and wp8(right)plants after maturation in field conditions,bar=10 cm,and the dashed box shows enlarged wild type(left)and wp8(right)leaves;G. Spike phenotype of wild type(left)and wp8(right)at mature stage,bar=2 cm.

表2 野生型(WT)和wp8农艺性状比较Table 2 Agronomic trait comparison of wild type(WT)and wp8
2.2 突变体wp8光合色素含量和光合作用指标测定
分别测量野生型和突变体wp84叶期幼叶、抽穗期剑叶、抽穗后7 d小穗的色素含量。与野生型相比,wp8幼叶和抽穗期剑叶叶绿素a、叶绿素b和类胡萝卜素含量均极显著降低(图2-A、B),wp8颖壳叶绿素a、类胡萝卜素含量均极显著降低(图2-C)。相较于野生型,wp8幼叶总光合色素含量下降31.8%,wp8抽穗期剑叶总光合色素含量下降32.8%,wp8小穗总光合色素含量下降42.1%。
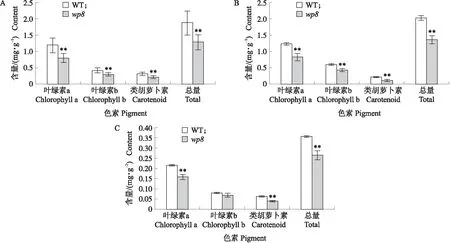
图2 WT 与wp8叶片和小穗中色素含量Fig.2 Pigment content in leaves and spikelets of WT and wp8A. 野生型和突变体wp8 4叶期第3片叶的色素含量;B. 野生型和突变体wp8抽穗期剑叶色素含量;C. 野生型和突变体wp8抽穗后7 d的小穗色素含量。A. Pigment content of the third leaf of wild type and wp8 mutant at four-leaf stage;B. Pigment content of flag leaf of wild type and wp8 mutant at heading stage;C. Pigment content of spikelet of wild type and wp8 mutant seven days after heading.
对最大分蘖期野生型和突变体wp8剑叶的光合作用指标的测量结果表明,相比于野生型,wp8剑叶的最大光量子效率显著降低3.7%,量子产量下降,但与野生型之间没有明显差异。wp8剑叶的净光合速率、气孔导度、蒸腾速率均极显著下降,比野生型分别下降44.9%、22.2%、17.6%。wp8剑叶胞间CO2浓度相比于野生型升高4.2%(表3)。这些结果表明,wp8农艺性状的变化可能是由于光合作用改变导致的。

表3 WT和wp8的光合作用指标Table 3 Photosynthesis indicators of WT and wp8
2.3 突变体wp8叶绿体显微结构
突变体wp8叶片在整个生长时期均呈纵向白条纹表型,表明可能与叶绿体发育受损有关。利用透射电镜对幼苗期野生型和突变体wp8叶绿体进行观察,结果(图3)表明野生型植株叶片叶绿体正常发育,类囊体片层结构完好,基粒紧密堆叠(图3-A、C);wp8植株叶片大部分叶绿体发生降解,一些仅存的叶绿体类囊体片层结构基本消失,并且伴随出现大量嗜锇体和空泡状结构(图3-B、D)。对抽穗期野生型和突变体wp8剑叶植株叶绿体形态进行观察,结果显示野生型植株叶片叶绿体正常发育(图3-E、G);wp8植株叶片类囊体片层结构相对疏散,并出现大量的嗜锇体结构(图3-F、H)。

图3 WT和wp8的叶绿体透射电镜观察Fig.3 Transmission electron microscopic observation of WT and wp8 mutantA、C. 野生型4叶期植株第3片叶叶绿体;B、D. wp8 4叶期植株白条纹叶片叶绿体;E、G. 野生型抽穗期剑叶叶绿体;F、H. wp8抽穗期剑叶叶绿体。CP:叶绿体;SG:淀粉颗粒;Thy:类囊体片层;OB:嗜锇体。A,C. The third chloroplast of a wild type of four-leaf stage plant;B,D. The chloroplast of a white striped leaf of a wp8 plant at the four-leaf stage;E,G. The wild type flag leaf chloroplast at the heading stage;F,H. The flag leaf chloroplast of wp8 at heading stage. CP:Chloroplast;SG:Starch granule;Thy:Thylakoid lamellar;OB:Osmiophilic body.
2.4 wp8活性氧(ROS)积累分析


图4 WT和wp8中活性氧(ROS)比较Fig.4 Comparison of reactive oxygen species(ROS)activities in WT and wp8 mutantA. 联苯胺(DAB)检测过氧化氢(H2O2);B. 硝基蓝四氮唑(NBT)检测超氧根离子 活性氧清除机制相关基因RT-qPCR分析;D. 野生型和突变体wp8过氧化氢含量。图A和B标尺为0.1 cm。A. Hydrogen peroxide(H2O2)detected by diaminobezidin(DAB)staining;B. Superoxide by nitro-blue tetrazolium(NBT)staining;C. RT-qPCR analysis of genes related to ROS clearance mechanism;D. The hydrogen peroxide content of wild type and wp8 mutant. Scale bars:0.1 cm in figure A and B.
2.5 突变体wp8的图位克隆

在F2分离群体中随机选取10株隐性极端单株进行初定位,将目标基因定位于第6条染色体短臂上于标记RM279和I6-5之间,2个标记之间的距离为4.4 Mb(图5)。将剩余的极端单株进行精细定位,最终定位于标记B4至B5之间,2个标记之间为287 bp,包含35个预测基因。其中19个编码假定蛋白、表达蛋白、转座子和逆转座子,剩余16个基因中含有1个已报道的与水稻条纹叶和白穗有关的基因(LOC_Os06g14620)[11]。基因组测序表明,wp8突变体中该基因编码区第1外显子第314位碱基G突变为A,导致编码蛋白翻译由精氨酸变为组氨酸。在筛选‘宁粳6号’突变体中发现了wp8的另一个等位突变体wsl9,其编码区第1外显子第157位碱基G突变为A,导致编码蛋白由天冬氨酸变为天冬酰胺。突变体wsl9仅表现为幼苗期和抽穗期白条纹叶片表型,而穗部与野生型没有明显的差异。

图5 wp8突变基因的定位Fig.5 Mapping of wp8 mutant geneA. 基因定位:n. 极端隐性单株数;Chr. 染色体。最终定位于B4和B5之间。A. Gene mapping:n. The number of extreme recessive plants;Chr. Chromosome. It is finally positioned between B4 and B5.B. 候选基因突变位点:wp8在基因第1外显子上(黑色方框)检测到1个碱基的突变(红线表示),同时显示另一个等位突变体wsl9的突变位点(红线表示)。B. Mutational sites of candidate gene:a single base mutation(indicated by a red line)in the first exon(black box)of the WP8 gene is shown. In addition,an allelic mutation site from wsl9 mutant is also indicated by a red line.
2.6 WP8编码核糖核苷二磷酸还原酶小亚基蛋白
通过NCBI网站(http://www.ncbi.nlm.nih.gov/)预测,WP8编码一个核糖核苷二磷酸还原酶小亚基蛋白(RNRS1)。该基因包含1个外显子,编码340个氨基酸,相对分子质量约38.37×103。核糖核苷二磷酸还原酶在DNA复制和DNA损伤修复过程中起作用,它以核苷二磷酸为底物,催化其形成脱氧核苷二磷酸[11]。对WP8基因的氨基酸序列进行比对分析,发现WP8基因只有一个保守结构域(氨基酸25~300)。同源分析表明WP8蛋白与粟(XP_004965173.1)、节节麦(XP_020183739.1)、大麦(KAE_8781384.1)、玉米(NP_001130908.2)的同源蛋白具有很高相似性(图6)。

图6 WP8同源蛋白的氨基酸序列比Fig.6 Comparison of amino acid sequence of WP8 homologous proteins下划线代表核糖核苷酸还原酶结构域;等位突变体wp8、wsl9、st1、st-wp、gws和slwp蛋白突变位点以红色字体和线框标出。比较序列分别来自水稻(LOC_Os06g14620)、粟(XP_004965173.1)、节节麦(XP_020183739.1)、大麦(KAE_87813884.1)和玉米(NP_001130908.2)。Underlines represent nucleotide reductase domain;Red font and frame indicate mutation sites of allelic mutants wp8,wsl9,st1,st-wp,gws and slwp. The compared sequences are from Oryza sativa(LOC_Os06g14620),Setaria italica(XP_004965173.1),Aegilops tauschii(XP_020183739.1),Hordeum vulgare(KAE_87813884.1)and Zea mays(NP_001130908.2),respectively.
2.7 WP8基因表达分析
通过RT-PCR对野生型和wp84叶期第3叶和抽穗期剑叶的WP8表达情况进行分析。结果(图7)表明突变体中WP8基因的表达水平比野生型略高,这可能是由于突变体WP8基因功能部分缺失,为了维持植株的正常发育,反馈调节使WP8表达升高。此外,检测WP8基因在野生型的根、茎、叶、穗、叶鞘、茎节中均表达,在叶片中的表达水平最高。

图7 WP8基因在WT和wp8 4叶期第3叶(A)和成熟期剑叶(B)以及在WT不同组织(C)中的表达分析Fig.7 WP8 gene expression analysis in the third leaf at 4-leaf stage in wild-type and wp8 seedling(A), flag leaf at maturity(B),as well as various tissues in wild-type plant(C)MR:成熟根Mature root;MSM:成熟茎Mature stem;ML:成熟叶Mature leaf;P:穗Panicle;MSH:成熟叶鞘Mature sheath;MN:成熟茎节Mature node.
2.8 叶绿体发育和合成相关基因表达分析
从图8-A可见:wp8突变体中叶绿素合成相关基因的表达受不同程度的调控,表明WP8基因突变导致叶绿素合成途径发生紊乱,进而影响叶绿素合成。基于wp8突变体叶绿体发育异常,对野生型和wp8苗期叶绿体发育相关基因进行了表达分析。从图8-B可见:大多数质体编码的细菌型RNA聚合酶(PEP)转录基因的表达水平下调,如psaA1、psbD1、ndh4、RCA、atpA和atpB,核基因编码的噬菌体型RNA聚合酶(NEP)转录基因rpoB表达水平下调,rpoC1表达水平上调(图8-B)。这些结果表明wp8突变体中叶绿体发育受损与基因表达密切关联。

图8 WT和wp8基因表达分析Fig.8 Gene expression analysis of WT and wp8 mutantA. HEMA:谷氨酰t-RNA还原酶基因Glutamyl t-RNA reductase gene;HEML:谷氨酸-1-半醛转氨酶基因Glutamate-1-semialdehyde-2,1-aminomutase gene;HEMB:胆色素原合酶基因Porphobilinogen synthase;HEMC:羟甲基后胆色素原合酶基因Hydroxymethylbilane synthase gene;URO-D:尿卟啉原Ⅲ合酶基因Uroporphyrinogen decarboxylase gene;HEME:尿卟啉原脱羧酶基因Uroporphyrinogen Ⅲ decarboxylase gene;HEMF:粪卟啉原氧化脱羧酶基因Coproporphyrinogen Ⅲ oxidase gene;CHLH:镁螯合酶H亚基基因Mg-chelatase subunit H gene;CHLI:镁螯合酶Ⅰ亚基基因Mg-chelatase subunitⅠgene;CHLM:镁原卟啉Ⅸ甲基转移酶基因Mg-protoporphyrin Ⅸ methyltransferase gene;CRD:镁原卟啉原Ⅸ单甲酯环化酶基因Mg-protoporphyrin Ⅸ monomethyl ester(oxidative)cyclase gene;DVR:二乙烯基还原酶基因Divinyl reductase gene;POR:原叶绿素酸氧化还原酶基因Protochlorophyllide oxidoreductase gene;CHLG:叶绿素合酶G亚基基因Mg-chelatase subunit G gene.B. psaA1:光系统Ⅰ亚基A1基因PhotosystemⅠP700 chlorophyll a apoprotein A1 gene;psaA2:光系统Ⅰ亚基A2基因PhotosystemⅠP700 chlorophyll a apoprotein A2 gene;psbD1:光系统Ⅰ亚基D1基因PhotosystemⅠD1 gene;ndh2:NADH脱氢酶亚基2基因Hydroxylamine reductase subunit 2 gene;ndh4:NADH脱氢酶亚基4基因Hydroxylamine reductase subunit 4 gene;RCA:Rubisco活化酶基因Rubisco activase gene;RBCL:核酮糖二磷酸羧化酶大亚基基因Ribulose-bisphosphate carboxylase large subunit gene;atpA:ATP合酶亚基A基因ATP synthase subunit A gene;atpB:ATP合酶亚基B基因ATP synthase subunit B gene;rpoB:RNA聚合酶亚基B基因RNA polymerase subunit B gene;rpoC1:RNA聚合酶亚基C1基因RNA polymerase subunit C1 gene.
3 讨论
叶色突变体是进行光合作用、叶绿素合成、叶绿体发育等基础研究的理想材料。从已有的白穗突变体来看,其在苗期即显示出明显的白条纹叶性状,抽穗期叶片呈现不同粗细的条纹,且伴随植株生长延缓,植株农艺性状变差[6,11-12,18-19]。
在水稻叶片从叶鞘中抽出时,茎总是带有4个处于不同发育阶段的未成熟叶片。这些未成熟叶片显示叶片发育连续阶段,称为P1(叶原基)、P2(第2片叶)、P3(第2片叶)和P4(第2片叶),这是叶片发育的早期阶段。新抽叶片和展开叶片分别命名为P5和P6,它们是叶片发育的后期阶段。通常,在野生型中,质体转录/翻译装置的rpo和rps基因在叶片发育的P4阶段高表达[20]。psaA1、psbD1、ndh4、RCA、atpA、atpB、rpoB等质体发育基因在突变体wp8中转录水平下降,类囊体片层结构消失,这说明wp8突变影响了叶绿体分化。在突变体wp8中,叶绿素合成基因紊乱,这可能是wp8叶绿素降低的主要原因。研究表明,一些叶绿体逆行信号因子,如四吡咯分子和氧化还原信号传导,对细胞核和质体发育相关基因表达起协调作用[21],这与本研究中氧化还原相关基因表达变化一致。
WP8编码核糖核苷二磷酸还原酶小亚基(RNRS1),可以与RNRL1(核糖核苷酸还原酶大亚基蛋白)互作并形成异源二聚体,其影响质体基因组的复制,进而控制叶绿体的发育与分化[18]。WP8与已报道的ST-WP、GWS(GREEN-WHITE-STRIPE)、ST1和SLWP为等位基因[11-12,18-19]。wp8、wsl9、st1、st-wp和slwp分别在该蛋白的第105、53、40、103和259位点发生单氨基酸突变,gws在编码区314~317碱基处发生碱基的突变和缺失,突变后蛋白发生截断,只有118个氨基酸残基(图6)。st1由粳稻品种‘FL176’自然突变获得,当其生长到四、五叶后,再次生长出的新生叶片表现纵向白绿相间的条纹,抽穗后恢复为绿色叶片[18];gws由粳稻品种‘日本晴’T-DNA插入突变获得,从第2叶开始叶片表现一定程度的绿白相间的条纹[19];st-wp由籼稻品种‘9311’经60Co-γ辐射诱变突变获得,从苗期至抽穗期叶片均带有平行于叶脉的白绿相间条纹,抽穗后颖壳和枝梗均呈现白化表型[12];slwp从2叶期开始在整个生育期均表现出条纹叶表型,抽穗期时幼穗白化,成熟期时突变体颖壳为白色[11];wp8叶片和穗部表型与st-wp相似,wsl9仅叶片表现白条纹症状(比wp8更加明显,数据未显示),穗部表型与野生型相似。这些等位突变体在叶片部位均有条纹表型,除st1农艺性状未报道,其他5个突变体的水稻产量均降低。从遗传背景看,幼穗白化突变体st-wp和slwp均为籼稻背景;粳稻品种的突变体st1和gws未显示白穗表型。已有研究表明叶色基因由于籼粳背景不同可能呈现不同的表型[22]。而本研究在粳稻中发现了该基因的不同位点突变显示不同的表型(wp8幼穗白化,wsl9未显示白穗表型)。wp8与wsl9均为‘宁粳6号’背景,排除了遗传背景对基因突变的影响。本材料可用于探索基因的不同保守结构域导致差异表型的原因。
综上,wp8在水稻生长的大部分时期都有明显的叶色突变表型,并且伴随着矮秆的性状,其对一次枝梗数、二次枝梗数、每穗粒数、粒型、千粒重等农艺性状影响不明显,因此wp8有望在两系杂交稻不育系幼苗和抽穗期除杂中发挥一定作用。
致谢:农业部长江中下游粳稻生物学与遗传育种重点实验室、江苏省现代作物生产协同创新中心/现代作物生产省部共建协同创新中心和南方粳稻研究开发有限公司对本研究给予支持。
