布鲁菌M5侵染小鼠骨髓源性树突状细胞后抗原肽的筛选
2021-11-18周永顺陈福龙孟凡则李婷婷刘子超高剑峰
张 凡,周永顺,陈福龙,李 刚,何 营,韩 凯,孟凡则,李婷婷,刘子超,高剑峰
(石河子大学 生命科学学院,新疆 石河子 832003)
布鲁菌(Brucella)是一种兼性胞内寄生的革兰阴性菌,能直接或间接感染人和动物[1],对以畜牧业为主的发展中国家和地区造成了严重的经济损失[2-4]。其羊种疫苗株M5由中国农业科学院哈尔滨兽医研究所于1962年研发,该疫苗来自于羊分枝杆菌的强毒株[5-6]。树突状细胞(dendritic cells,DCs)是目前免疫系统中被认为最有效的抗原递呈细胞之一,是唯一能够激活初始T淋巴细胞并由此诱导适应性免疫应答的抗原递呈细胞,几乎与所有类型的免疫细胞相互作用[7],可以感知不同类型的病原体,并调节不同类型的免疫反应[8]。树突状细胞捕获、处理入侵的微生物,接着将其抗原决定簇递呈至相应的淋巴细胞中,捕获入侵的抗原后,未成熟的树突状细胞将转化为成熟且活化的表型[9],树突状细胞依赖Ⅰ类和Ⅱ类主要组织相容性复合物(MHC)分子进行抗原的处理和递呈,以分别触发 CD8+或CD4+T细胞应答[10],MHC Ⅰ类分子参与内源性经典递呈途径的同时也参与外源性抗原内化递呈途径,而MHC-Ⅱ类分子仅参与递呈外源性抗原[11]。
MHC Ⅱ类分子在抗原递呈细胞的表面表达,并与源自自身和非自身抗原的短肽片段结合[12]。 这些肽-MHC复合物在自身抗原情况下具有维持免疫耐受的功能,在外源蛋白质情况下具有启动CD4+T细胞介导的适应性免疫的功能[13]。对抗原递呈细胞上MHC Ⅰ和MHC Ⅱ分子蛋白的抗原肽序列的了解,将有助于疫苗和免疫疗法的鉴定。关于病原体抗原肽的筛选及其与MHC分子的识别结合研究一直是免疫学研究的热点之一。人们对抗原摄入、加工的机制,胞内抗原肽-MHC Ⅱ类分子复合物的形成及其在抗原提呈细胞表面的递呈过程等都有较为深入的了解[14]。目前,已经运用表面展示技术、双向荧光差异凝胶电泳及质谱技术[15]等筛选并获得多种病原体的主要抗原肽,其中将毛细管电泳或高效液相色谱仪与电离子喷雾串联质谱联用,可以实现多肽混合样品的在线分离测序,使抗原肽的大规模筛选成为可能,因此质谱技术在抗原肽研究中的应用越来越多。Bozzacco等[16]建立了用小鼠FMS样酪氨酸激酶3配体(Flt3L)体外富集小鼠脾脏树突细胞和MHC-抗原肽免疫共沉淀的方法,结合质谱和多肽合成技术,对小鼠脾脏树突状细胞中MHC Ⅱ类分子与抗原肽的结合进行了确证和定量分析。本试验在体外诱导培养小鼠骨髓源性树突状细胞的基础上,使用布鲁菌M5作为外源性抗原刺激培养7 d的处于未成熟状态的树突状细胞,使其成熟并完成抗原递呈过程,再结合免疫共沉淀(CO-IP)以及LC-MS/MS技术对成熟树突状细胞表面MHC Ⅱ类分子结合的多肽片段进行分离筛选,以期为后续布鲁菌病相关疫苗的研究提供理论支撑。
1 材料与方法
1.1 试验材料
1.1.1 材 料 C57BL/6小鼠200只,雄性,8~10周龄,由郑州市惠济区华兴实验动物养殖中心提供。绿色荧光标记的布鲁菌M5菌株(GFP-M5),由石河子大学生命科学学院细胞分子生物学实验室构建。
1.1.2 试 剂 RPMI 1640细胞培养液、重组小鼠GM-CSF、重组小鼠IL-4、PBS和FBS,均购自美国GIBCD公司;红细胞裂解液,购自北京索莱宝科技有限公司;PE标记的CD11c抗体和FITC标记的CD80抗体,购自美国Biolegend公司;IP Lysis Buffer(50 mmol/L Tris-HCl(pH 7.4),150 mmol/L NaCl,体积分数1% NP-40,质量分数0.1% SDS,PierceTMIP Lysis Buffer,87787),含体积分数2% Tween(Sigma公司,P9416)的PBST(NaCl 0.138 mol/L,KCl 0.002 7 mol/L(国药集团,分析纯),体积分数0.05% TWEEN®20,pH 7.4);pH 2.8的甘氨酸(Sigma公司,G1377)洗脱液(50 mmol/L);甲酸、乙腈(ACN),购自碧云天根生物有限公司;三氟乙酸(TFA)购自美国Biolegend公司。
1.2 小鼠骨髓源性树突状细胞的诱导培养
参考童志霞[17]的分离方法并稍作改进。
1.2.1 小鼠骨髓细胞的获得 将小鼠用颈椎脱臼法处死,置于体积分数75%酒精中浸泡5 min消毒灭菌,手术去除所有股骨和胫骨,并用剪刀和镊子将骨周围的肌肉组织剔除干净,然后再用医用纱布揉搓,成为光杆,将剥离后的完整骨浸没于事先预冷的4 ℃ PBS溶液中;将骨移至超净工作台内,并用盛有体积分数75%酒精的无菌培养皿浸泡3 min消毒灭菌,然后用无菌的PBS清洗2次;将骨移入另一个盛有PBS的新培养皿中,剪去骨两端,用注射器抽取PBS,针头分别从骨两端插入骨髓腔,反复冲洗出骨髓至新的无菌培养皿中,直至骨完全变白;收集骨髓悬液,用移液枪反复吹打使聚集的细胞完全分散,再用孔径0.075 mm(200目)的尼龙网滤去小碎片和肌肉组织;滤过液1 200 r/min离心5 min,弃上清;加入4 mL红细胞裂解液,吹打重悬细胞,室温孵育4~10 min;加入15 mL PBS中和裂解液的作用,然后1 200 r/min离心5 min,弃上清;细胞沉淀用PBS洗1次,然后用含体积分数10% FBS的RPMI 1640培养液重悬细胞,即可获得小鼠骨髓细胞。
1.2.2 小鼠骨髓源性树突状细胞的诱导分化 小鼠骨髓细胞用计数板计数后,用含体积分数10% FBS的RPMI 1640 完全培养液调整细胞浓度为 1×106mL-1;将细胞铺至6孔板内,每孔3 mL,同时加入重组小鼠GM-CSF(20 ng/mL)和IL-4(10 ng/mL),将细胞培养板置于37 ℃、体积分数5% CO2培养箱中培养,此为培养的第1天;2 h后洗去细胞培养板中未贴壁的细胞;每2 d轻轻摇晃培养板,培养第3天按培养液1/2体积轻轻弃去上清培养液(以去除悬浮生长的粒细胞和淋巴细胞),补加新鲜培养液及细胞因子GM-CSF(20 ng/mL)和IL-4(10 ng/mL);培养第5天,再次补加细胞因子GM-CSF(20 ng/mL)和IL-4(10 ng/mL);培养第6天按培养液1/3体积轻轻弃去上清培养液并补加相应的新鲜培养液及细胞因子;培养第7天,轻柔吹打培养液,收集悬浮细胞及疏松贴壁生长的细胞,1 200 r/min 离心5 min,弃上清,用含体积分数10% FBS的RPMI 1640培养液重悬细胞并计数,然后调整细胞浓度至1×106mL-1铺板,37 ℃、5% CO2培养箱中培养。
1.3 小鼠骨髓源性树突状细胞的形态学观察
6孔细胞板中的小鼠骨髓源性树突状细胞经RPMI 1640完全培养液诱导培养,收集的细胞经PBS洗涤、1 500 r/min 离心5 min后,再用含重组小鼠GM-CSF和IL-4的完全培养液吹打混匀,制成细胞悬液,分别在第1,3,5,7天置于倒置荧光显微镜下观察细胞的形态学变化,包括细胞贴壁情况、细胞形态变化、细胞数量、细胞集落生长情况等。
1.4 小鼠骨髓源性树突状细胞表面表型的鉴定
收集6孔细胞板中培养至第7天的小鼠骨髓源性树突状细胞,用PE标记的CD11c抗体和FITC标记的CD80抗体进行标记,流式细胞仪检测其成熟性。
1.5 GFP-M5侵染小鼠骨髓源性树突状细胞
收集6孔细胞板中培养至第7天的小鼠骨髓源性树突状细胞,按照细菌数与细胞数100∶1的比例用GFP-M5侵染细胞,然后用体积分数10% RPMI1640培养液培养24 h。以不作侵染处理的细胞作为空白对照,激光共聚焦显微镜观察侵染情况。
1.6 MHC Ⅱ分子结合肽的分离纯化
收集GFP-M5侵染24 h的树突状细胞,设置3组生物学重复,加入IP Lysis Buffer至体积20 μL,冰上孵育15 min,12 000g离心20 min,去掉上清,收集蛋白样品。加入200 μL PBST,再加入到结合了MHC Ⅱ抗体的磁珠中,在旋转混合仪上室温孵育2 h。用400 μL PBST洗涤磁珠3遍,每次旋转混合仪上洗涤5 min去掉未结合的蛋白或多肽。用60 μL甘氨酸溶解洗涤后的磁珠,加入15 μL 5×SDS loading buffer沸水浴5 min,1 000g离心1 min,收集上清溶液。上清液使用10 ku超滤管[18](pall OD010C35)过滤并离心15 min,去除大分子量蛋白成分,保留小的肽段成分。滤过液使用C18 固相萃取柱脱盐。脱盐详细步骤为:收集多肽样品用1 mL体积分数 0.1% TFA复溶;C18柱内加入1 mL乙腈,抽干;C18柱内加入1 mL体积分数0.1% TFA水,抽干;C18柱内加入样品,抽干;C18柱内加入1 mL体积分数0.1% TFA水,抽干,重复1次;换1.5 mL新收集管,加入1 mL体积分数70% ACN/0.1%(体积分数)TFA,抽干,此时1.5 mL EP管中有大约1 mL洗脱液,冻干。脱盐冻干样品用10 μL 体积分数0.1%甲酸水溶液复溶后供质谱分析使用。
1.7 多肽样品的色谱分离
每份样品采用纳升流速HPLC液相系统Easy nLC(ThermoFisher)进行分离。液相所用A液为体积分数0.1%甲酸水溶液,B液为体积分数0.1%甲酸-乙腈水溶液(乙腈体积分数为84%)。液相色谱柱(0.15 mm×150 mm,RP-C18)以95%的A液进行平衡,样品由自动进样器上样到Zorbax 300SB-C18,再经过液相色谱柱分离,流速为250 nL/min,液相梯度设置如下:0~30 min,B液线性梯度从4%升到50%;30~34 min,B液线性梯度从50%升到100%;34~35 min,B液维持在100%。
1.8 多肽样品的质谱鉴定
酶解产物经毛细管高效液相色谱分离后用Q Exactive质谱仪(ThermoFisher)进行质谱分析,分析时长35 min。多肽和多肽碎片的质量电荷比按照下列方法采集,检测方式:正离子模式;母离子扫描范围:300~1 800 m/z;一级质谱分辨率:70 000 at m/z 200;AGC指标:3e6;一级最大IT:10 ms;扫描范围数:1;动态排除:40.0 s。每次全扫描后采集10个碎片图谱(MS2 scan),MS2激活类型:HCD;隔离窗:2 m/z;二级质谱分辨率:17 500 at m/z 200;微扫描:1;二级最大IT:60 ms;碰撞能量:30 eV;底部填充率:0.1%。
1.9 数据分析
质谱测试原始数据(RawFile)用MaxQuant 1.5.5.1 软件在布鲁菌M5数据库中比对,与布鲁菌M5基因组匹配的MHCⅡ类结合序列即为树突状细胞递呈的布鲁菌M5短肽序列,再用软件MEGA 7检索这些序列在布鲁菌M5中所代表的蛋白质。
2 结果与分析
2.1 小鼠骨髓源性树突状细胞的形态学特征
由图1可知,刚接种于培养液的骨髓细胞呈悬浮状态生长,体积相对较小,细胞形态呈圆形,表面光滑无突起(图1-A);在恒温培养箱中培养48 h后(图1-B),部分细胞呈半悬浮状态生长,细胞体积较之前明显增大,形状不规则,少数细胞表面可见微小突起;培养至第5天,悬浮生长的细胞明显增多,有大量的细胞集落形成,细胞集落的数量和体积明显增大,表面有微小突起的细胞数量增多(图1-C);培养至第7天,可见悬浮细胞大量聚集,形态更加突出,细胞表面突起明显伸长,可见明显的树突状突起明显增多,呈现典型的树突状细胞特征(图1-D)。
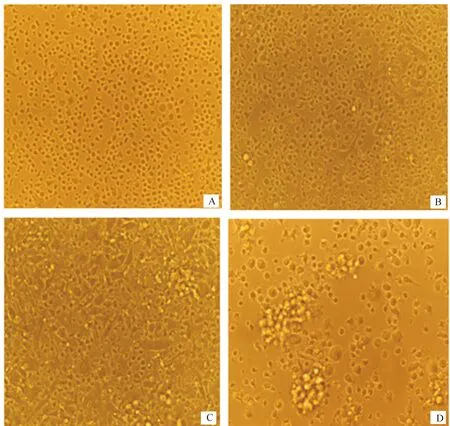
A.培养第1天;B.培养第3天;C.培养第5天;D. 培养第7天A.Day 1 of culture;B.Day 3 of culture;C.Day 5 of culture;D.Day 7 of culture
2.2 小鼠骨髓源性树突状细胞表面表型的鉴定
由图2可知,诱导培养至第7天的小鼠骨髓源性未成熟树突状细胞高表达CD11c,其阳性率为72.0%;同时低表达CD80,其阳性率为8.4%,符合未成熟树突状细胞表面标志物的特征。

图2 培养第7天的小鼠骨髓源性树突状细胞表型鉴定Fig.2 Phenotype identification of mouse bone marrow-derived dendritic cells on day 7 of culture
2.3 GFP-M5对小鼠骨髓源性树突状细胞的侵染程度观察
由图3可知,GFP-M5侵染未成熟小鼠骨髓源性树突状细胞24 h后,在激光共聚焦显微镜下可观察到大部分树突状细胞已完全被GFP-M5侵染,可进行后续试验。

从左到右分别为含绿色荧光的布鲁菌、小鼠骨髓源性树突状细胞阴影轮廓图以及含绿色荧光布鲁菌和小鼠骨髓源性树突状细胞的叠加图The three figure from left to right represents Brucella containing green fluorescence,the shadow profile of mouse bone-marrow-derived dendritic cells,and a superposition of Brucella containing green fluorescence and mouse bone marrow-derived dendritic cells,respectively图3 GFP-M5对小鼠骨髓源性树突状细胞的侵染情况Fig.3 Infection of GFP-M5 on mouse bone marrow-derived dendritic cells
2.4 小鼠骨髓源性树突状细胞膜上MHCⅡ类结合肽段的分离及鉴定
对经GFP-M5侵染24 h的3组树突状细胞进行细胞膜MHCⅡ结合肽洗脱及LC-MS/MS分析,结果显示,在每组试验中,都能从细胞膜上分离识别出800多个MHCⅡ分子结合的肽序列,在表1中只列举了经与布鲁菌全基因组比对,属于布鲁菌且在3个试验重复中至少有2组重复出现的28个序列。

表1 小鼠骨髓源性树突状细胞膜上部分MHCⅡ类结合肽序列Table 1 Partial peptide sequences combined with MHC Ⅱ class on membrane of bone marrow dendritic cells in mice
对鉴定到的MHCⅡ结合肽序列进行蛋白质鉴定,结果见表2。

表2 小鼠骨髓源性树突状细胞膜上部分MHCⅡ类分子结合肽蛋白鉴定结果Table 2 Identification of partial peptide proteins combined with MHC Ⅱ class molecules on marrow cell membrane of dendritic cells in mice bone
由表2可知,鉴定到的蛋白主要为生物合成整合膜蛋白、外膜蛋白BP26、外膜蛋白OMP28和各种外膜蛋白组装因子(外膜蛋白组装因子BamA和BamE)以及一些膜蛋白插入酶等;除与布鲁菌外膜蛋白相关的蛋白外,还鉴定到ABC转运蛋白渗透酶亚基、ABC转运蛋白通透酶、3-羟基异丁酸酯脱氢酶等一些参与天然毒物、代谢废物排出体外和酶促反应的相关酶。
3 讨 论
布鲁菌的抗原蛋白及其毒力因子大多集中在外膜蛋白(Omps)上,布鲁菌属分为羊种、牛种、猪种、犬种、绵羊附睾种及沙林鼠种等19个生物型,在中国流行的菌种主要是羊种布鲁菌,其次是牛种布鲁菌[19]。目前,已经发布的布鲁菌全基因组序列有12个,相关的蛋白质、DNA/RNA序列达数十万条 (检索自NCBI网站) 。有人将Omps分为3组,其中第1组目前已经确定的有Omp10、Omp18和Omp19;第2组包括分子质量为36~38 ku的 Omps,1984年Douglas等[20]确定这组Omps为一种外膜的孔蛋白;第3组包括分子质量为31~34 ku和25~27 ku的Omps。第2组蛋白和第3组蛋白以共价键的形式与细胞外膜的肽聚糖层紧密结合。
早期研究基本上是以小鼠或人的脾脏或胸腺组织为试验材料,采用液相色谱质谱联用(HPLC-MS)或毛细管电泳质谱联用(HPCE-MS)技术分析淋巴细胞或树突状细胞中的MHC Ⅰ和Ⅱ免疫多肽组,其中包含的多肽数量有200~8 000不等,长度在11~25个氨基酸[21]。近年来,通过差异多肽组学技术,Ⅰ-Ⅱb期非小细胞肺癌的血清生物标志物[22]、早期胃癌血清特征性多肽组[23]、人阿尔兹海默症血清多肽组[24]等陆续被报道,多肽组研究分析技术也不断被改进和优化[25-26],基于HPLC-MS技术的多肽组学研究手段日益成熟。树突状细胞在抗原递呈中扮演着重要角色,目前研究认为,树突状细胞为体内递呈功能最强大的专职抗原递呈细胞[27],是机体免疫应答的始动者。
本试验使用布鲁菌M5侵染体外诱导培养的小鼠骨髓源未成熟树突状细胞,并利用LC-MS/MS技术对树突状细胞膜上递呈的外源性抗原肽进行筛选与分析。试验设置3组生物学重复,从每组细胞膜上基本都能筛选出800多个MHCⅡ分子结合肽,经过空白对照筛选,以及与布鲁菌全基因组比对,得到了属于布鲁菌且至少在2组重复中出现的28个短肽序列。随后对这些短肽序列进行了蛋白质鉴定,可知这些蛋白质有布鲁菌外膜蛋白BP26(OMP26)和外膜蛋白OMP28、一些外膜蛋白组装因子(外膜蛋白组装因子BamA和BamE)、膜β-桶蛋白、生物合成整合膜蛋白等与布鲁菌外膜蛋白相关的蛋白质。其中,BP26蛋白是布鲁菌的优势蛋白,是一种具有强免疫原性的外膜蛋白,在感染的动物血清中均能找到BP26蛋白单克隆抗体[28]。有研究表明,MHCⅡ分子递呈的多肽分子除了来自相应的外源抗原蛋白外,还有一部分来自于细胞组织的重构、细胞的凋亡、细胞膜的编辑和补体或凝集因子的蛋白酶级联降解[29]。本研究还鉴定到一些相关酶蛋白,如L,L-二氨基庚二酸酯氨基转移酶、ABC转运蛋白通透酶、DNA指导的RNA聚合酶β亚基、双功能依赖ADP的NAD(P)H水合物脱水酶、NAD(P)H水合物差向异构酶等,这些酶类可能在布鲁菌胞内免疫逃逸或在细胞溶酶体内以及抗原递呈过程中发挥作用,也可能在细胞自身的生化反应中起作用。对筛选到的布鲁菌外膜蛋白需要进行后续的原核表达、小鼠免疫以及小鼠布鲁菌检测等相关试验,以进一步确证筛选到的布鲁菌抗原肽。本试验利用免疫共沉淀(CO-IP)以及LC-MS/MS技术完成了抗原递呈细胞细胞膜上外源性抗原肽的分离与筛选,为针对布鲁菌的特异性分子疫苗研制以及绵羊的抗布鲁菌病分子标记辅助育种奠定了理论基础。
4 结 论
本研究结果表明,联合细胞因子重组GM-CSF和IL-4诱导小鼠骨髓单个核细胞向树突状细胞定向分化和增殖,第7天可以获得数量较多、纯度较高、具有抗原提呈功能的小鼠骨髓源树突状细胞;在经外源性抗原布鲁菌M5菌株持续侵染24 h 的树突状细胞膜上,可筛选到大量的MHCⅡ类分子结合肽,经布鲁菌全基因组比对,确定有28个短肽序列属于布鲁菌;进一步进行蛋白质鉴定表明,这些短肽可能是布鲁菌外膜蛋白和外膜蛋白组装过程中需要的相关酶类,也可能是在抗原递呈过程中细胞内一系列生化反应所需的酶类。
