水生动物病原药敏实验解析
2021-11-17杨移斌
○杨移斌
随着养殖户对高产、高效的追求,水生动物养殖密度日益提高,养殖环境不断恶化。水生动物疾病频发,这些疾病中或多或少都有病原生物的参与。因此,在养殖动物病害防控进行相关药敏实验是必要的,但在养殖生产中推广药敏实验也遇到了一些问题。本文就水生动物病原药敏实验进行阐述,以期与同行交流。
1 何为药敏实验
药敏试验是离体抗微生物药物敏感性试验的简称,又称药物敏感性试验,是指在离体条件下,测定药物抑制或杀灭致病微生物能力的试验。药物敏感性实验实验简(称药敏实验,)涉及到病原体及药物两方面,因此病原体必须是可体外培养的,可分离的,而药物目前常用抗生素都有市售药敏纸片供选择,而针对其他药物如消毒剂等,则可进行相应的MIC(最小抑菌浓度)/MBC(最小杀菌浓度)测定,从而评估病原体对其敏感性。目前可以进行药敏实验的病原只有细菌、真菌以及一些寄生虫(寄生虫的药敏实验主要以活虫体在药物刺激下挣扎程度来反应的)。
2 药敏实验方法
目前药敏实验主要分为琼脂扩散法(即K-B法)及倍比稀释法,而琼脂扩散法又分为打孔法及药敏纸片法。一般以药敏纸片法及倍比稀释法最常用。以细菌性病原为例,简介药敏实验方法。
无菌条件下,取患濒死水产养殖动物,取病灶及重要组织器官如肝肾脾等,用接种环蘸取所取各样品在固体培养基上划线,置于28℃恒温培养箱中培养24小时。从已经长好菌落的平板上挑取形态大小、颜色相近的菌落进一步纯化培养。向分离得到的纯化菌株加入25%甘油,混匀后保存于-80℃冷冻保存。
药敏纸片法:将分离株接种于液体培养基中,经200r/min恒温28℃震荡培养18小时,用无菌生理盐水调整分离株浓度为104-108CFU/mL,取100μL菌液均匀涂布于固体琼脂培养基上,贴上不同种类的药敏纸片,28℃恒温培养24小时后测量抑菌直径,根据药敏纸片说明书者其他标准判定分离株对不同药物的敏感性。
倍比稀释法:主要是通过使用液体培养基倍比稀释药物,然后在每个浓度药物内接种病原,恒温培养24小时后,把无菌生长、稀释度最大的药物如消毒剂浓度作为分离株的MIC,取所有无菌生长的组涂布于固体培养基上,恒温培养24小时后观察有无菌落生长,平板上无菌落生长的最低药物如消毒剂浓度即为MBC。
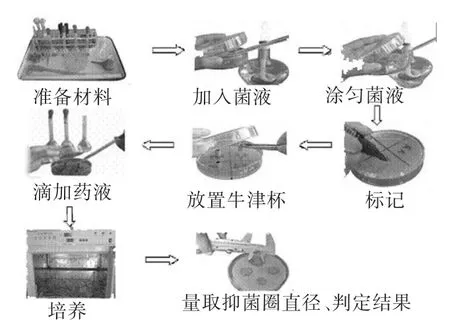
图1 药敏实验-K-B法
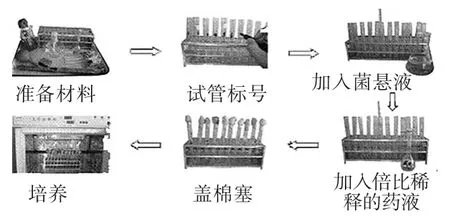
图2 药敏实验-倍比稀释法
3 实际生产中可选用的药敏实验方法
在实际生产中由于条件限制以及病情的紧迫性,使得药敏实验不太可能像在实验室这么开展,因此制定生产中药敏实验方法显得更加迫切,下面将就生产中可行的药敏实验方法进行详细阐述。
首先针对发病水产养殖动物进行取样,同样是选择具有典型症状濒死的个体。在无菌条件下,取其病灶部位及重要组织器官。将所取样品分别剪碎,溶解于无菌0.9%生理盐水中,后涂布于固体平板上,或者接种含有不同浓度药物试管中,其后操作同K-B或者倍比稀释法,经恒温24小时培养后即可读取结果。
4 药敏实验结果解读
倍比稀释法得出的最小抑菌浓度及最小杀菌浓度即可作为用药依据。K-B法结果得到的是抑菌圈的直径大小,一般购买的商品化药敏纸片都有抑菌圈参考范围,这抑菌圈参考范围即是使用标准菌株得出的实验数据,依据说明书即可判定是否耐药,根据结果也可作为用药依据。在实际生产中,如果自制药敏纸片,则需先用标准菌株进行实验,得出参考范围,如多大抑菌圈算敏感等,再以此为参考判定所分离菌株的药物敏感性。绝对不可以统一确定一个数值作为判定标准,如确定10mm分标准,大于10mm为敏感,小于或等于为耐药或者中度敏感,这是不合理的,因为不同药物抑菌机制是不一样的。
5 药敏实验的意义
对于渔药生产企业而言,“药敏实验室”除了能帮助企业把控渔药原材料的质量外,还能通过对所生产渔药的应用效果进行试验研究,根据渔药的实际用药效果修订其渔药的使用说明书内容,确保渔药的应用效果,避免药害事故发生。首先,在“药敏实验室”根据渔药的类型和功能,进行药效验证性试验。针对抗生素类渔药除了在实验室内测定其对水产养殖动物致病菌的最小抑菌浓度(MIC)外,还需要完成在野外鱼池中的水产养殖动物细菌性疾病治疗试验;对于水产用消毒剂要完成测定其对水养殖水体中细菌或者水产养殖动物致病菌的杀菌效果;对水产用杀虫剂测定对水生动物寄生虫的驱、杀虫效果。其次,对于水产用消毒剂和杀虫药物,还需要完成水体环境因子(如水温、pH等)对药物效果影响的相关试验,准确地掌握渔药在不同水体环境因子存在时对渔药使用效果的影响,这些试验内容对于避免渔药的用药事故发生,都是至关重要的。
对于渔药经销人员而言,可以利用“药敏实验室”对所销售渔药完成水产养殖动物致病生物的抑菌、杀菌、杀虫效果试验,帮助其准确掌握所销售渔药的质量与使用效果,科学地指导水产养殖业者使用所销售的渔药:首先,在“药敏实验室”根据渔药的类型和功能,进行不同种类渔药用药效果的验证性试验。针对抗生素类渔药主要是测定其对水产养殖动物致病菌的最小抑菌浓度(MIC),对于水产用消毒剂主要是测定其对水养殖水体中细菌或者水产养殖动物致病菌的杀菌效果,而对于水产用杀虫剂测定对水生动物寄生虫的驱、杀虫效果。其次,根据在“药敏实验室”完成的药物效果试验结果,准确地掌握所销售的渔药质量与使用效果,做到对渔药质量和使用效果的心中有数。其三,根据在“药敏实验室”获得的渔药药效试验结果,指导水产养殖业者科学、合理地使用各种渔药,以提高渔药使用效果,实现科学用药并能达成农业农村部提倡的“减量用药”的目标。
对于水产养殖业者而言,“药敏实验室”可以帮助解决在水产养殖动物疾病防控中的一些问题:首先,“药敏实验室”可以通过分离、鉴定病原生物,帮助水产养殖业者解决水产养殖动物疾病正确诊断的问题。其次,“药敏实验室”可以通过市售渔药对水产养殖动物致病生物的抑菌、杀菌、杀虫效果试验,帮助水产养殖业者将解决从渔药市场上正确选择、购买渔药的问题。其三,“药敏实验室”可以通过测定渔药对致病生物的最小抑、杀菌浓度试验,帮助水产养殖业者解决无法准确确定渔药使用剂量的问题(引自陈昌福教授,阐述的很完美)。
6 药敏实验结果不等于临床防控效果
使用抗生素应以细菌药敏实验结果为依据,但临床对此往往并不重视,原因是细菌的药敏结果与临床药效出入较大,有时甚至出现用敏感药无效,而用不敏感药有效的情况。究其原因很复杂,主要有如下几个方面:
6.1 体内外环境不同
体外药敏试验和体内药物疗效确实有差异,主要是因为体外和体内的环境不同,有些细菌可以利用体内的一些物质生成抵抗抗生素的成分,使抗生素失效,导致出现体外敏感,而体内耐药的情况。更重要一点即是体外,病原微生物直接跟药物接触,而体内,药物跟病原微生物接触需要经过用药、吸收、运载及达峰等一系列步骤,每一步都会对药效产生很大的影响。
6.2 细菌耐药性产生
一些细菌产生耐药性。例如产超广谱B2内酰胺酶的大肠杆菌和克雷伯菌对头孢菌素及氨曲南,沙门氏、志贺氏菌对第1、2代头孢菌素及氨基糖苷类药物的体外药敏试验有时可能呈敏感,但临床治疗是无效的,报告药敏结果时需要对此类结果进行修正和说明。
6.3 致病菌判断不准确或未检出
致病菌判断不正确,或者没有检出,我们认为这才是最可能原因。首先,一般医院检验科微生物实验室做细菌培养仅限于需氧非苛养菌的检测,而对于厌氧菌、L型细菌以及一些对氧或营养有特殊要求的细菌都不能培养出来,如果这类细菌才是病原菌的话,当然有问题了。致病菌的判定是个难题,需要检验者具备较丰富的经验,致病菌判断错误,药敏与药效不符也就难免了。还有很多细菌可能都是致死或者产生症状,但根源可能是非生物因素,这样可能会导致疾病反复暴发。
6.4 药敏试验方法选择错误导致药敏结果不正确
例如,非肠杆菌科革兰氏阴性杆菌除铜绿假单胞菌和不动杆菌可做纸片扩散法药敏试验外,假单胞菌属其它细菌、嗜麦芽窄食单胞菌和其它苛养不发酵葡萄糖的革兰氏阴性杆菌的药敏试验均需用稀释法。
6.5 药敏纸片或药物浓度变化或失效,造成假耐药情况
这主要是试剂质量问题,最容易出问题的是氨苄西林、替卡西林、哌拉西林纸片和亚胺硫霉素水剂,还有就是自制药敏纸片质量问题,如含量差异。
6.6 药敏实验操作误差
严格按要求做药敏试验也是很重要的,包括选用合格的平皿、琼脂、培养基的厚度、菌液的浊度、孵育的温度及时间等。
6.7 渔药质量不合格
渔药本身质量问题,如购买到假冒伪劣产品等;渔药保存不当,养殖户经常把渔用物资存放在养殖池塘旁边,极易受潮变质;渔药购买时间太久,导致过期等,而养殖户又不舍得丢掉,总抱着侥幸心理使用,导致得不偿失。
6.8 临床用药剂量很难把控
水生动物用药方式与陆生动物绝然不同,水生动物一般都是群体用药,采取的是泼洒或者伴饵投喂等方式,其最大的缺点即是无法确保发病个体能获得足够药物。临床用药时剂量的很不好掌握,依据药物说明书上的剂量,往往在使用过程中会出现很大损耗,如拌料损耗、药性失活等,而药物进入水环境,也会因为水质的原因有不同的损耗,就不用水质溶解药物的量不一样的,这给用药剂量的确定带来了很大的困难,目前尚无此类研究来解决这个问题。
6.9 药物选择、症状及使用对象不符
目前水生动物养殖中批准使用的抗菌药物种类不多,但各种药物也有其应用的范围,即应对症、对鱼选用药物。如肠道疾病如炎症等,则应选择在肠道停留较长的药物如新霉素等,而治疗全身性感染,则应选择吸收较好的氟苯尼考等。很多养殖对象对药物的敏感性不用,药物选择不对不但不能致病,反而可能引起鱼类死亡。
(通联:430223,中国水产科学研究院长江水产研究所 电话:17771809619)
