多功能Aβ有机小分子探针的构建及诊疗应用进展
2021-11-15陈晓宇刘义升上官萍韩璐璐王杰菲师冰洋
陈晓宇,刘义升,何 牧,上官萍,韩璐璐,王杰菲,师冰洋
(1.河南大学生命科学学院,河南大学⁃麦考瑞大学生物医学联合创新中心,2.河南大学生命科学学院⁃药学院,河南省脑靶向生物纳米药物重点实验室,开封475004;3.南方医科大学珠江医院,广州510280)
神经退行性疾病是脑部神经元结构和功能渐进性病变的一类疾病,其中阿尔茨海默症(AD)是最常见的神经退行性疾病类型之一[1~4].随着世界人口老龄化的不断加剧,AD的发病率呈现逐年递增的趋势,给患者带来了严重的生理痛苦和经济负担.β-淀粉样蛋白(Aβ)的脑部沉积是AD的重要病理特征,被认为是形成神经损伤和认知下降的主要原因之一,其作为一个关键的病理靶点,对神经退行性疾病的检测和治疗研究具有重要意义[5~11].Aβ肽以多种形式存在,包括可溶性单体、低聚体和不溶性聚集体[12~15],在AD的病程中发挥着不同的生理作用.目前,临床常用的AD诊断手段主要依靠临床症状结合影像学手段,包括电子计算机断层扫描[16,17]、磁共振成像[18,19]和正电子发射断层扫描[20~24].这些方法操作繁琐、特异性低、半衰期短、价格昂贵且对人体有辐射风险,具有不可避免的局限性,因此迫切需要发展一种高灵敏、非侵入的安全成像诊断技术,并对其进行治疗功能拓展,从而通过Aβ诊疗一体化的构建,提高AD患者的生存水平.
荧光成像技术具有安全简便、成本低、实时性好及灵敏度高等优点,作为一种安全无损的成像技术,非常适用于Aβ的检测应用[25~28].其中,构建血脑屏障(BBB)穿透性强、灵敏度高的荧光探针是Aβ检测的核心.通过对探针进行改性,可在标记Aβ蛋白的同时有效实现对蛋白纤维的解聚和单体的阻聚,从而达到检测和治疗的目的.刚果红(CR)衍生物[29~31]和硫黄素T(ThT)衍生物[32~38]是检测淀粉样斑块的常用荧光探针,目前认为其结合机制主要归因于Aβ与染料分子的平面芳香π体系的结合作用,如ThT能与Aβ纤维的β折叠结构的疏水凹槽处结合,较强的亲和力使其与蛋白结合后荧光显著增强[39].虽然此类探针对Aβ聚集体具有一定的特异结合能力,但仍存在以下问题:(1)在结合蛋白时会发生聚集猝灭(ACQ)效应,造成低的信噪比;(2)这些荧光探针属于离子型荧光探针,无法穿越血脑屏障满足体内检测的需求;(3)发射波长短,活体穿透深度浅,成像灵敏度低;(4)无法标记可溶态Aβ物种;(5)探针只有单一的成像功能,缺乏治疗功能.针对上述问题,研究人员针对提高分子的BBB穿透效率、灵敏度和治疗功能拓展进行了研究.
探针对Aβ蛋白的特异选择性是诊断和治疗的核心基础,通过化学修饰方法对分子识别工具(荧光探针)进行精准的修饰是提高其特异性的一种有效途径.因此,研究人员在传统市售探针分子的结构基础上,利用有效的化学调控对探针的分子量大小、端基官能团种类和分子共轭结构等进行目的性调控,发展了多种具有BBB高穿透、Aβ特异性和可拓宽至近红外窗口的新型功能分子[40~43],实现了对Aβ检测和治疗的目的(图1).本文对已有的检测探针和诊疗一体化探针的设计合成和分子调控规律进行归纳总结,综合评述了近年来关于分子可控合成用于Aβ诊疗的最新研究进展,最后对该领域所面临的机遇和挑战进行了总结和展望.

Fig.1 Illustration of chemical regulation for the theranostic of Aβ
1 Aβ探针的合成调控
通过对探针的分子结构进行合理设计和调控,可有效提高分子识别Aβ的特异选择性,并丰富分子识别作用模式.探针在到达脑内Aβ目标蛋白前,首先要穿过大脑特有的血脑屏障结构,因此探针需要引入能辅助穿越血脑屏障的特征结构,促进其高效穿脑发挥成像的功能.此外,探针的检测灵敏度还与其它多个因素相关,包括发光方式、发射波长和可适用的Aβ检测范围等.
1.1 脑靶向Aβ探针
Aβ探针作为神经中枢类的探针,其BBB穿透功能是构建探针的首要要求.总结已有的研究发现,小分子量(<600 Da)、亲脂电中性及平面刚性分子具有更好的脑靶向入脑效率[44~50].在调控分子量方面,Zhang等[28]基于小分子的优势,设计了不同低分子量(<438 Da)的小分子光声探针.由于分子量低并具有两亲性的结构,它们能有效地穿透BBB,利用光声成像技术实现了AD小鼠大脑中Cu2+的可视化监测.在调控亲脂性方面,由于CR和ThT属于带电分子,两者都不能很好地通过血脑屏障用于体内成像,但其对应的非带电类似物能有效渗透血脑屏障[39].基于此,Pettegrew等[51]对刚果红分子结构进行改性,其分子中的磺酸基官能团被电离性较差的羧基取代,增加了分子的电中性,所得分子在保持其Aβ特异性结合能力的基础上,显著提升了探针对血脑屏障的透过率.在ThT衍生物上也得到了相同的规律.如图2所示,Shin等[52]利用亲脂性探针构建方案,借鉴香豆素基染料(IBC-2)大的双光子横截面优势和ThT特征结构,设计了具有BBB穿透能力的新型中性双光子荧光团(IRI-1).该探针与Aβ纤维特异性结合,显示出远优于市售IBC-2染料(2.5倍增强)的荧光增强(167倍);体内荧光检测结果表明,小鼠的额叶皮质中Aβ斑块的荧光增强,显示出良好的体内血脑屏障渗透效率.

Fig.2 Synthetic route of IRI⁃1 and the chemical structures of IBC⁃2 and ThT dyes[52]
1.2 发光方式
常见的荧光探针与Aβ纤维结合时易发生π⁃π堆积而导致聚集荧光猝灭(ACQ),显著降低了检测效率.聚集诱导发光(AIE)是一种基于分子内转动受限和分子内振动受限机制的特殊发光现象[53~55],具有优于传统ACQ分子的无猝灭、信噪比高、灵敏度好及抗光漂白能力强等优势,能有效解决上述问题.因此,研究人员在上述探针分子的基础上,合理设计具有AIE特性的荧光探针[56,57],以提升探针分子的检测灵敏度.Tang等[56]设计了4种具有AIE活性的超分辨荧光探针用于淀粉样纤维蛋白(HEWL)的检测[图3(A)].图3(B)~(I)表明,在上述几种探针中,PD-NA-TEG探针对HEWL具有较好的检测效率(检测限为63.71 nmol/L).荧光共定位成像显示,探针对AD小鼠脑片中的Aβ斑块具有良好的靶向能力,光学成像分辨率约为30 nm.该项工作中的高分辨率成像为研究淀粉样蛋白的生长机制,并进一步研究其它蛋白质构象紊乱相关的神经疾病和开发新的诊疗剂提供了有力的工具.

Fig.3 Schematic synthesis and optical properties of AIE probes[56]
1.3 发光波长的调控
硫黄素和刚果红衍生物荧光探针作为传统的可见光区荧光探针,无法满足活体脑内Aβ的高灵敏成像.近红外(NIR)荧光探针具有发射波长长、穿透深度大、自发荧光干扰小及对生物体光损伤小等优势,非常适用于活体Aβ成像应用[58~61].通过减小探针最高占据分子轨道(HOMO)和最低未占据分子轨道(LUMO)间的能隙来实现发射红移,同时增加电子的推拉能力,构建电子给体(D)-受体(A)的组合是实现分子吸收和发射红移的有效途径.在传统给-受体(D-A)结构基础上,进一步在两者之间引入π电子桥接结构,构建D-π-A和D-π-A-π-D的平面型AIE分子共轭体系更有利于光谱的进一步红移[62~65].二甲氨基被广泛用作电子给体基团,甲酰和氰基则被认为是最佳的电子受体基团[40],常被用于构建给-受体型近红外分子.
自2005年Hintersteiner等[61]报道第一个用于脑内Aβ斑块近红外荧光成像的分子探针AOI-987以来,研究人员开发了一系列近红外脑靶向AD荧光探针.如Cui等[66]为了系统性研究探针结构、光学特性和生物学特性之间的构效关系,设计合成了3个系列的D-π-A型AIE探针(图4),它们具有不同的芳香给体环(苯、吡啶和嘧啶)和7种不同反式双键π桥接链组合.研究结果表明,这些探针的分子结构和光学性质与其结合能力和脑摄取等特性存在显著的相关性,随着共轭双键数量的增加,最大吸收和发射峰逐渐红移,而脑摄取量先增加后降低.在保持相同数量的共轭双键基础上,向给体环中引入氮原子,探针的发光性能和检测效率出现下降趋势.最终分子结构中无杂原子、共轭桥接链长适中的PHC-4探针分子显示出最优的灵敏度,对AD鼠和不同年龄AD病人的脑切片均显示出高灵敏的特异性成像效果.在注射后不同时间点的体内成像结果显示,PHC-4探针分子有很好的入脑效果,且相对于野生型鼠的快速代谢,PHC-4分子在AD鼠上显示出更持久的成像强度.与PYC-4相比,PHC-4对AD和野生型(WT)鼠的区分能力明显增强.该研究为目的性合成具有高BBB穿透和灵敏度的近红外荧光探针提供了强有力的支持.

Fig.4 Detection of NIR fluorescence probes for Aβin brain slices[66]
在上述研究基础上,为了更进一步提高成像灵敏度,研究人员设计了具有AIE特性的近红外探针,其大的活体穿透深度和特殊的发光方式可以实现更高的活体分辨率[67~69].Zhu等[70]在ThT分子基础上,通过引入磺酸基设计了具有一定亲水性靶向Aβ的近红外AIE荧光探针QM-FN-SO3(图5).通过引入亲脂性π共轭噻吩桥接,有效将发射波长扩展到近红外波长范围,同时显著增强了血脑屏障的穿透能力.与ThT的信噪比(VS/N=6)相比,QM-FN-SO3具有一个低的背景信号和高的信噪比(VS/N=50).体内注射20 min后,AD小鼠的脑部荧光信号明显高于野生型小鼠,有效实现了Aβ斑块的体内高保真成像检测;细胞毒性评估结果表明,该水溶性探针具有良好的生物相容性.该研究为构建水溶性近红外高灵敏Aβ探针提供了良好的分子设计借鉴.

Fig.5 Rational chemical design of NIR⁃AIE Aβprobes[70]
1.4 可溶态Aβ探针的构建
AD患者的大脑中实际存在可溶性与不可溶性两大类Aβ蛋白物种,且低聚物比纤维具有更高的神经毒性[71].因此,发展可溶性Aβ寡聚物或低聚物的特异性荧光探针对AD的早期诊断具有更重要的意义.但不同形式的Aβ物种本质上都含有相同的多肽单元,因此用小分子探针区分可溶性和不溶性Aβ是极具挑战性的工作.Teoh等[72]通过计算筛选技术,发展了一种新型荧光化学探针(BD-Oligo),能选择性识别Aβ寡聚物(结合力Kd=0.48μmol/L).体内实验结果表明,该探针具有优异的血脑屏障渗透效率和Aβ寡聚物染色能力.受Aβ抗体识别原理和平面型姜黄素分子可以插入Aβ的β-片层结构中的启示,Ran等[63]基于姜黄素分子结构骨架,通过合理的分子设计,合成了一系列具有不同立体位阻的新型姜黄素类似物的Aβ早检荧光探针(CRANAD-65,CRANAD-75和CRANAD-102,图6).实验结果表明,由于苯环在4位的阻碍有限,CRANAD-65对Aβ单体和低聚物显示出随孵育时间先增高后降低的选择性;而CRANAD-75中的2个异丙基位阻增大,显著提升了其对Aβ单体的选择性检测效率,但是由于位阻过大,会阻止其进入β-片层结构中,无法实现对Aβ低聚物的选择性检测.最终选用位阻较小的2个甲基取代CRANAD-75中的2个异丙基,合成了CRANAD-102探针,研究发现其对Aβ低聚物具有灵敏的选择性响应,在700 nm处的荧光强度增加了4.33倍.这种基于已有探针和抗体发展的探针设计策略也可拓展用于其它淀粉样蛋白检测探针的设计上.
除了上述对寡聚物和低聚物的检测,对可溶态Aβ的具体聚集形式进行高精度成像对于理解探针分子与Aβ的作用模式具有重要意义.研究表明,Aβ存在3种聚集态结构(三聚体、六聚体和十二聚体),它们均有一个三角形的蛋白腔,特别是在三聚体中有2种特殊的多肽残基(Phe19和Val36),这2种残基是Aβ低聚物特有的物种.基于此,Yang等[62]在Aβ三聚体的蛋白结构基础上,设计合成了一种新型的“v形”Aβ寡聚物特异性荧光探针PTO-29(图7).PTO-29中的苯基和氧杂硼杂己环可通过π-π堆叠和范德华力与Aβ寡聚物的疏水域相互作用,而N,N-二甲苯环可以插入到蛋白腔中,使结合更加紧密.PTO-29可以高灵敏地检测Aβ三聚物的水平.体内成像结果显示,PTO-29具有良好的BBB渗透和低细胞毒性.在4月龄的APP/PS1小鼠模型上,其脑部Aβ信号明显高于同月龄的野生型小鼠脑部信号.该研究证明PTO-29作为一种有前途的高精度Aβ早检荧光探针,为AD病的早检及其它蛋白精细结构的研究提供了一种有效的方案.由于Aβ肽可通过激活小胶质细胞产生过氧亚硝基阴离子(ONOO−)而损伤神经元,在已有的检测Aβ物种研究的基础上,研究人员开发了一些新型的针对Aβ物种和脑内氧化物种的双检测探针,如He等[73]基于小分子荧光探针技术,发展了3-羟基黄酮(3-HF)基的荧光探针,能特异性检测出Aβ聚集体,同时还能对脑内ONOO−物种实现比率型检测,为其它多功能检测探针的合成提供了一种重要思路.

Fig.6 Rationale for designing probes selectively detecting soluble Aβs[63]

Fig.7 PTO⁃29 probe combined with Aβoligomers[62]
2 Aβ的治疗
2.1 阻聚型探针
诊疗一体化探针同时具备成像和有效破坏Aβ聚集的功能,是AD诊疗领域的另一个研究重点.目前常见的Aβ治疗策略主要从阻止Aβ聚集和清除Aβ沉积入手[74~80].2016年,Li等[79]首次报道了一种集Aβ近红外成像和抑制Aβ聚集的诊疗一体化探针(图8).该探针通过在不同带电分子骨架中引入亲脂性烷基链,得到DMA-SLOH,DBA-SLOH和DPA-SLM 3种探针.其中,长度适中、对Aβ物种有高结合力的DBA-SLOH结构表现出显著的增强荧光、最高的BBB穿透性和生物相容性.采用全内反射荧光显微镜(TIRFM)监测Aβ1-40与探针孵育过程,结果显示该探针有效降低了Aβ1-40单体的聚集速率.活体荧光成像结果显示,该分子对6月龄AD鼠的Aβ斑块具有较好的成像能力,并能有效阻止Aβ1-40和Aβ1-42肽自聚集.该策略为开发高效安全的脑靶向Aβ诊疗探针开辟了新的途径.

Fig.8 Chemical structure(A)and synthetic routes of the three charged dyes(B)[79]
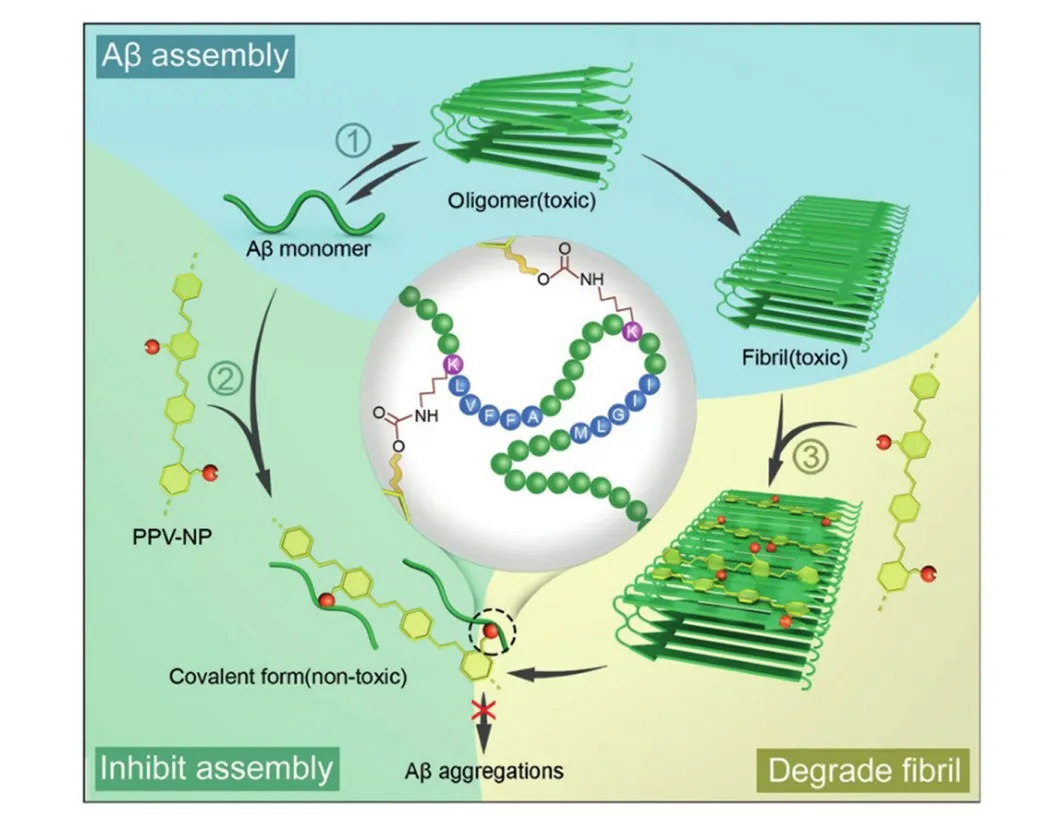
Fig.9 Inhibition and disassembly for Aβ42 aggregation by PPV⁃NP[81]
2.2 解聚/抑制双功能探针
AD的病程发生发展时间较长,发现时通常脑内已经形成大量的Aβ纤维,因此迫切需要开发一种同时具有纤维解聚和单体阻聚双功能的诊疗探针.由于常见的Aβ抑制剂多是通过非共价相互作用,如疏水相互作用、π⁃π堆叠、静电相互作用和氢键等.这些相互作用强度弱、易受周围环境(pH或温度)影响,从而导致抑制剂失活.相比之下,共价键作用力稳定性高,不易受周围环境影响,能有效阻止已降解的纤维发生可逆聚集.基于此,Wang等[81]设计了一种具有高稳定性的反应性共轭聚合物(PPV-NP,图9),其大的空间位阻可有效阻止淀粉样蛋白聚集成有毒的聚集物,显示出剂量依赖的Aβ聚集抑制效率.Aβ与PPV-NP共孵育后的圆二色光谱(CD)和透射电子显微镜(TEM)表征结果显示,Aβ由β-片状结构转变为尺寸较小的解聚结构.同时,对硝基苯可以猝灭PPV的荧光,偶联蛋白质后对硝基苯基分离,PPV的荧光得到恢复,这种OFF-ON的荧光变化可以监测PPV-NP与蛋白质之间的反应.两亲性共轭聚合物可通过疏水作用与Aβ结合,实现抑制淀粉样蛋白的组装和降解纤维的目的.体外细胞毒性实验结果显示,其能够降低淀粉样蛋白在活细胞中聚集产生的细胞毒性.大脑离体切片观察结果显示,经PPV-NP处理的大脑切片海马区和皮质中的Aβ斑块和面积明显减少,表明PPV-NP能够清除脑组织中的Aβ斑块.该研究创新地探索了多功能诊疗一体化Aβ荧光探针的成像和治疗功能,为AD的诊疗研究提供了新思路.
基于已有的小分子药物结构,合理设计Aβ靶向诊疗分子是另一种常用的构建策略.Yang等[57]基于姜黄素特异性靶向和治疗功能结构,构建了一种集解聚和阻聚双功能的AIE活性探针Cur-N-BF2,用于AD诊疗并有效保护神经元细胞(图10).体外荧光实验结果显示,姜黄素和对照分子ThT在高浓度下均发生严重的自猝灭,而Cur-N-BF2探针保持了高效的特异选择性和聚集增强发光效率.Cur-N-BF2与Aβ多肽共孵育7 d后,可有效抑制其单体的纤维化聚集,同时TEM和CD表征结果也显示探针能有效解聚Aβ纤维成球形和无定形的聚集物.神经元细胞毒性实验表明,Cur-N-BF2(100%)具有远优于姜黄素(75.6%)和ThT(45.2%)的细胞存活率;APP/PS1转基因小鼠的脑片水平对Aβ具有高的选择性和信噪比,有效提高神经元细胞活力(从55.5%增至83.2%).该AIE探针的构建为开发具有神经保护功能的双功能Aβ诊疗探针提供了有力的支持.
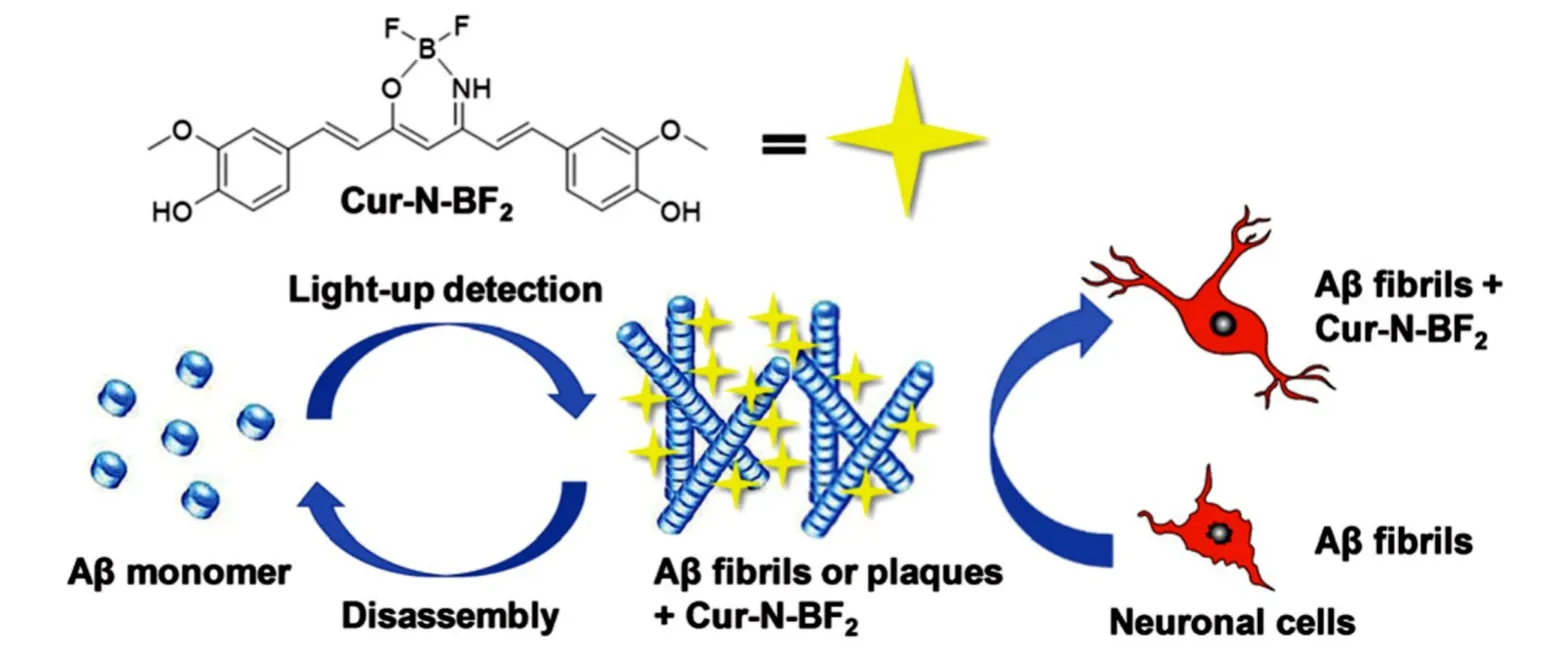
Fig.10 Light⁃up detection,inhibiting fibrillation and promoting disassembly of Aβfibrils to protect neuronal cells by Cur⁃N⁃BF2 probe[57]
2.3 其它Aβ的诊疗策略
在上述疗法的基础上,研究人员开发了利用药物小分子、基因药物、免疫疗法及光热/光动力疗法等多种新型治疗手段[82~85],丰富了Aβ诊疗模式.如利用纳米诊疗剂组分、尺寸和功能灵活可调优点的相关研究[86,87].He等[88]通过水相自组装法,将合成的AIE探针与二维MoS2基底进行复合,构建的纳米复合物对Aβ42多肽有高达19倍的荧光增强响应;AD小鼠体内成像结果表明,该探针具有良好的穿透血脑屏障和标记转基因小鼠大脑中的Aβ斑块的能力.Wang等[89]报道了一种靶向Aβ低聚物的Gd3+基纳米诊疗剂,通过负载花青染料,不仅实现靶向Aβ低聚物和单体,而且能提高生物相容性/细胞膜通透性,降低毒性,提高BBB穿透和快速从肝脏和肾脏洗脱.核磁和荧光双模态成像结果表明,该纳米诊疗剂不仅能监测不同年龄组AD小鼠脑内Aβ寡聚体的含量变化,还能对Aβ纤维起到显著抑制,实现对神经元的保护.另有一些研究基于Aβ形成的上游β分泌酶1(BACE1)靶点,设计对应的纳米诊疗剂.如,Zheng等[90]构建了一种半乳糖修饰的高分子纳米基因药物,装载能有效下调BACE1表达的siRNA.该纳米药物具有高的血液稳定性和BBB渗透效率,通过siRNA技术高效沉默BACE1实现了AD的有效治疗.
3 总结与展望
基于Aβ的特殊蛋白结构,研究者们设计了一系列靶向诊疗探针分子.本文从检测和治疗两个角度总结了化学调控与Aβ识别之间的规律和构效关系,综合评述了Aβ脑靶向诊疗分子的可控设计策略及其体内外AD诊疗应用.尽管该领域已取得一些初步的进展,但其在活体体内检测方面还面临着诸多的严峻挑战:(1)颅骨对光具有较大的屏蔽,已有的Aβ近红外分子属于近红外一区,波长仍较短,无法实现优异的活体检测效率,需开发具有更长波长和发光效率的近红外二区诊疗分子;(2)近红外二区探针通常分子量较大,血脑屏障穿越效率随分子量的增加而下降,发展新型的探针穿越血脑屏障方式是未来研究的潜在重要方向;(3)在AD病灶区,Aβ斑块常常伴随着其它病理性变化,如ROS水平高和金属离子(Cu2+,Zn2+和Fe3+)含量升高等,对Aβ进行有效抑制的同时,调控这些指标的水平对恢复脑正常功能具有重要意义.因此,未来仍需发展多元化的化学调控手段,丰富Aβ功能性探针的种类,构建安全、高效的脑靶向诊疗一体化多功能探针是阿尔茨海默症及其它神经退行性疾病未来的发展方向.
