颅内动脉粥样硬化性狭窄支架植入术后再狭窄机制及治疗新进展
2021-11-15王建波
何 钰,王建波,王 武
颅内动脉粥样硬化性狭窄(intracranial atherosclerotic stenosis,ICAS)是脑卒中的主要原因,占脑卒中33%~50%[1],中国人群中患病率约为46.6%[2]。有研究表明,颈内动脉狭窄、大脑中动脉狭窄和椎基底动脉狭窄导致的年病死率分别为12.4%、6.8%和11.6%[3]。随着腔内介入治疗技术和材料不断发展,脑血管支架植入术已成为ICAS首选治疗策略,并广泛应用于大脑中动脉狭窄、颈内动脉和椎动脉起始部等常见部位狭窄。但是支架植入术近期并发症中最常见的是围手术期远端栓塞和出血事件,其次是缺血再灌注损伤,远期并发症中影响最严重的是支架内再狭窄(in-stent restenosis,ISR)。有研究将ISR定义为植入支架内或紧邻动脉血管(5 mm内)狭窄>50%,绝对管腔损失>20%[4]。有脑血管支架植入术后远期随访研究显示,ISR总体发生率为14.4%,前循环中发生率比后循环中更高[5]。ISR还会进一步导致迟发性脑血管缺血事件发生。这些因素均使脑血管支架广泛应用受到限制。因此,探索ISR发生发展及治疗,有助于降低脑血管支架植入术后远期不良事件发生率,拓展脑血管介入治疗适应证,改善支架术后远期疗效。
1 ICAS
1.1 病因和病理学基础
ICAS病理学基础为内皮细胞功能障碍和炎症引起的血管壁脂质异常堆积,诸多因素促进其发展。目前已确定的危险因素包括年龄、种族、高血压、血脂异常、代谢综合征、胰岛素抵抗、吸烟、糖尿病和高同型半胱氨酸血症等[3,6]。随着年龄增长,脑动脉抗氧化保护作用显著减少,致使其易受到氧化应激和炎性反应的影响,导致脂质迅速堆积。种族差异可能归因于遗传易感性和生活方式差异。研究发现KALRN基因单核苷酸多态性(Single nucleotide polymorphism,SNP)突变位点与中国北方ICAS人群密切相关,其可能机制为基因位点促进新内膜增生和平滑肌细胞增殖,并通过减少一氧化氮产生导致ICAS[7-8]。高血压改变了血管内血流动力学和血管壁剪切力,导致血管壁损伤,激活炎症逐级反应。脂质异常分为保护性[(高密度脂蛋白(HDL)和载脂蛋白A(Apo A)]和损伤性[(低密度脂蛋白(LDL)和载脂蛋白B(Apo B)],前者通过促进巨噬细胞胆固醇流出,同时抑制LDL氧化、平滑肌细胞迁移及血小板聚集,起到抗动脉粥样硬化作用,后者则相反,内膜中LDL累积导致斑块形成,最终引发ICAS发生和发展[3]。吸烟增加氧化修饰并改变一氧化氮生物合成,影响颅内动脉粥样硬化发生和发展。综上,它们直接或间接地激活血管壁炎性反应,引发一系列复杂的生化反应,如细胞外基质积聚、内皮活化、单核细胞和T细胞浸润、内膜增厚、纤维帽形成和血管生成,随后斑块逐渐生长,最终导致进行性狭窄。根据这种级联反应,病理学上对ICAS进行演变过程分型[9],见表1。
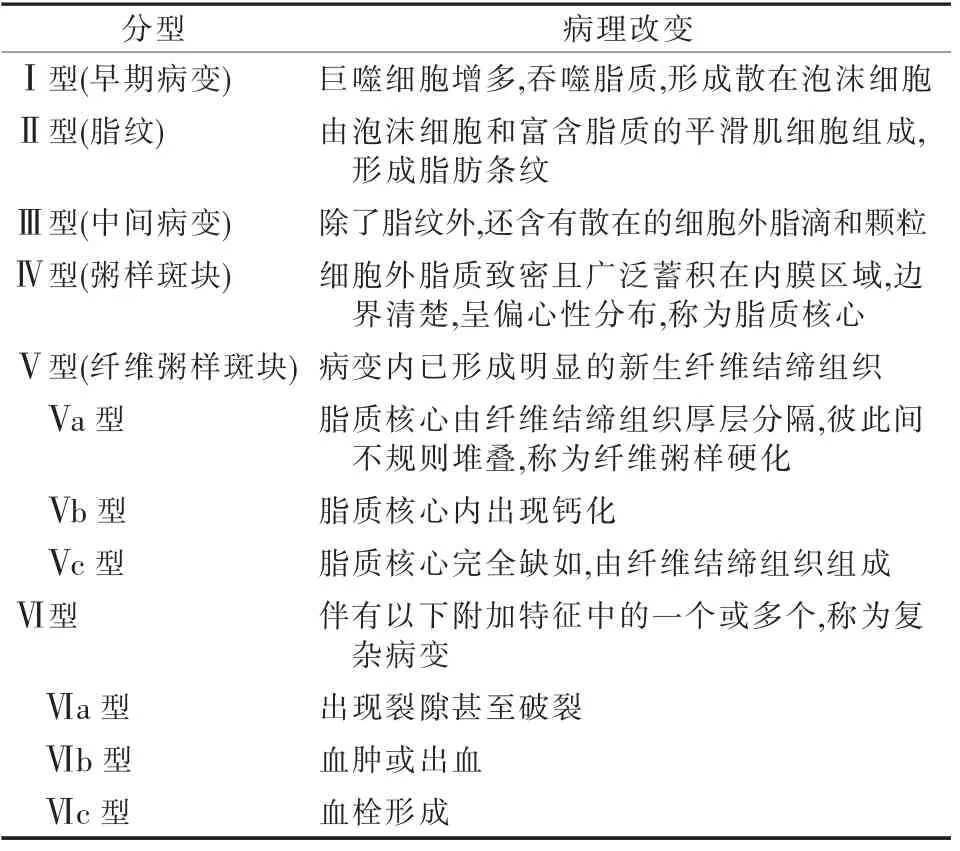
表1 ICAS演变过程的病理学分型
1.2 治疗方法
ICAS治疗方法主要包括药物治疗、外科手术(颈内动脉内膜剥脱术和脑血管旁路移植术)和介入治疗。随着脑血管成形术和支架植入术广泛开展,其独特优势显现。例如,作为微创治疗,其术中、术后不良事件发生率低,避免了手术并发症发生,同时远期疗效提高,包括良好的血运恢复能力及可观的远期通畅率[10]。其与颈内动脉内膜切除术相比,患者创伤小,住院时间短,术后生活质量提高[11]。然而有文献报道颈动脉支架植入术与颈内动脉内膜剥脱术相比围手术期脑卒中发生率和中期ISR发生率较高[12],因此还需要远期大样本病例研究进一步求证,也是目前亟待解决的难题。现今最基础治疗仍然是药物治疗,包括双联抗血小板聚集药物和他汀类药物等,尤其是对高风险脑动脉狭窄患者,积极且合理的序惯性药物治疗很重要[13]。
2 脑动脉狭窄支架植入术后ISR
2.1 病因和病理学基础
冠状动脉介入治疗术后ISR研究发现,ISR发生与血管损伤和过度修复密切相关[14]。血管支架植入往往会导致血管壁机械损伤,引发一系列免疫和生化连锁反应,致使支架内内皮细胞和平滑肌细胞增生,从而发生ISR。脑血管支架植入术后金属支架导致内皮细胞脱落和内膜损伤,一方面引起内膜炎性反应,释放炎性因子,加剧内皮细胞功能障碍,抑制内皮细胞迁移和增殖,血管壁内皮修复延迟,另一方面原位血小板黏附于损伤部位并释放血小板衍生生长因子、转化生长因子、表皮细胞生长因子等,这些细胞因子对血管平滑肌细胞具有趋化性和促有丝分裂作用。因此,内皮化延迟和血管平滑肌细胞迁移和增殖被认为是ISR关键机制(图1)[15]。支架内新生动脉粥样硬化(in-stent neoatherosclerosis,ISNA)指支架附近新生内膜内有富脂质泡沫细胞聚集,伴或不伴坏死核形成,是一种延迟性并发症,其特征是新内膜内泡沫细胞簇、牙髓核和钙化,形态类似于动脉粥样硬化斑块[16]。功能障碍的内皮细胞也被认为是ISNA的基础。
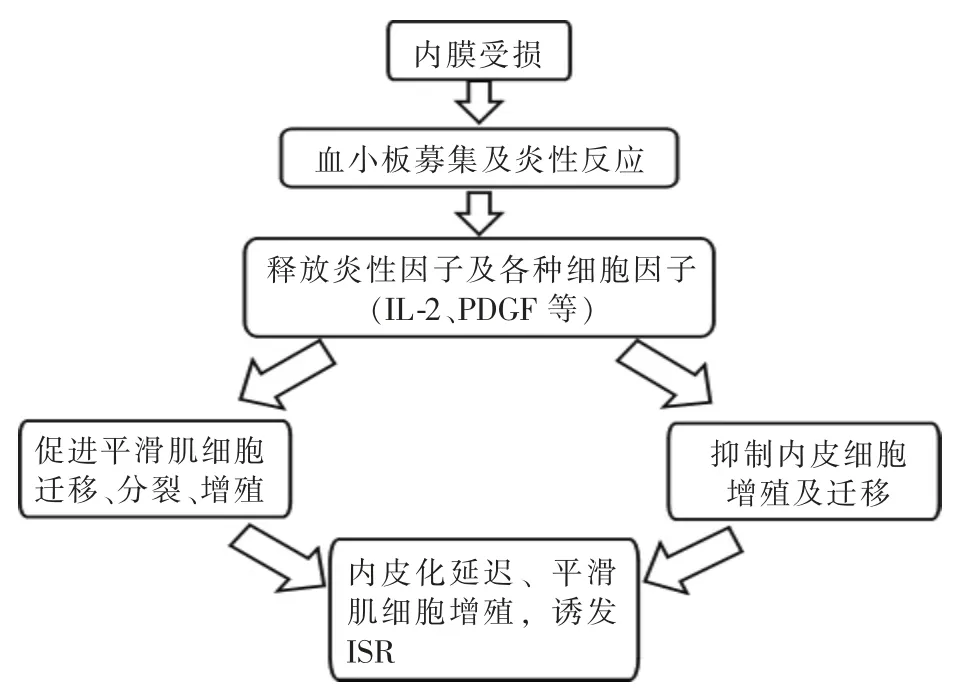
图1 ISR病理机制
除以上主要因素外,ISR发生还与患者年龄、性别、吸烟、基础疾病和抗血小板聚集药物抵抗等因素有关。吸烟可引起动脉内皮细胞受损,炎性细胞聚集、黏性增加。糖尿病可导致血液黏稠,降低凝血因子生物活性,增强血小板聚集[17]。此外,还与选择支架类型、大小、长度以及血管弯曲、直径、狭窄范围、狭窄程度相关[18-19]。支架是否具有较好的柔韧性,往往会改变血管壁力学特性,柔韧性低会降低其顺应性,患者术后ISR机会增加。
2.2 治疗方法
目前对ISR的认识尚处于如何降低其发生率阶段。据研究报道,局部给药是预防和治疗ISR的理想策略,因为ISR往往影响血管的一小部分,全身治疗通常无效,或反而引起意外不良反应。药物洗脱支架(drug-eluting stent,DES)通过在狭窄段局部释放负载药物,调节血管炎症并防止内膜增生,可提高脑血管成形术和支架植入术疗效,降低ISR复发率。
DES最早应用于冠状动脉,随后用于下肢动脉成形术[20],目前探索在脑血管中的应用[21]。DES第一代涂层药物为紫杉醇、西罗莫司,抑制平滑细胞增殖和迁移;第二代DES改善了药物释放动力学,采用更具生物相容性材料并改变了支架构造,涂层药物大多为西罗莫司衍生物;第三代DES采用具有更好生物相容性或生物可降解聚合物,以减少炎症、延迟动脉愈合和ISR可能性,但临床应用中仍有延迟性ISR发生。DES更替体现出对ISR认识的深入,研究初期强调平滑肌细胞增殖在ISR中的作用,逐步发现同样起作用的还有内皮细胞过度异常增殖;随后研究发现支架对血管壁属于一种异物损伤,刺激炎性反应;直至近几年,开始重视内皮细胞功能恢复。有学者研究提出超早期完成内皮化,促进内皮细胞功能恢复,包括对内皮细胞、血管壁保护和支持后,可能降低平滑肌细胞过度增殖[22]。遗憾的是,至今仍未发现非常理想的活性药物,既促进内皮功能恢复,又抑制平滑肌细胞增殖。
到目前为止,DES研究关键点主要体现在药物选择、支架或涂层材料、药物释放机制等方面[23]。已开发和测试许多药物,通过口服或DES、纳米颗粒直接输送至病变部位,有10多种药物或生物分子用于治疗冠状动脉和下肢股动脉区域ISR(表2)。纳米颗粒在药物载药的应用对药物载药系统有效性和安全性发展产生了重大影响[24]。其优势体现在:①靶向药物递送,实现局部作用,可降低全身不良反应;②可同时负载多种药物,且负载量更大;③更好地改善药物稳定性和溶解性,提高药物疗效;④最重要的,还能控制药物稳定剂量持续释放和程序性释放。例如,纳米离子双相释药使血管内皮细胞生长因子立即释放,促进内皮细胞黏附、增殖,延迟紫杉醇释放,避免其对内皮细胞的负面影响,同时抑制晚期平滑肌细胞过度增殖[23]。
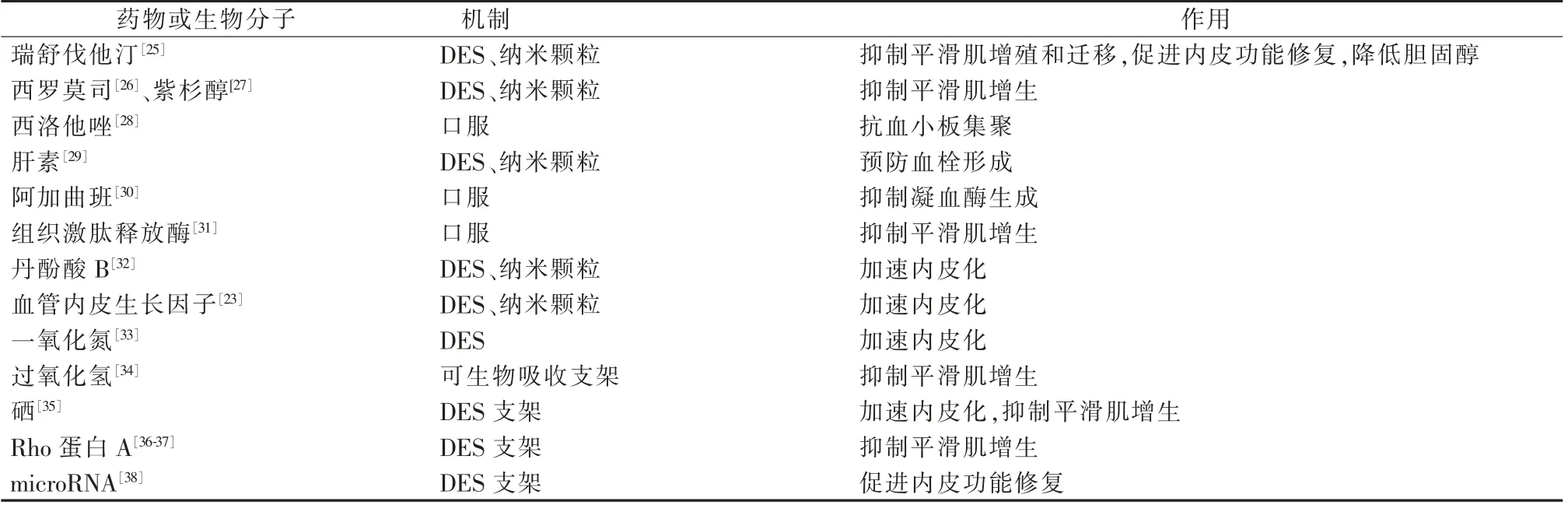
表2 ISR治疗药物或生物分子
ISR机制研究取得了很大进展,但ISR发生后治疗仍是难点,目前尚无统一的再介入治疗标准或指征。药物洗脱球囊血管成形术是冠状动脉狭窄裸金属支架和DES植入后ISR治疗的可靠选择[39-40],并列入相关临床指南。脑血管应用中首选药物涂层球囊再扩张,其次为支架或DES再植入,但目前仅证实应用于颈动脉及椎动脉开口处ISR有效[41-42]。主要原因在于支架再植入虽可提供良好的血管重构,但可能进一步损伤血管管径,并于此植入金属支架重复ISR过程,中远期无明显优势。
3 ISR治疗几个问题和展望
首先,关于脑血管支架植入术后覆盖支架表面的内皮细胞来源,仍有争议。有研究表明CD34抗体涂层支架的抗体与内皮细胞膜受体结合,吸引内皮细胞聚集,从而促进早期内皮化[43]。再者,对表面形成的内皮细胞功能进一步研究发现,支架表面改性有助于内皮细胞功能恢复,内皮细胞早期成熟可延缓或阻断ISNA发生[44]。基因洗脱支架可能具有一定潜力,因为靶向基因疗法可能会上调生长因子或减少内膜增生,阻断血栓形成[45]。这些具有研究潜力的ISR可能机制,立足于促进早期内皮化,在现有研究基础上实现生物可降解聚合物、无聚合物涂层和完全可降解生物支架,通过活性分子药物直接或间接作用选择性抑制平滑肌细胞并保护内皮细胞。理想的DES应具有这样的功能,即允许早期结构重新内皮化,抑制平滑肌细胞增殖[16,46]。Goel等[47]研究提出血管重塑这一全新概念,即动脉直径永久性改变和血管痉挛或扩张引起的动脉尺寸暂时性变化。这一概念拓宽了支架植入术后ISR治疗领域。如何通过介入支架植入治疗,实现对病变段血管重塑,值得进一步研究和实践。完全可吸收生物载药支架可能代表未来发展方向。目前DES仍会出现迟发性血栓或ISR[48],这也被认为是延迟血管再内皮化的结果。因此,DES技术改进需要考虑如何通过抑制不适应的内膜增生内环境,促进血管内皮化和修复,进一步提高支架安全性。
总之,ISR是一种过度伤口愈合反应或不良适应反应,其治疗是一不断探索问题和解决问题过程。目前药物洗脱球囊可将药物释放至不同的ISR病理过程靶点,如紫杉醇抑制细胞增殖,曲美他嗪保护内皮等,并在冠状动脉ISR治疗中发挥重要作用[49]。其他几类药物,如抗炎药物、抗氧化药物、抑制细胞增殖和迁移药物等也已开发,并于动物雌激素疾病模型进行实验。这些药物可选择性影响平滑肌细胞增殖和迁移,而不仅是内皮细胞。因此,有必要进一步开发与新型药物结合的药物洗脱球囊或药物涂层球囊。目前研究的生物活性分子局部和靶向给药,有望改善血管介入治疗效果,然而许多靶向血管药物尚未达到临床要求。未来研究必须解决新一代DES和完全生物可吸收支架远期安全性问题,以维持有效的功能性内皮细胞和有利的血管内环境,从而减少支架血栓和ISR发生。
