盐胁迫对番茄种子萌发中多胺形态变化和抗氧化的影响*
2021-11-15范翠枝赵海燕吴馨怡顾志壮郑青松郑春芳
陈 军,关 欣,范翠枝,赵海燕,吴馨怡,韩 鹰,顾志壮,郑青松,4†,郑春芳
盐胁迫对番茄种子萌发中多胺形态变化和抗氧化的影响*
陈 军1,关 欣2,3,范翠枝3,赵海燕3,吴馨怡3,韩 鹰1,顾志壮3,郑青松3,4†,郑春芳2††
(1. 苏州农业职业技术学院园艺科技学院,江苏苏州 215008;2. 温州大学生命与环境科学学院,浙江温州 325035;3. 南京农业大学资源与环境科学学院,南京 210095;4. 绵阳师范学院四川县域经济发展研究中心,四川绵阳 621000)
以番茄“合作903”为材料,研究25~200 mmol·L–1NaCl胁迫对其种子发芽、种子活力指数(SVI)、丙二醛(MDA)含量、保护酶活性、溶质积累和不同形态多胺含量的影响。结果表明:25、50 mmol·L–1NaCl处理7 d,不影响番茄种子发芽率,但显著降低SVI;随着盐处理浓度上升,发芽率和SVI均显著下降。分别以种子发芽率和SVI为因变量,NaCl处理浓度为自变量,种子萌发和萌发后幼苗建成的耐盐阈值分别为106.1 mmol·L–1NaCl(0.62%)和43.38 mmol·L–1NaCl(0.25%)。随着NaCl处理浓度上升,萌发种子MDA含量显著上升,保护酶活性、可溶性蛋白(SP)和可溶性糖(SS)均上升,游离态腐胺(fPut)、游离态亚精胺(fSpd)和游离态精胺(fSpm)、(fSpd+fSpm)/fPut均显著上升,束缚态腐胺(bPut)、束缚态亚精胺(bSpd)、束缚态精胺(bSpm)均显著增加,而(bSpd+bSpm)/bPut变化不明显。与对照相比,50 mmol·L–1NaCl处理下,番茄萌发种子结合态亚精胺(cSpd)、结合态精胺(cSpm)含量及(cSpd+cSpm)/cPut均极显著上升,随着NaCl处理浓度上升,cPut、cSpd、cSpm含量及(cSpd+cSpm)/cPut均逐渐下降。综上所述,盐胁迫延缓、抑制番茄种子萌发,对于萌发后幼苗的建成抑制作用更强。番茄种子萌发阶段对盐分具有一定的抗性,主要由于番茄萌发种子中多胺代谢在盐胁迫下呈现(fSpd+fSpm)/fPut比值的急剧上升、cSpd和cSpm含量的显著上升和束缚态各多胺的显著积累,同时SS和SP的积累随盐胁迫加剧显著积累,从而提高了萌发种子的抗氧化和渗透调节能力;但是在高盐(150 mmol·L–1NaCl)下,cSpd和cSpm的上升调控作用明显减弱,而束缚态各多胺、fSpd和fSpm的上升以及SS和SP积累调控作用仍在增强。
番茄;NaCl胁迫;萌发;抗氧化;溶质积累;多胺代谢
土壤盐渍化是典型的非生物逆境之一。中国盐渍化土壤面积约366 500 km2,在全球各国排第3位,严重抑制植物生长,导致作物产量和品质下降,威胁着农业生产的可持续发展,也限制了经济发展和生活质量的提升[1]。盐渍产生的渗透胁迫和离子毒害,导致种子很低的发芽率,从而显著降低植物生产和农业产量[2]。番茄()是一种世界性果蔬,具有很好的气候适应性,从热带到温带,甚至北极圈的一些区域均可栽培种植[3]。番茄也是露地和设施栽培产量高、营养丰富和经济效益最高的果蔬之一[4]。而番茄为对盐中度敏感的作物[5],且又主要种植在世界温暖和干旱地区,这些地区的土壤通常盐度较高。因此,了解番茄等作物对盐渍的响应和忍受机制,深入挖掘土壤生物学潜力,就显得迫切而有现实意义[4,6]。
高盐分延迟番茄种子萌发、降低其发芽率、降低其幼苗素质[7-9],而其相关的机理探讨甚少,且已有的研究主要集中在抗氧化[7,10-11]、离子平衡[12-13],也有探讨其内在的激素平衡的变化[14-15]。目前有关番茄抵抗盐胁迫中内源多胺(PAs)的作用研究甚少,主要集中于番茄植株中内源游离多胺代谢的研究,而番茄多胺代谢中不同形态与抗盐关系的研究极为匮缺,番茄种子萌发中不同形态多胺变化的研究目前尚未触及。PAs被确定为新型的植物生长物质,属于脂肪族含氮碱类,广泛存在于植物界,也具有很广泛的生理作用。PAs不仅具有植物激素的一些特性,而且它们本身还是抗氧化非酶物质[16]。此外,PAs还可作为小分子的有机溶质直接起渗透调节作用。PAs代谢或平衡缓解植物盐害的文献较多。最近几年有关盐胁迫下植物PAs代谢,如PAs的不同水平和不同化学形态、PAs合成酶活力及其基因表达等文献报告也日渐增多。诸多研究表明,植物在盐适应中PAs水平是上升的,但也有文献表明在盐适应过程中一些植物PAs水平是下降的[17]。甚至有研究[5]发现在盐胁迫下番茄生长的幼苗期和坐果期PAs水平上升,而其开花期PAs水平却又下降的现象。无论是上升还是下降,PAs的诸多生理作用并未被清楚解释或阐述。一些研究表明渗透胁迫下游离态腐胺(fPut)上升是伤害性反应,而游离态亚精胺(fSpd)和游离态精胺(fSpm)含量的上升能提高植物的抗逆性[5,16]。抗逆性强的植物为了解除fPut的毒害,一方面能通过S-腺苷蛋氨酸脱羧酶作用使腐胺(Put)向亚精胺(Spd)和精胺(Spm)转化,另一方面使游离态腐胺(fPut)向结合态Put(cPut)或/和束缚态Put(bPut)转化。通过这两方面的转化,从而提高了植物体内(fSpd +fSpm)/fPut的比值[18]。结合态PAs(cPAs)是指高氯酸可溶性结合态的PAs,即fPAs以酞胺键与一些小分子物质如肉桂酸、阿魏酸及香豆酸等以共价键结合的PAs。cPAs有两种类型:碱性酞胺和中性酞胺。前者为水溶性,具有初级胺的功能,主要由脂肪族二胺和多胺如Put、Spd、Spm等与轻基肉桂酸等共价结合而成;后者为水不溶性,无电离性质,由脂肪族和芳香族胺如酪胺、多巴胺、色胺等作为胺底物构成。cPAs形成分子屏障,抵御外界不良因素侵染。cSpd和cSpm可有效清除ROS,具有较其游离态更高的抗氧化能力[18-19]。束缚态PAs(bPAs)是指高氯酸不溶性结合态PAs,即fPAs与生物大分子如蛋白质、糖醛酸或木质素等以共价键结合而成的多胺。这些结合态多胺参与了细胞内蛋白质的交联,对蛋白合成过程中的结构修饰,具有稳定细胞中蛋白成分的作用。束缚态多胺通过大分子的交联稳定细胞内成分[18,20]。本研究采用目前在江苏各地推广使用较好的杂交番茄“合作 903”为材料,研究了不同浓度NaCl 胁迫对番茄种子萌发、幼苗生长、溶质积累、抗氧化及不同形态和种类多胺含量的变化,揭示番茄种子萌发对盐分的响应机制,尤其多胺的代谢变化,以期为番茄的耐盐栽培和育种提供理论依据。
1 材料与方法
1.1 试验设计
以番茄()品种“合作903”为试验材料。番茄种子表面消毒并用蒸馏水清洗干净后,选取健壮、饱满、大小一致的种子转入直径12 cm、高度5 cm的发芽盒中,进行不同盐处理,即向发芽盒中加入分别为0、25、50、100、150、175、200 mmol·L–1NaCl溶液,分别表示为CK、S25、S50、S100、S150、S175、S200处理,每个处理设5个重复,置于25℃恒温培养箱中进行暗培养7 d,培养期间始终保持滤纸湿润,即倾斜时盒底无溶液集聚。种子以露白为萌发标准,每天统计各处理的发芽数,7 d后收样,将萌发种子(去壳)用蒸馏水清洗干净,用吸水纸吸干表面水分,进行下列指标的测定和计算。
1.2 发芽率和种子活力指数测定
每天统计各处理的番茄种子发芽率。用万分之一电子天平(Sartorius,美国)称量萌发种子的鲜物质量(FW)。参考Ahammed等[21]文献计算发芽势、发芽率和发芽指数(GI),参考Wu等[22]文献计算种子活力指数(SVI)。
发芽势/%=(规定3 d内发芽种子数/供检测的种子数)×100
发芽率/%=(规定7d内发芽种子数/供检测的种子数)×100
GI=ΣGt/Dt(Gt指第天的发芽率,Dt指相应的发芽天数)
SVI=单个萌发种子鲜物质量×发芽指数
1.3 丙二醛、可溶性糖和可溶性蛋白含量测定
参考王学奎和黄见良[23]文献,采用硫代巴比妥酸法测定萌发种子丙二醛(MDA)含量,蒽酮比色法测定萌发种子可溶性糖(SS)含量,Folin-酚试剂法测定萌发种子可溶性蛋白(SP)含量。
1.4 番茄萌发种子保护酶系统活性测定
参考王学奎和黄见良[23]文献,称取0.5 g萌发种子鲜样用5 mL 0.05 mol·L–1磷酸缓冲液(pH 7.8)进行冰浴研磨,离心(4 000 r·min–1,4℃)15 min,取上清液进行相应抗氧化酶活性测定。超氧化物歧化酶(SOD)活性采用氮蓝四唑(NBT)还原法测定,SOD活性单以抑制NBT光化还原的50%为一个酶活性单位(U)表示;过氧化氢酶(CAT)活性采用紫外吸收法测定,以每分钟光密度240(OD240)减少0.1的酶量为1个酶活性单位(U);过氧化物酶(POD)活性采用愈创木酚比色法测定,以每分钟OD470变化0.01为1个过氧化物酶活性单位(U)。
1.5 番茄萌发种子不同形态多胺含量测定
参照刘金隆[24]方法提取游离态、结合态和束缚态多胺,并稍加修改。称取萌发种子鲜样2 g,加入预冷的5%高氯酸2 mL冰浴研磨成匀浆后,再加入4 mL 5%高氯酸混匀后转入离心管中,4℃浸提过夜后离心(14 000 ×,20 min,4℃)。分别收集上清液和沉淀,上清液用于测定游离态多胺和结合态多胺含量,沉淀则用于测定束缚态多胺含量。
游离态多胺(free polyamines,fPAs)含量的测定:吸取1 mL上清液,加入1 mL丹磺酰氯(10 mg·mL–1,溶于丙酮)和1 mL饱和Na2CO3,混匀后于60℃水浴15 min,然后加入0.5 mL 脯氨酸(100 mg·mL–1)终止反应。室温下冷却后用2 mL甲苯萃取,吸取有机相甲苯后于40℃下用氮气吹干,溶于1 mL乙腈,过滤后取20 μL样品用高效液相色谱仪(HPLC,Agilent Technologies 1200,美国)进行检测分析,柱子为C18柱,洗脱采用梯度洗脱方法[24],流速为1.5 mL·min–1,柱温为30℃,检测波长为254 nm,用荧光检测器检测。以Put、Spd、Spm(购于Sigma公司)作标准曲线。
结合态多胺(conjugated polyamines,cPAs)含量测定:吸取2 mL上清液于安瓿瓶中,加入2 mL 12 mol·L–1HCl,将安瓿瓶封口于110℃下酸解18 h,使结合态多胺转变为游离态多胺,然后在80℃下水浴蒸干多余的HCl,向其中加入3 mL 5%高氯酸重悬,离心(14 000 ×,10 min,4℃),之后测定步骤同游离态多胺含量的测定,然后进行HPLC分析,酸解中总多胺含量减去游离态多胺含量获得结合态多胺含量。
束缚态多胺(bound polyamines,bPAs)含量测定:沉淀用5%高氯酸清洗4次,然后加入4 mL NaOH用力涡旋震荡溶解,离心(14 000 ×,20 min,4℃),吸取2 mL上清液,按照结合态Put、Spd、Spm含量测定方法,HPLC分析。
1.6 数据处理与统计分析
利用Microsoft Excel2013、IBM SPSS 20.0软件进行数据的处理、统计分析,数据均为“平均数±标准差”格式,采用邓肯(Duncan)新复极差测验法(<0.05)进行单因素显著性方差分析。
2 结 果
2.1 不同浓度NaCl处理对番茄种子发芽和种子活力指数的影响
图1a所示,25 mmol·L–1NaCl处理下,番茄种子有轻微的延迟发芽现象,但是发芽势和发芽率均不受影响(>0.05);50 mmol·L–1NaCl处理下,明显延迟发芽,发芽势显著下降(<0.05),但发芽率不受显著影响;75 mmol·L–1NaCl处理下,明显延迟发芽,显著降低发芽势和发芽率,分别较对照降低40%和17%;100 mmol·L–1NaCl处理发芽势和发芽率分别较对照降低61%和58%;盐处理浓度进一步上升,番茄种子发芽率极显著下降,在200 mmol·L–1NaCl处理下7 d,均无种子萌发。25 mmol·L–1NaCl处理下,番茄种子活力指数(SVI)显著下降,随着NaCl浓度上升,SVI显著下降。当处理盐度达到150 mmol·L–1NaCl,SVI降至5.91;当盐浓度高达175和200 mmol·L–1NaCl,SVI进一步分别降至0.49和0。
2.2 番茄种子萌发的耐盐阈值确定
以番茄种子发芽率为因变量,NaCl处理浓度为自变量,通过拟合曲线估计,建立回归方程(图2)发现,种子发芽率、种子活力指数与NaCl处理浓度的回归方程分别为:=(4×10–7)4–0.000 13+ 0.006 12– 0.171 3+ 93.73(2= 0.996 1)和=(–2×10–6)4+ 0.000 83–0.071 42–6.037+ 803.6(2= 0.986 8)。以种子发芽率或种子活力指数较对照下降50%为标准计算,得出番茄“合作903”种子萌发和萌发后生长的耐盐阈值分别为106.1 mmol·L–1NaCl(0.62%)和43.38 mmol·L–1NaCl(0.25%)。
2.3 不同浓度NaCl处理对番茄萌发种子抗氧化酶系统和溶质累积的影响
与对照相比,50 mmol·L–1NaCl处理下7 d,番茄萌发种子MDA含量显著上升(图3a),而其SOD、POD、CAT活性变化不显著(图3b、图3c、图3d);100 mmol·L–1NaCl处理下,种子MDA含量、SOD、POD、CAT活性均显著上升,分别上升41%、49%、86%、31%;随着NaCl浓度上升,其增幅也进一步增加(图3b、图3c、图3d)。50 mmol·L–1NaCl处理下7 d,萌发番茄种子可溶性蛋白(SP)含量无显著变化,但可溶性糖(SS)含量显著下降,100 mmol·L–1NaCl处理下,SP和SS含量显著高于对照,分别较对照增加117%和27%;150 mmol·L–1NaCl处理下,SP和SS含量分别较对照增加274%和53%(图3e和图3f)。
2.4 不同浓度NaCl处理对番茄萌发种子不同形态多胺含量及构成的影响
与对照相比,50 mmol·L–1NaCl处理7 d,番茄萌发种子游离态腐胺(fPut)显著下降,随着NaCl浓度上升,fPut含量随之上升,但均显著低于对照。而50 mmol·L–1NaCl处理下萌发种子游离态亚精胺(fSpd)和游离态精胺(fSpm)与对照均无显著差异,随着NaCl处理浓度的增加,fSpd和fSpm含量均显著上升。100 mmol·L–1NaCl处理下,fSpd和fSpm分别较对照增加109%和399%,150 mmol·L–1NaCl处理下,fSpd和fSpm分别较对照增加201%和578%。与对照相比,50 mmol·L–1NaCl处理下,(fSpd+fSpm)/fPut显著上升,随着NaCl处理浓度的增加,这一比值上升愈显著。与对照相比,50、100、150 mmol·L–1NaCl处理下,(fSpd+fSpm)/fPut分别增加382%、829%和1135%(表1)。
与对照相比,50 mmol·L–1NaCl处理7 d,番茄萌发种子结合态腐胺(cPut)无显著变化,随着NaCl处理浓度的增加,cPut含量显著下降;而50 mmol·L–1NaCl处理下萌发种子结合态亚精胺(fSpd)、结合态精胺(fSpm)含量及(cSpd+cSpm)/cPut均显著高于对照,随着NaCl处理浓度的增加,cSpd、cSpm含量及(cSpd+cSpm)/cPut均逐渐显著下降。与对照相比,50 mmol·L–1NaCl处理7 d,番茄萌发种子束缚态腐胺(bPut)、束缚态亚精胺(bSpd)、束缚态精胺(bSpm)含量分别增加4%、8%和33%;100 mmol·L–1NaCl处理下,bPut、bSpd和bSpm分别较对照增加120%、129%和253%;150 mmol·L–1NaCl处理下,bPut、bSpd和bSpm分别较对照增加263%、288%和427%(表1)。
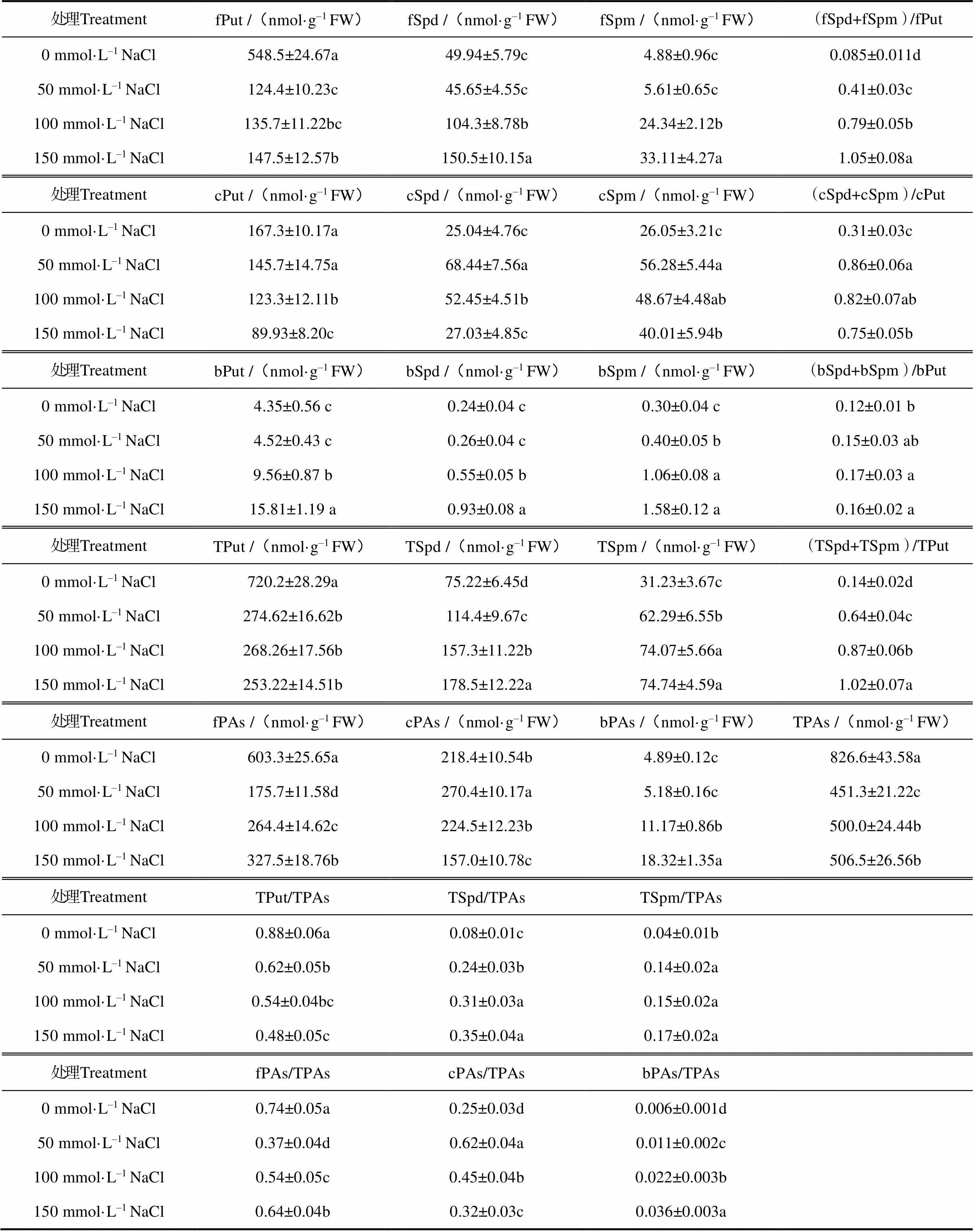
表1 不同浓度NaCl处理下番茄萌发种子不同形态多胺含量和构成
注:不同的小写字母表示处理间差异显著(<0.05)。Note:The different lower-case letters after same horizontal data mean significant difference at the level of 0.05.
表1还显示,与对照相比,番茄萌发种子总多胺(TPAs)在不同浓度NaCl胁迫下均显著下降,但随着NaCl处理浓度的上升,其TPAs含量逐渐上升。盐胁迫下番茄萌发种子游离态多胺(fPAs)及其在总多胺中的份额(fPAs/TPAs)显著下降,但是随着NaCl处理浓度的上升,番茄萌发种子fPAs含量和fPAs/TPAs 显著上升。而种子结合态多胺(cPAs)在50 mmol·L–1NaCl处理下显著上升,而NaCl处理浓度上升至100 mmol·L–1,其cPAs下降,与对照差异不显著,上升至150 mmol·L–1NaCl,其cPAs进一步下降,显著低于对照。盐胁迫下番茄萌发种子束缚态多胺(bPAs)及其在总多胺中的份额(bPAs/TPAs)显著上升,随着NaCl处理浓度的上升,番茄萌发种子bPAs含量和bPAs/TPAs 显著上升。
3 讨 论
3.1 盐胁迫对番茄种子萌发的抑制及其耐盐阈值
种子萌发是植物生命起始的首要过程,也是植物最早接触盐渍的阶段。阐述种子萌发对盐胁迫的响应,是系统认识盐害和植物耐盐性的较好途径。发芽率首当其冲反映种子质量优劣的主要指标之一。刘庆华等[25]以山西主栽品种“白果强丰”和“德冠1号”为研究材料,研究表明30 mmol·L–1NaCl胁迫10 d,番茄品种“白果强丰”发芽率显著下降,而“德冠1号”发芽率无显著变化,60 mmol·L–1NaCl胁迫下,“白果强丰”和“德冠1号”发芽率分别下降32%和17%。苏实等[13]在“合作908”上研究表明,50、100 mmol·L–1NaCl胁迫10 d,番茄发芽率较对照无显著变化,125 mmol·L–1NaCl胁迫下,“合作908”发芽率显著下降。本研究表明,25、50 mmol L–1NaCl胁迫7 d,“合作903”发芽率与对照相比差异不显著,75 mmol·L–1NaCl胁迫下,“合作903”发芽率显著下降,125和150 mmol·L–1NaCl胁迫下,“合作903”发芽率极显著下降,发芽率分别较对照下降58%和90%(图1a)。而“白果强丰”在120和150 mmol·L–1NaCl胁迫下,发芽率分别较对照下降75%和87%;“德冠1号”在120和150 mmol·L–1NaCl胁迫下,发芽率分别较对照下降54%和90%[25]。上述结果表明,低盐下,“合作903”耐盐性与“德冠1号”近似,均强于“白果强丰”,而逊于“合作908”;当高盐达到150 mmol·L–1NaCl胁迫下,由于吸水困难,上述的番茄品种发芽均严重被抑制,很难区分出耐盐性的差异。本研究表明,当盐分达到200 mmol·L–1NaCl胁迫,“合作903”种子在7 d已经不能露白萌发(图1a)。而Huang等[26]用“Micro-Tom”栽培番茄为材料,发现200 mmol·L–1NaCl胁迫7 d,依然可保持对照56%的发芽率。Ahammed等[21]同样以“合作903”为材料,发现150 mmol·L–1NaCl胁迫下5 d,发芽率仅较对照下降9%,表明“合作903”在萌发阶段,具有很高的耐盐性,与本研究多次重复试验的结果不一致,其原因有待于进一步探讨。
种子活力指数(SVI)是种子质量的重要指标,也是种用价值的主要组成部分,它与种子田间出苗密切相关,甚至有人将种子活力作为种子质量的同义词[27-28]。Maleki等[29]研究发现耐盐藜麦在立苗期、花期和灌浆期的耐盐阈值分别为8、20和15 dS·m–1,表明种子立苗阶段对盐胁迫最为敏感,立苗成功后对盐环境适应性较强,可适应较高浓度的盐胁迫。刘晓威等[30]以泌盐盐生植物红砂为试验材料,分析和计算表明,红砂的最适萌发盐浓度为45.78 mmol·L–1、最适幼苗生长盐浓度为50.59 mmol·L–1;同时发现红砂萌发耐盐阈值浓度为273.0 mmol·L–1,而幼苗生长耐盐阈值为388.2 mmol·L–1,显然盐生植物红砂幼苗在盐土上生长对盐度的依赖或忍耐均要高,而种子萌发阶段较为敏感,这也符合盐生植物的基本特征。本研究发现,盐胁迫下番茄SVI的降幅较发芽率的降幅更显著(图1),进一步根据耐盐阈值的比较分析可发现,以种子活力指数为因变量的萌发阶段的耐盐阈值要明显低于以发芽率为因变量的(图2)。这说明番茄种子萌发时遭遇盐分胁迫不仅延缓,甚至抑制种子萌发,对于萌发后幼苗的建成抑制作用更强,与王霞霞等[31]在燕麦上的研究结果一致。这些研究均说明种子萌发阶段是盐生植物或淡土植物逆境条件下成活的关键阶段。在这一阶段,对其生长所在环境胁迫抗性最弱。种子萌发成功后盐生植物幼苗对盐环境适应性较强,可适应较高浓度的胁迫,而相对耐盐性弱的淡土植物幼苗在持续的盐胁迫下通常受抑制更为严重。萌发阈值及生长阈值的确定,为盐生植物或淡土植物研究提供了不同发育层面的数据支撑。
3.2 番茄种子萌发中抗氧化和溶质积累对盐胁迫的应答
盐胁迫包括渗透胁迫和离子胁迫以及由此引起的次级盐害如氧化胁迫等。产生的大量氧自由基和诱发的膜脂过氧化作用导致膜透性发生变化使结构和功能受损[2]。Huang等[26]发现200 mmol·L–1NaCl胁迫“Micro-Tom”栽培番茄种子萌发7 d,其叶片CAT、SOD、POD、谷胱甘肽巯基转移酶(GST)的基因表达均显著上升,而脂肪氧化酶(LOX)、抗坏血酸过氧化物酶(APX)的基因表达下降,同时其可溶性糖(SS)含量上升。刘丹等[10]在有机番茄上的研究表明,盐处理使得番茄种子的MDA含量上升,其中耐盐性强的“妙红”MDA增幅低于相对不耐盐的品种“佳人”,盐处理也使得幼苗SOD、POD、CAT活性增加,且随着盐处理强度的增加,番茄的SOD、POD、CAT活性也不同程度上升,且耐盐性越强的品种,这一上升现象越明显。霍文雨等[32]以“合作906”和“合作909”番茄品种为试验材料,发现100 mmol·L–1NaCl胁迫10 d,SOD、POD、CAT和抗坏血酸过氧化物酶(APX)均不同程度地显著下降;同时,其可溶性蛋白(SP)均下降,而耐盐的“合作909”的SS含量下降,盐敏感的“合作906”的SS含量上升。杨若鹏等[33]以“福宝”和“东方红”番茄品种为材料,发现100 mmol·L–1NaCl胁迫7 d,萌发的早期幼苗SOD、POD、CAT活性均显著上升,胁迫增加至200 mmol·L–1NaCl,显示下降,但仍显著高于对照。Moles等[34]研究了25 mmol·L–1NaCl胁迫下,耐盐的番茄品种Ciettaicale的总抗氧化能力显著上升,而盐敏感品种San Marzano的总抗氧化能力下降,与抗氧化能力呼应的是耐盐Ciettaicale的SS含量在盐处理下显著上升,而盐敏感San Marzano的SS含量下降。Ebrahim 和Saleem[11]以栽培番茄Super Strain-B的种子为材料,盐处理12 d,发现50、100 mmol·L–1NaCl处理显著提高幼苗叶片SS含量,而降低叶片SP含量,盐度越高,这一变化趋势越显著。本研究显示盐胁迫导致番茄幼苗膜脂过氧化产物MDA含量显著上升,同时幼苗的SOD、POD、CAT活性也不同程度上升,且随着盐胁迫强度的上升,上述指标上升愈显著(图3),与刘丹等[10]在有机番茄上的结果相一致。而溶质如SS、SP含量的变化,则因品种、处理时间、处理强度等不同而呈现多样性的变化。
3.3 番茄种子萌发中多胺含量和形态对盐胁迫的应答
Wang和Liu[35]研究表明,盐胁迫下多胺氧化酶(PAO)基因的超表达虽然导致盐胁迫下甜橙种子萌发上升,但是抑制胚根伸长和幼苗生长,主要是因为fSpd和fSpm含量显著下降和大量H2O2产生导致次生胁迫;下调PAO基因,从而上调游离态Spd和Spm含量,是有效增强植物耐盐性的方法。Afzal等[36]分别采用50 mg·L–1Put、Spm和Spd浸种24 h,发现Spm或Spd处理可促进番茄种子萌发、提高种子活力,增强其抗氧化能力,而Put处理降低了番茄种子的抗氧化能力,从而推迟番茄种子萌发和降低种子活力。Bueno等[37]研究了盐胁迫对戟叶滨藜和芹叶车前草的萌发效应,发现盐处理明显降低盐生植物戟叶滨藜萌发种子中游离总多胺(fPAs)的含量,而明显增加不耐盐的芹叶车前草的fPAs含量,盐胁迫强度越大,上述趋势越明显;进一步分析表明,盐胁迫下耐盐的戟叶滨藜萌发种子中fPut下降极显著,fSpd的下降不如fPut明显,而fSpm显著上升,从而其(fSpd + fSpm)/fPut比值显著上升;盐胁迫下不耐盐的芹叶车前草萌发种子中fPut下降,但其降幅远不如戟叶滨藜,fSpd和fSpm均显著上升,尤其是fSpm上升明显,从而其(fSpd + fSpm)/fPut比值也显著上升;比较分析显示,200 mmol·L–1NaCl处理10 d,戟叶滨藜和芹叶车前草萌发种子(fSpd + fSpm)/fPut比值分别为各自对照的5.7倍和3.8倍。本研究表明,50 mmol·L–1NaCl处理7 d,fPAs显著下降,这很可能是因为盐胁迫启动了番茄萌发种子的积极应答;但是随着盐处理浓度的上升,fPAs又逐渐显著上升,但是依然低于对照的(表1),这表明随着盐胁迫强度的增加,其积极响应程度在下降。进一步分析发现,盐胁迫下fPAs的下降主要是由于fPut的下降导致的,而fSpd和fSpm均显著上升,尤其是fSpm的增幅更为显著,从而其(fSpd +f Spm)/fPut比值也急剧上升,并随着盐胁迫强度的增加而上升愈显著(表1)。总体而言,种子萌发要适应盐胁迫,其游离态多胺积累趋势是从fPut向fSpd和fSpm的变化,且通常伴随游离态总多胺的下降,这一下降意味着游离态向结合态或束缚态多胺的变化。有关在植株生长阶段这样变化的文献报告更多。fPut的下降通常被解释为腐胺通过二胺氧化酶(DAO)分解,最后形成Pro。盐胁迫下植物fPAs总量大多显示下降主要是由于其fPut含量明显高于其他多胺,fPut的变化代表了多胺总量的变化。(fSpd +fSpm)/fPut比值的上升,体现了盐胁迫下fSpd和fSpm对植物的保护作用,尤其是对细胞膜的保护作用,而fPut通常被表明是不起作用的,因而(fSpd+fSpm)/fPut比值的上升有利于增强植物细胞的再生能力[35-36]。如Chen等[19]研究表明,高盐下野生大麦遭到胁迫,伴随着fPut显著上升及fSpd和fSpm的显著下降,而接种内生真菌可明显逆转这一过程,从而提高野生大麦的耐盐性。Ke等[20]研究表明,100 mmol·L–1NaCl处理小麦幼苗16 d,其植株遭到严重胁迫,伴随着fPut显著上升及fSpd和fSpm的显著下降,而1 μmol·L–1褪黑素预处理,明显缓解植株盐害,伴随着fPut显著下降及fSpd和fSpm的显著上升。
探讨盐胁迫下作物种子萌发过程中多胺形态代谢的文献极为匮缺。本研究表明,随着盐胁迫的加剧,萌发的番茄种子中游离态多胺(fPAs)和束缚态多胺(bPAs)比重上升,而结合态多胺(cPAs)比重下降(表1),可见fPAs和bPAs在提高植物抗渗透能力中的贡献,在小麦、大豆和玉米等植物上均有这样的结果[38]。Scaramagli等[39]对马铃薯悬浮细胞进行了渗透胁迫试验,诱导出聚乙二醇(PEG)适应性细胞系,即在受到渗透胁迫时,倾向于向高氯酸不溶性结合态多胺(bPAs)转化,特别是bPut的含量较对照高达14倍。而在种子萌发中,盐胁迫中的渗透胁迫是主要胁迫因素。本研究发现盐胁迫下bPAs,乃至bPut、bSpd、bSpm均呈现显著上升,而且随着盐胁迫强度的增加,其上升越发显著,尤以bSpm的上升更为明显(表1)。Chen等[19]对野生大麦幼苗的研究表明,盐胁迫下其fPAs比重下降,cPAs是先升再降后升的“波浪式”,而bPAs比重一直上升;而接种内生真菌进一步加剧fPAs比重的下降,并导致cPAs比重的下降,加大了bPAs的比重。由此可见,fPAs、cPAs向bPAs的转化很可能是增强野生大麦幼苗耐盐、番茄种子萌发耐盐的重要原因。盐胁迫诱导野生大麦植株TPut上升、TSpd下降,以及TSpm先降后升,但是接种内生真菌导致植株耐盐性显著上升的同时,伴随TPut的显著下降以及TSpd和TSpm的显著上升,体现了TPut/TPAs的显著下降,以及(TSpd+TSpm)/TPut、TSpd/TPAs、TSpm/TPAs的显著上升[19]。本研究发现盐胁迫下萌发番茄种子也正是体现了这种耐盐特征的变化趋势,且三种形态多胺及上述比值也体现了这一变化趋势(表1),验证了三种多胺积累趋势均是从Put向Spd和Spm变化,尤其是游离态和束缚态多胺的如是变化。
4 结 论
本研究比较全面地探讨了盐胁迫对番茄“合作903”种子萌发的效应,盐胁迫延缓番茄种子萌发,甚至抑制种子萌发,对于萌发后其幼苗的建成抑制作用更强。番茄种子萌发阶段对高盐分具有一定的抗性,主要由于萌发种子多胺代谢中的(游离态亚精胺+游离态精胺)/游离态腐胺[(fSpd+fSpm)/fPut]比值的急剧上升、结合态的亚精胺和精胺(cSpd和cSpm)含量的显著上升以及束缚态各多胺的显著积累,同时可溶性糖和可溶性蛋白随着盐胁迫的加剧显著积累,从而显著提高了萌发种子的抗氧化和渗透调节能力。但是在150 mmol·L–1NaCl这样的高盐胁迫下,cSpd和cSpm的上升调控作用明显减弱,而束缚态各多胺、fSpd和fSpm的上升以及可溶性糖(SS)和可溶性(SP)积累调控作用仍在增强。当然,要进一步更好地理解番茄种子萌发中的多胺代谢、抗氧化、溶质积累等与萌发种子抗盐性的关系,阐述萌发种子中抗氧化、溶质积累和多胺的相互作用,需要就其相关关键酶的生理活性及其基因表达等分子生物学机理开展进一步研究工作。
[1] Wen P,Chen X B,Zhang L L,et al. Effects of salt and drought on winter wheat in seedling stage under different nitrogen rates[J]. Soils,2019,51(2):324—329. [文佩,陈小兵,张乐乐,等. 盐旱交叉胁迫对各施氮水平下小麦苗期的影响[J]. 土壤,2019,51(2):324—329.]
[2] Xu B,Niu N,Zhao W Y,et al. Comparative study on physiological characteristics of natural quinoa varieties against salt-alkali stress[J]. Soils,2020,52(1):81—89. [许斌,牛娜,赵文瑜,等. 天然型藜麦品种抗盐碱生理特性比较研究[J]. 土壤,2020,52(1):81—89.]
[3] Reyes-Pérez J J,Ruiz-Espinoza F H,Hernández-Montiel L G,et al. Evaluation of glycosyl-hydrolases,phosphatases,esterases and proteases as potential biomarker for NaCl-stress tolerance inL. varieties[J]. Molecules,2019,24(13):2488.
[4] Sun D Z,Han X R,Yang H S,et al. Alleviating effects of exogenous nitric oxide on oxidative damage in tomato seedling leaves under Ca(NO3)2stress[J]. Acta Pedologica Sinica,2019,56(3):728—738. [孙德智,韩晓日,杨恒山,等. 外源NO对Ca(NO3)2胁迫下番茄叶片活性氧损伤的缓解效应[J]. 土壤学报,2019,56(3):728—738.]
[5] Zheng Q S,Liu J L,Liu R,et al. Temporal and spatial distributions of sodium and polyamines regulated by brassinosteroids in enhancing tomato salt resistance[J]. Plant and Soil,2016,400(1/2):147—164.
[6] Zhang J L,Zhang J Z,Shen J B,et al. Soil health and agriculture green development:opportunities and challenges[J]. Acta Pedologica Sinica,2020,57(4):783—796.[张俊伶,张江周,申建波,等. 土壤健康与农业绿色发展:机遇与对策[J]. 土壤学报,2020,57(4):783—796.]
[7] Terzi I,Demir Y,Kocacaliskan I. Effects of sea water concentrations on germination of tomato and alfalfa seeds Effects of sea water concentrations on germination of tomato and alfalfa seeds[J]. Journal of Environmental Protection and Ecology,2013,14(3):1254—1261
[8] Yang F J,Li T L,Zang Z J,et al. Salt resistance of different tomato genotypes at seed germination stage[J]. Chinese Journal of Applied Ecology,2009,20(7):1691—1697. [杨凤军,李天来,臧忠婧,等. 不同基因型番茄种子萌发期的耐盐性[J]. 应用生态学报,2009,20(7):1691—1697.]
[9] Ayiguli A,Xireniguli,Lu S X,et al. Effects of compound salt stress on seed germination and seedling growth of 4 varieties of tomato[J]. Journal of Xinjiang Agricultural University,2016,39(6):467—471. [阿衣古力·阿布都瓦依提,西热尼古丽,卢士学,等. 复合盐胁迫对4个番茄品种种子萌发和幼苗生长的影响[J]. 新疆农业大学学报,2016,39(6):467—471.]
[10] Liu D,Hu B Z,Xu Y Q,et al. Effect of salt stress on physiological characteristics of organic tomato of germination and seedling[J]. Northern Horticulture,2015(11):23—27. [刘丹,胡宝忠,徐永清,等. 盐胁迫对有机番茄萌发及苗期生理特性的影响[J]. 北方园艺,2015(11):23—27.]
[11] Ebrahim M K H,Saleem A R. Alleviating salt stress in tomato inoculated with mycorrhizae:Photosynthetic performance and enzymatic antioxidants[J]. Journal of Taibah University for Science,2017,11(6):850—860.
[12] Singh J,Sastry E V D,Singh V. Effect of salinity on tomato(Mill.)during seed germination stage[J]. Physiology and Molecular Biology of Plants,2012,18(1):45—50.
[13] Su S,Lian W W,Yang W J,et al. Effects of salt stresses on seed germination and growth of tomato seedlings[J]. Acta Agriculturae Boreali-Sinica,2006,21(5):24—27. [苏实,练薇薇,杨文杰,等. 盐胁迫对番茄种子萌发和幼苗生长的效应[J]. 华北农学报,2006,21(5):24—27.]
[14] Jang J H,Shang Y,Kang H K,et al.galactinol synthases 1(AtGOLS1)negatively regulates seed germination[J]. Plant Science,2018,267:94—101.
[15] Yang R C,Chu Z N,Zhang H J,et al. The mechanism underlying fast germination of tomato cultivar LA2711[J]. Plant Science,2015,238:241—250.
[16] Yu Z,Jia D Y,Liu T B. Polyamine oxidases play various roles in plant development and abiotic stress tolerance[J]. Plants,2019,8(6):184.
[17] Janicka-Russak M,KabaŁa K,MŁodzińska E,et al. The role of polyamines in the regulation of the plasma membrane and the tonoplast proton pumps under salt stress[J]. Journal of Plant Physiology,2010,167(4):261—269.
[18] Wang W,Paschalidis K,Feng J C,et al. Polyamine catabolism in plants:A universal process with diverse functions[J]. Frontiers in Plant Science,2019,10:561. https://doi.org/10.3389/fpls.2019.00561.
[19] Chen T X,Li C J,White J F,et al. Effect of the fungal endophyte Epichloë bromicola on polyamines in wild barley()under salt stress[J]. Plant and Soil,2019,436(1/2):29—48.
[20] Ke Q B,Ye J,Wang B M,et al. Melatonin mitigates salt stress in wheat seedlings by modulating polyamine metabolism[J]. Frontiers in Plant Science,2018,9:914. https://doi.org/10.3389/fpls.2018.00914.
[21] Ahammed G J,Li Y,Li X,et al. Epigallocatechin- 3-gallate alleviates salinity-retarded seed germination and oxidative stress in tomato[J]. Journal of Plant Growth Regulation,2018,37(4):1349—1356.
[22] Wu L Y,Huo W,Yao D W,et al. Effects of solid matrix priming(SMP)and salt stress on broccoli and cauliflower seed germination and early seedling growth[J]. Scientia Horticulturae,2019,255:161—168.
[23] Wang X K,Huang J L. Principles and techniques of plant physiological and biochemical experiments[M]. 3rd Ed. Beijing:High Education Press,2006:171—173,180—181,274—275,276—277,282—287.[王学奎,黄见良. 植物生理生化实验原理和技术[M]. 3版. 北京:高等教育出版社,2006:171—173,180—181,274—275,276—277,282—287.]
[24] Liu J L. The effects and mechanisms of brassinolide regulating salt resistance of three dicotyledons[D]. Nanjing:Nanjing Agricultural University,2013. [刘金隆. 油菜素内酯调控三种双子叶植物耐盐性的效应及其机制[D]. 南京:南京农业大学,2013.]
[25] Liu Q H,Lei F J,Liu X L,et al. Effects of NaCl stress on seed of main cultivated varieties in Shanxi tomato[J]. Northern Horticulture,2018(17):59—63. [刘庆华,雷逢进,刘秀丽,等. NaCl胁迫对山西主栽番茄品种种子萌发的影响[J]. 北方园艺,2018(17):59—63.]
[26] Huang W,Xian Z Q,Hu G J,et al. SlAGO4A,a core factor of RNA-directed DNA methylation(RdDM)pathway,plays an important role under salt and drought stress in tomato[J]. Molecular Breeding,2016,36(3):28.
[27] Zhu J F,Yang X Y,Wu H W,et al. Research advances in salt and alkali tolerance improvement technology at the seed germination stage [J]. Biotechnology Bulletin,2020,36(2):158—168. [朱建峰,杨秀艳,武海雯,等. 植物种子萌发期耐盐碱性提高技术研究进展[J]. 生物技术通报,2020,36(2):158—168.].
[28] Xie T,Cui B S,Li S Z,et al. Management of soil thresholds for seedling emergence to re-establish plant species on bare flats in coastal salt marshes[J]. Hydrobiologia,2018,827(1):51—63.
[29] Maleki P,Bahrami H A,Saadat S,et al. Salinity threshold value of Quinoa(QuinoaWilld.)at various growth stages and the appropriate irrigation method by saline water[J]. Communications in Soil Science and Plant Analysis,2018,49(15):1815—1825.
[30] Liu X W,Yang X Y,Wu H W,et al. Effects of NaCl stress on the germination ofand evaluation of salt tolerance at germination stage[J]. Biotechnology Bulletin,2019(1):27—34. [刘晓威,杨秀艳,武海雯,等. NaCl胁迫对红砂萌发的影响及萌发期耐盐性评价[J]. 生物技术通报,2019(1):27—34.]
[31] Wang X X,Li Y,Tang J W,et al. Analysis of oat seed protein during seed germination under salt stress[J]. Acta Agriculturae Boreali-Sinica,2015,30(3):48—53. [王霞霞,李龑,唐杰伟,等. 盐胁迫对燕麦种子萌发期蛋白质组影响的研究[J]. 华北农学报,2015,30(3):48—53.]
[32] Huo W Y,Wu L Y,Yao D W,et al. Effects of solid matrix priming on tomato seeds vigor and physiological and biochemical indexes under NaCl stress[J]. Journal of Northwest A & F University(Natural Science Edition),2018,46(8):63—70. [霍文雨,吴凌云,姚东伟,等. 蛭石引发对NaCl胁迫下番茄种子活力及生理生化指标的影响[J]. 西北农林科技大学学报(自然科学版),2018,46(8):63—70.]
[33] Yang R P,Li Y F,Li J. Effects of vermiculite priming on seed germination,seedling growth and physiological characteristics of tomato under salt stress [J]. Jiangsu Agricultural Sciences,2018,46(4):135—139. [杨若鹏,李爷福,李杰. 蛭石引发对盐胁迫下番茄种子萌发、幼苗生长及生理特性的影响[J]. 江苏农业科学,2018,46(4):135—139.]
[34] Moles T M,Guglielminetti L,Huarancca Reyes T. Differential effects of sodium chloride on germination and post-germination stages of two tomato genotypes[J]. Scientia Horticulturae,2019,257:108730.
[35] Wang W,Liu J H. CsPAO4offunctions in polyamine terminal catabolism and inhibits plant growth under salt stress[J]. Scientific Reports,2016,6:31384.
[36] Afzal I,Munir F,Ayub C M,et al. Changes in antioxidant enzymes,germination capacity and vigour of tomato seeds in response of priming with polyamines[J]. Seed Science and Technology,2009,37(3):765—770.
[37] Bueno M,Lendínez M L,Aparicio C,et al. Germination and growth ofand:Two strategies to survive in saline habitats[J]. Flora,2017,227:56—63.
[38] Gupta K,Dey A,Gupta B. Plant polyamines in abiotic stress responses[J]. Acta Physiologiae Plantarum,2013,35(7):2015—2036.
[39] Scaramagli S,Biondi S,Leone A,et al. Acclimation to low water potential in potato cell suspension cultures leads to changes in putrescine metabolism[J]. Plant Physiology and Biochemistry,2000,38(4):345—351.
Effects of Salt Stress on Form of Polyamine and Antioxidation in Germinating Tomato Seed
CHEN Jun1, GUAN Xin2, 3, FAN Cuizhi3, ZHAO Haiyan3, WU Xinyi3, HAN Ying1, GU Zhizhuang3, ZHENG Qingsong3, 4†, ZHENG Chunfang2†
(1. College of Horticulture and Technology, Suzhou Polytechnic Institute of Agriculture, Suzhou, Jiangsu 215008, China; 2. College of life and Environmental Sciences, Wenzhou University, Wenzhou, Zhejiang 325035, China; 3. College of Resources and Environmental Science, Nanjing Agricultural University, Nanjing 210095, China; 4. Research Center of Sichuan County Economy Development, Mianyang Normal University, Mianyang, Sichuan 621000, China)
【Objective】Tomato is one of the fruit and vegetable crops cultivated with the highest economic benefits in open fields and greenhouses. It is of great necessity to explore salt tolerance of germinating tomato seeds and its mechanism, especially changes in polyamine metabolism in the seeds. 【Method】In this study, Impacts of NaCl stress on seed germination percentage (SGP) and development of radical and hypocotyl, seed water content (SWC), seed vigor index (SVI), Malondialdehyde (MDA) content, protective enzyme activity, solute accumulation and contents of various forms of polyamine of/in the seeds of tomato, "Hezuo 903" in variety were studied. 【Result】When the soil was treated with 25 or 50 mmol·L–1NaCl for seven days, germination of tomato seeds was slightly delayed, but SGP was not affected, however, SVI of the tomato decreased significantly. With rising salt concentration in the treatment, both the SGP and SVI decreased significantly. With SGP and SVI cited as dependent variables, and NaCl concentration in the treatment as independent variable, salt tolerance threshold for seed germination and seedling establishment was 106.1 mmol·L–1NaCl (0.62%) and 43.38 mmol·L–1NaCl (0.25%), respectively. With rising NaCl concentration, MDA content, soluble protein (SP) content and the activities of enzymes like SOD, POD and CAT in germinating seeds were increased significantly, also, the contents of fPut, fSpd, fSpm, (fSpd+fSpm)/fPut, bPut, bSpd, and bSpm in the germinating tomato seeds all increased significantly, but (bSpd+bSpm)/bPut did not change much. Compared with the seeds in CK, the seeds treated with 50 mmol·L–1NaCl did not change much in conjugated Put (cPut), but increased significantly in the contents of cSpd, and cSpm and the ratio of (cSpd+cSpm)/cPut. With increasing NaCl concentration, the seeds declined gradually in cPut, cSpd, cSpm and (cSpd+cSpm)/cPut. It was also found that salt stress significantly reduced the content of total polyamines (TPAs) and free total polyamines (fPAs) in germinating tomato seeds, but increased the content of free total polyamines with rising NaCl concentration. 【Conclusion】Salinity delays and even inhibits germination of tomato seeds, and has a much stronger inhibitory effect on establishment of the seedlings after germination. Tomato seeds per se have certain salt tolerance during their germination phase mainly due to the drastic increase in (fSpd+fSpm)/fPut, cSpd, cSpm, and significant accumulation of all the forms of bound polyamines, SS and SP in the seeds under salt stress, thus raising the seeds’ antioxdation and osmotic adjustment capacities. However, when salt reaches as high as 150 mmol · L–1NaCl, the effects of salt stress raising cSpd and cSpm weaken, while the effects raising bound polyamine of all forms, fSpd and fSpm, and regulating SS and SP accumulation are still intensify.
Tomato; Salt stress; Germination; Antioxadation; Solute accumulation; Polyamine form
Q945.78
A
10.11766/trxb202002180051
陈军,关欣,范翠枝,赵海燕,吴馨怡,韩鹰,顾志壮,郑青松,郑春芳. 盐胁迫对番茄种子萌发中多胺形态变化和抗氧化的影响[J]. 土壤学报,2021,58(6):1598–1609.
CHEN Jun,GUAN Xin,FAN Cuizhi,ZHAO Haiyan,WU Xinyi,HAN Ying,GU Zhizhuang,ZHENG Qingsong,ZHENG Chunfang. Effects of Salt Stress on Form of Polyamine and Antioxidation in Germinating Tomato Seed [J]. Acta Pedologica Sinica,2021,58(6):1598–1609.
*国家自然科学基金项目(31672141)、江苏省现代农业(蔬菜)产业技术体系-苏州推广示范基地项目(JATS[2019]364)和温州市科技计划项目(N20180001)共同资助Supported by the National Natural Science Foundation of China(No. 31672141),the Modern Agriculture(vegetable)Industry Technology System of Jiangsu Province- the Extension Demonstration Base Program of Suzhou City of Jiangsu Province(No. JATS[2019]364)and the Science and Technology Program of Wenzhou City of Zhejiang Province(No. N20180001)
Corresponding author,E-mails:qszheng@njau.edu.cn;20195101@wzu.edu.cn
陈 军(1976—),男,江苏盐城人,副教授,主要研究方向:蔬菜栽培生理与生产技术。E-mail:chenjun@szai.edu.cn
2020–02–18;
2020–06–08;
2020–09–08
(责任编辑:陈荣府)
