仿刺参葡聚糖结合蛋白的重组表达与功能研究
2021-11-15贾昌锋陈知雨雷一萱孔令明
贾昌锋,陈知雨,雷一萱,张 雷,孔令明
(山东大学海洋学院,山东 威海 264209)
机体免疫系统是生物抵抗病原体或病原微生物侵害的主要手段。由于无脊椎动物缺乏抗体生成机制,因此无法进行适应性免疫反应,但它们却具有高效的固有免疫[1]。固有免疫是用于生物机体免疫和防御的一种古老且高效的手段,能够通过模式识别受体(Pattern recognition receptor,PRR)识别外界的病原微生物,并将相关识别信号传递到细胞核中,进而诱导相关的免疫效应因子进行转录和表达[2,3]。β-1,3-葡聚糖结合蛋白(β-1,3-glucan-binding pro⁃tein,GBP)作为一种免疫应答反应的模式识别受体,可介导入侵病原体的识别,激活蛋白酶联反应,促进抗菌肽的合成,提高对细菌的抵抗力,在生物的先天免疫中起着关键作用[4,5]。GBP 首次是从家蚕(Bom⁃byx mori)的血淋巴中分离出来[6],而在甲壳动物中,其在淡水螯虾(Pacifastacus leniusculus)中最先被发现[7]。此外,GBP 与某些革兰氏阴性菌结合蛋白(Gram-negative bacteria binding protein,GNBP)在对β-1,3 和β-1,3-1,4 葡聚糖酶的结合区域中表现出同源性,且其可以识别脂多糖(lipopolysaccharide,LPS)和β-1,3-葡聚糖(β-1,3-glucan,βG)[8]。目前,海洋无脊椎动物中GBP 的研究主要集中在甲壳类和贝类中,如中国对虾(Fenneropenaeus chinen⁃sis)[9]、南美白对虾(Litopenaeus vannamei)[10,11]、日本对虾(Marsupenaeus japonicus)[12]、罗氏沼虾(Macro⁃brachium rosenbergii)[13]、短沟对虾(Penaeus semisul⁃catus)[14]、文蛤(Meretrix meretrix)[15]等,结果表明它们在受到病原菌刺激时,会被诱导表达进而参与到生物的先天免疫中[10,14]。
仿刺参(Apostichopus japonicus)隶属棘皮动物门(Echinodermata)海参纲(Holothuroidea)楯手目(As⁃pidochirotida)刺参科(Stichopodidae),为海味“八珍”之一,有着很高的医药和营养价值[16-18]。其在中国山东和辽宁半岛以及河北沿岸分布较为广泛[19-21]。近年来,由于人们生活水平和健康意识的不断提高,仿刺参市场需求量呈现逐年增加的态势,水产养殖规模呈现持续扩大态势,使得仿刺参逐渐成为中国水产养殖的重要经济物种之一[19]。据报道,当前中国仿刺参水产养殖面积达238 183 hm2,产量高达174 340 t[22]。但由于持续恶化的海洋环境、海洋富营养化程度的日趋加重,养殖周期长和其自身免疫力低下等因素,仿刺参养殖业常会受到大规模的病害威胁,大范围死亡事件时有发生。这极大地制约了仿刺参养殖业的持续发展[20,23]。而使用常见的化学药物(如二氧化氯、高锰酸钾、福尔马林及抗生素等)进行治疗,会对仿刺参造成毒害作用。β-1,3-葡聚糖结合蛋白可增强生物抗菌力,但尚未见其在仿刺参中的相关报道。本研究利用分子生物学手段克隆仿刺参β-1,3-葡聚糖结合蛋白,并对其功能进行探索,有助于了解仿刺参抵抗病原微生物入侵的机制,可为水产养殖业提供疾病防治的理论依据。
1 材料与方法
1.1 材料
1.1.1 仿刺参 仿刺参(约65 g/只)购于威海帝王宫水产市场,试验前将其放于流动海水池(温度20 ℃)中饲养一周。然后选取健康的个体进行解剖,并将解剖所得组织投入液氮,-80 ℃保存,用于总RNA 的提取。
1.1.2 试验细菌 利用3 种革兰氏阳性菌和3 种革兰氏阴性菌完成AJ-GBP 重组蛋白的相关活性分析。其分别为枯草芽孢杆菌(Bacillus subtilis)、金黄色葡萄球菌(Staphylococcus aureus)、藤黄短小杆菌(Curtobacterium luteum)、鳗弧菌(Vibrio anguillarum)、大肠杆菌(Escherichia coli)和绿脓杆菌(Pseudomonas aeruginosa)。
1.2 方法
1.2.1 总RNA 的提取与cDNA 合成 利用TransZol(TransGen Biotech 公司)从仿刺参各组织中提取总RNA,并用1% 琼脂糖凝胶电泳检测总RNA 提取质量。参照EasyScript First-Strand cDNA Synthesis Su⁃perMix(TransGen Biotech 公司)进行cDNA 第一条链的合成,引物见表1。
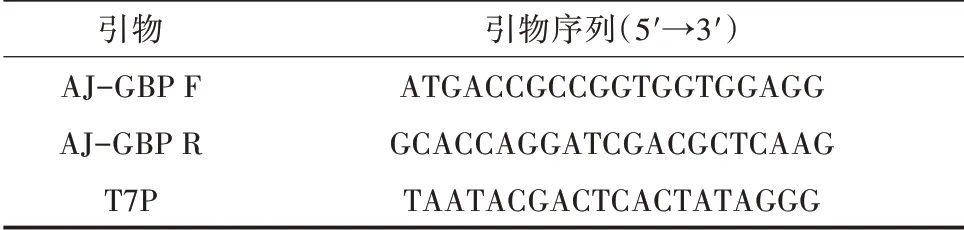
表1 AJ-GBP 基因扩增和表达所用引物
1.2.2 构建AJ-GBP 原核重组表达载体 根据已测序的仿刺参转录组,获得仿刺参GBP 的cDNA 序列并设计一对基因特异性引物(AJ-GBP F,AJ-GBP R),用于后续的聚合酶链式反应PCR。PCR 反应采用EasyPfu DNA Polymerase 试剂盒(TransGen Biotech公司)。其体系(50 μL)为:引物(8 μmol/L)各2 μL,2×easypfu 为25 μL,cDNA 为0.5 μL,ddH2O 为20.5 μL。 PCR 反应条件如下:94 ℃4 min;94 ℃30 s,52 ℃30 s,72 ℃1 min,40个循环;72 ℃10 min。然后利用MiniBEST DNA Fragment Purification Kit(TaKa⁃Ra Bio 公司)完成PCR 产物的回收,并将获得AJGBP基因片段与pEASY-Blunt E2(TransGen Biotech公司)进行连接。利用BL21(DE3)pLysS Chemically Competent Cell 试剂(TransGen Biotech 公司)将连接产物转入大肠杆菌BL21 感受态细胞,挑选5~10 个单菌落并接种于含有AMP(Solarbio 公司)浓度为100 μg/mL 的LB 肉汤(Solarbio 公司)。使用rTaq试剂(TaKaRa Bio 公司)和载体上引物(T7P)、AJ-GBP基因下引物(AJ-GBP R)进行菌液PCR,鉴定阳性重组子。PCR 体系(50 μL)为:T7P(8 μmol/L)为2 μL,AJ-GBP R(8 μmol/L)为2 μL,rTaq为0.25 μL,dNTP(2.5 μmol/L)为4 μL,10×Buffer 为5 μL,菌液为0.5 μL,ddH2O 为36.25 μL。之后将确定的重组阳性子进行测序。
1.2.3AJ-GBP基因序列分析AJ-GBP的cDNA 序列和氨基酸序列利用国家生物技术信息中心(NCBI)(http://blast.ncbi.nlm.nih.gov/Blast.cgi)和专业蛋白分析系(http://www.expasy.org/)进行分析。采用Sig⁃nalP 5.0(http://www.cbs.dtu.dk/services/SignalP/)预测信号肽。使用SWISS-MODEL(http://swissmodel.expasy. org/)预测三维结构。 使用SMART service(http://smart. embl-heidelberg. de/) 和 HMMER(https://www.ebi.ac.uk/Tools/hmmer/)预测特定保守区域。利用NetNGlyc 1.0 Server(http://www.cbs.dtu.dk/services/NetNGlyc)预测蛋白质糖基化位点。
1.2.4 AJ-GBP 蛋白重组表达 将重组阳性菌株按1∶10 接种于1 mL 含有AMP 的新鲜LB 肉汤中(AMP浓度为100 μg/mL),37 ℃180 r/min 过夜培养。然后将此菌液按1∶100 接种于150 mL 新鲜LB 肉汤(含有AMP,且AMP 浓度为100 μg/mL)中,37 ℃180 r/min培养至OD600为0.6。加入IPTG(终浓度0.8 μmol/L),37 ℃180 r/min 培养5 h。离心收集细菌,用PBS 缓冲液清洗3 遍后重悬。将细菌破碎后12 000 r/min离心20 min 收集沉淀包涵体蛋白。沉淀包涵体蛋白先用Buffer A(5 mmol/L EDTA,50 mmol/L Tris-HCL)清洗2 次,再用Buffer B(5 mmol/L EDTA,50 mmol/L Tris-HCl,2 mol/L 尿素)清洗2 次,最后用Buffer C(10 mmol/L Tris-HCL 0.1 mol/L NaH2PO4,8 mol/L 尿素)溶解。采用0.45 μm 滤膜过滤后,再使用Milli⁃pore10 kd 超滤离心管(Millipore)纯化重组蛋白,从而获得纯化重组蛋白。
1.2.5 AJ-GBP 重组蛋白活性分析
1)细菌凝集活性分析。将枯草芽孢杆菌、金黄色葡萄球菌、藤黄短小杆菌、大肠杆菌和绿脓杆菌分别接种到LB 肉汤中,37 ℃培养至OD600为0.6;鳗弧菌接种TCBS 培养基,28 ℃培养至OD600为0.6。然后用无菌生理盐水稀释至OD600为0.001。5 000 r/min离心10 min 获得沉淀菌体,用TBS 缓冲液洗涤沉淀3次后将沉淀重悬,使菌数为2×109个/mL。再将75 μL重组蛋白(约600 μg/mL)分别加入96 孔板中,加入30 μL 菌液,室温孵育1 h。阴性对照组则用牛血清白蛋白(BSA)代替重组蛋白。在倒置显微镜下查看细菌凝集情况,从而获得试验结果。
2)抑菌活性分析。将枯草芽孢杆菌、金黄色葡萄球菌、藤黄短小杆菌、大肠杆菌和绿脓杆菌分别接种到LB 肉汤中,37 ℃培养至OD600为0.6;鳗弧菌接种到TCBS 培养基,28 ℃培养至OD600为0.6。然后把各菌液用新鲜培养基稀释20 倍后备用。向96 孔细胞培养板中各加入100 μL 菌液和100 μL 重组蛋白并将二者混匀,37 ℃培养3 h 后,利用酶标仪每隔30 min 记录一次OD600值。BSA 为对照组,并设置3 个平行,统计OD600值并绘制不同组的生长曲线。
3)细菌结合活性分析。将枯草芽孢杆菌、金黄色葡萄球菌、藤黄短小杆菌、大肠杆菌和绿脓杆菌分别接种到LB 肉汤中,37 ℃培养至OD600为0.6;鳗弧菌接种到TCBS 培养基,28 ℃培养至OD600为0.6。将各菌液5 000 r/min 离心10 min 获得沉淀菌体,利用TBS 缓冲液洗涤沉淀3 次后将沉淀重悬,使其含有3.5×108个/mL 细胞。取200 μL 菌悬液与200 μL 重组蛋白(约600 μg/mL)混匀,室温条件下振荡孵育30 min。5 000 r/min 离心10 min 弃上清液并收集菌体。利用TBS 洗涤菌体4 次,将第4 次洗涤液和菌体分别加入蛋白上样缓冲液,然后进行10 min 沸水浴,离心收集上清液后进行SDS-PAGE 以及Western blotting 检测目的条带。
4)糖结合活性分析。分别取葡聚糖(80 μg/mL)、脂多糖(80 μg/mL)、肽聚糖(80 μg/mL)各50 μL 加入96 孔细胞培养板中,37 ℃过夜晾干;次日60 ℃孵育30 min,然后在每孔各加入200 μL 含5% 脱脂奶粉的PBS,37 ℃封闭2 h;倒掉封闭液,再在每孔中加入200 μL PBST(20%Tween-20∶PBS=1∶100)洗4 次,每次5 min;后在每孔中加入50 μL 蛋白(蛋白用含1% 脱脂奶粉的PBS 二倍梯度稀释,共6 组蛋白;对照组使用BSA);在细胞培养板中加入200 μL 的PBST(20%Tween-20∶PBS=1∶100)洗4 次,每次5 min;将一抗(大鼠抗His-tag 抗体)用1% 脱脂奶粉的PBS 按照1∶300 稀释后将其在每孔中各加入100 μL,室温条件下放置2 h;倒去一抗,再在细胞培养板中加入200 μL 的PBST(20%Tween-20∶PBS=1∶100)洗4 次,5 min/次;将辣根过氧化物酶标记的兔抗大鼠二抗用1% 脱脂奶粉的PBS 按1∶3 000 稀释后在细胞培养板各加入100 μL,室温条件下放置2 h;倒掉二抗后在每孔中加入200 μL 的PBST(20%Tween-20:PBS=1∶100)洗4 次,5 min/次。利用EL-TMB 显色试剂盒(Sangon Biotech 公司)得到显色结果,并在酶标仪450 nm 处读取吸光度。
2 结果与分析
2.1 AJ-GBP 基因克隆与序列分析
克隆所得AJ-GBP基因全长660 bp,开放阅读框(Open reading frame,ORF)长657 bp,可翻译成219个氨基酸。AJ-GBP重组蛋白是糖基水解酶家族16 中的一员,分子质量为24.64 kDa,等电点为5.94,无信号肽,链型为单链,拓扑结构为线型,且AJ-GBP具有2 个蛋白激酶C 磷酸化位点(S36EK,S83AR),3个酪蛋白激酶II 磷酸化位点(S36EKE,S55PAD,T186FGD),1 个β-1,3-葡聚糖酶位(W127-E132-I133-D134),1 个β-1,3-多糖连接识别基序(FH⁃NYTLVWTADSLDFYLDG),1个多糖结合基序(VFAQLPKGDWLWPAIWLLP)和1 个葡聚糖酶基序(WPASGEIDLVES)。此外,在AJ-GBP 重组蛋白的第17 位和第193 位发现有糖基化位点存在(图1)。

图1 AJ-GBP 氨基酸序列中位点和基序预测
2.2 AJ-GBP 重组蛋白活性鉴定
2.2.1 细菌凝集活性分析 细菌凝集试验对AJGBP 重组蛋白凝集枯草芽孢杆菌等6 种细菌的能力进行测定,结果如图2 所示。由图2 可知,AJ-GBP重组蛋白对革兰氏阳性菌以及革兰氏阴性菌具有明显的凝集效果。

图2 AJ-GBP 的凝菌结果
2.2.2 抑菌活性分析 抑菌试验对AJ-GBP 重组蛋白抑制6 种细菌的能力进行测定,如图3 所示。由图3 可知,AJ-GBP 重组蛋白能够抑制革兰氏阴性菌和革兰氏阳性菌的生长,但对金黄色葡萄球菌和绿脓杆菌的抑制作用并不明显。
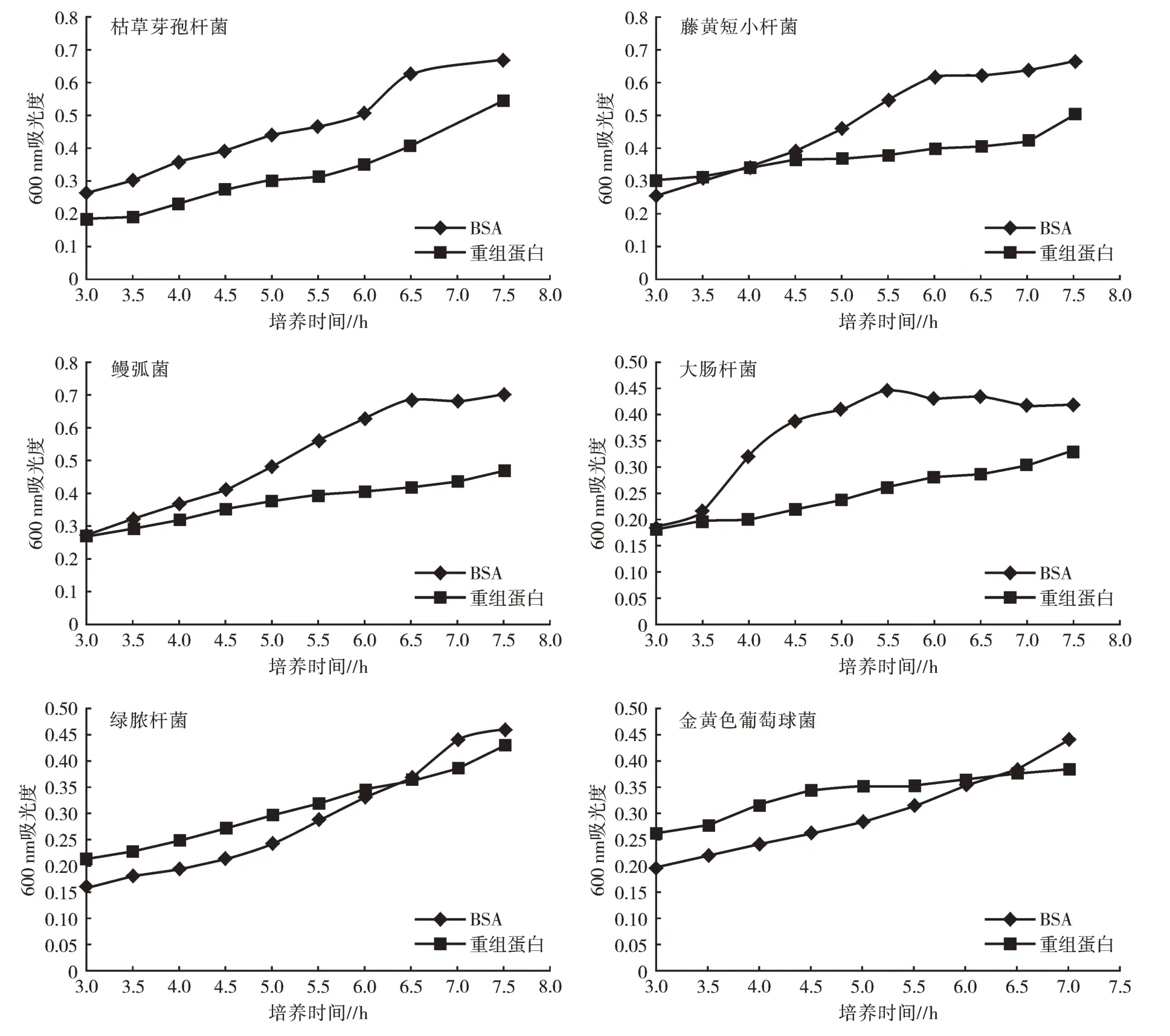
图3 AJ-GBP 的抑菌结果
2.2.3 细菌结合活性分析 细菌结合试验测定AJGBP 重组蛋白对6 种细菌结合能力。图4A 中2~7 泳道均有明显的重组蛋白条带,说明AJ-GBP 对枯草芽孢杆菌、大肠杆菌、鳗弧菌、金黄色葡萄球菌、藤黄短小杆菌、绿脓杆菌均有结合活性。图4B 中除泳道2 外,其余泳道中均无重组蛋白残留,说明未与菌体结合的重组蛋白已被洗净。结果表明,AJ-GBP 重组蛋白对革兰氏阴性菌、革兰氏阳性菌有明显的结合活性。

图4 AJ-GBP 的菌结合活性
2.2.4 糖结合活性分析 对葡聚糖、肽聚糖、脂多糖进行糖结合试验,结果表明,AJ-GBP 重组蛋白对葡聚糖有明显的结合活性(图5),且结合强度与蛋白浓度成正比。但AJ-GBP 重组蛋白对脂多糖、肽聚糖没有明显的结合活性。

图5 AJ-GBP 与葡聚糖结合活性
3 讨论
试验成功地将仿刺参GBP基因的cDNA 进行克隆,并命名为AJ-GBP,其全长660 bp。AJ-GBP 重组蛋白具有219 个氨基酸,但不具有信号肽。研究表明,中国对虾的GBP(FcβGBP-HDL)也被证实没有信号肽[9]。此外,序列比对结果显示,AJ-GBP 属于糖基水解酶家族16,且没有虾β-GRP 特有的细胞黏着位点RGD,而在氨基酸序列的107 位置发现KGD。RGD 主要存在于甲壳类动物GBP 中,可激活酚氧化酶级联反应以清除入侵的病原体[12,24],而KGD 则在维持蛋白稳定性方面发挥了巨大作用[25,26]。
GBP 可以通过结合、凝集和激活酚氧化酶活性等方式来激活对入侵病原微生物的免疫防御机制[10]。研究结果表明,AJ-GBP 重组蛋白对革兰氏阳性菌和革兰氏阴性菌均具有明显的凝集作用。说明AJ-GBP 可能参与了仿刺参的免疫防御机制。且AJ-GBP 重组蛋白虽然能抑制革兰氏阳性菌和革兰氏阴性菌生长,但对金黄色葡萄球菌和绿脓杆菌的抑制作用并不明显。然而研究人员从南美对虾中获取的GBP 不具有抑菌能力[10],表明GBP 具有一定的物种特异性。AJ-GBP 重组蛋白对革兰氏阴性菌和革兰氏阳性菌有明显的结合活性。由于在无脊椎动物中,识别入侵病原体或病原微生物是免疫防御机制的第一步[11],因此AJ-GBP 可能参与了仿刺参的固有免疫反应,并在其中发挥了关键性作用。这点在罗氏沼虾、中国对虾、南美对虾中已被证实[9,10,13]。此外,大多数GBP 对葡聚糖具有明显的结合活性。AJ-GBP 重组蛋白也证明了这一点,其对葡聚糖具有明显的结合活性,而对脂多糖、肽聚糖没有明显的结合活性。但有报道称,从淡水螯虾和澳大利亚红螯螯虾(Cherax quadricarinatus)中分离出的GBP 对脂多糖和葡聚糖具有结合活性[27,28]。GBP 糖结合能力的不同表明来自不同生物的蛋白之间存在差异性,再一次说明GBP 具有物种特异性。综上所述,AJ-GBP 重组蛋白具有明显的抗菌活性,因此其在制备生物抗菌药物、解决当前养殖中抗生素抗药性具有十分重要的意义。
