云南景迈古茶园茶叶内生真菌多样性初步研究
2021-11-15张建坤王振华
张建坤,周 剑,彭 超,王 琴,汪 飞,王振华
(1.武汉理工大学,武汉 430070;2.思茅海关综合技术服务中心,云南 普洱 665000;3.中国质量认证中心武汉分中心,武汉 430062;4.武汉海关技术中心,武汉 430054)
早在1884 年,Heinrich Anton de Bary 提出内生菌(Endophyte)一词,指在植物组织中存在的任何微生物体。现在认为,在植物生命的某一段时间内,完全或部分生活史阶段可以在植物组织内部定殖且不对宿主本身造成明显伤害的微生物都是内生菌。自1898 年Vogl 于黑麦草(Lolium perenneL.)的种子中分离得到第一个内生真菌以来,植物组织中内生真菌便一直倍受研究者关注。这些内生真菌在陆地生态系统中起着关键作用,极大地影响着植物个体的生长发育、种群进化、群落结构和环境适应性[1]。迄今为止,认为植物内生真菌(Endophytic fungi)是对植物贡献最大的一类内生菌。内生真菌不仅在宿主植物内发挥多种重要作用,也是人类孜孜以求的珍贵真菌资源,大量研究表明,部分内生真菌在医药、农业、环境等领域显示了良好的应用前景[2-4]。
茶树(Camellia sinensis)是一种原产中国的常绿乔木,茶叶中富含多胺、多酚、咖啡因、花青素和其他成分,茶饮品成为人类最为喜爱的饮品之一。茶树全株都有内生真菌分布,与茶叶的品质和茶饮品的口感密切相关。据统计,截至2020 年9 月份,已经报道的茶树内生真菌包括3 门5 纲14 目24 科34 属,其中刺盘孢菌(Colletotrichumspp.)、间座壳菌(Dia⁃porthespp.)、青霉菌(Penicilliumspp.)和木霉菌(Trichodermaspp.)是茶树的优势内生真菌[5]。研究表明,地理环境、茶树种类与品种、不同组织对内生真菌的优势种群分布和群落结构都有决定性的影响[6,7]。本研究以云南省景迈县千年古茶园茶叶为研究对象,分离并鉴定了干燥茶叶的内生真菌,发现了多个新的茶叶内生真菌和多个新的真菌种,初步揭示了古茶园茶叶内生真菌的多样性和特异性。
1 材料与方法
1.1 样品采集与保存
2017年10月,从中国云南省景迈县惠民乡景迈村和芒景村的一处古茶园中采集茶叶样品。古茶园已有1 300 多年的普洱茶种植历史,种植面积1 800 hm2。取样茶树树龄都在千年以上,株高2~10 m。随机选择植株,采集有或无明显病害症状的茶叶,将同一株茶树的茶叶放入一个无菌塑料袋中,48 h 内带回实验室。除少数样品用于病原菌分离外,其余样品装入牛皮纸袋中自然干燥,室温保存。
1.2 内生真菌分离与纯化
挑选健康、无明显病斑的干燥茶叶,用自来水冲洗2 次,75% 乙醇浸泡60 s,再用0.5% 次氯酸钠浸泡3 min,75% 乙醇漂洗30 s,最后用无菌蒸馏水洗涤3次,用于茶叶表面杀菌。用无菌剪刀将表面杀菌后的茶叶剪成大小0.2 cm×0.2 cm(长×宽)的叶组织块。取4 个叶组织块均匀地放置于PDA 平板周边,每片茶叶重复接种3 个平板。作为对照,加入100 μL 最后一次洗涤水于相同的平板中,以检验表面杀菌的效果。用封口膜密封培养皿,于恒温培养箱中(25±0.3)℃培养7 d,定期检查菌丝生长情况。将具有明显真菌菌落特征的菌丝转接至新的PDA 平板中,(25±0.3)℃培养,以获得纯培养物。
1.3 内生真菌ITS 扩增
将真菌纯培养物接种于含15 mL PDB 的100 mL锥形瓶中,在(25±0.3)℃条件下静置培养7 d。菌丝经过滤后,在液氮中充分研磨成粉末,用于基因组DNA 提取。用PureLinkTM植物基因组DNA 纯化试剂盒(Invitrogen,Thermofisher,Shanghai,China)提取基因组DNA,操作步骤按照产品说明书进行。用保守引物ITS1F 和ITS4R 进行PCR,扩增rDNA 的ITS(In⁃ternal Transcribed Spacer)序列,或用引物EF1-728F和EF1-986R 扩增TEF(Translation Elongation Fac⁃tor)基因(表1)。

表1 茶叶内生真菌ITS 和TEF 的PCR 引物和扩增条件
用1.5% 的琼脂糖凝胶电泳检测PCR 产物,DNA片段大小预计在450~700 bp(ITS)或180~250 bp(TEF)。
1.4 DNA 测序与系统进化分析
PCR 产物直接送至上海生工公司测序。将所得序列用BLASTn 程序(http://blast.ncbi.nlm.nih.gov)在GenBank 数据库中搜索最佳匹配序列。在MEGA7.0中,用Clustal W 对DNA 序列进行多重比对,用邻接法(Neighbour Joining Method)构建DNA 的系统发育树,Bootstrap 分析重复1 000 次。
2 结果与分析
在PDA 平板上共接种486 个叶组织块,获得103 个纯培养的真菌分离物,分离率为21.2%。根据菌落的形态学特征,从中选取30 个真菌分离物,进行ITS 的PCR 和测序。分离物1 未能获得测序结果,后改用TEF 引物进行PCR 和测序,从而获得TEF 基因的序列。30 份DNA 序列已提交至GenBank 相关数据库,登录号为MZ617296-MZ617324。
Blastn 搜索和比对结果显示,30 个分离物分别属于2 门3 纲7 目11 科13 个属(表2),其中23 个是子囊菌,余下6 个是担子菌,分离物20 为粪壳菌纲(Sordariomycetes)真菌,但未获得属一级水平的分类信息。属于鬼伞属(Coprinellus)的分离物最多,有6个,占比为20.0%,是茶叶样品中内生真菌的优势属,多节孢属(Nodulisporium,16.7%)、炭团菌属(Hy⁃poxylon,13.3%)和轮层炭菌属(Daldinia,10.0%)依次排在其后。
用邻接法构建了29 个分离物的ITS 系统发育树(图1),23 个子囊菌分离物和6 个担子菌分离物构成发育树的2 个大支。分离物24 是子囊菌,与对应的最佳匹配分离物的序列相似性仅有90.87%,E值为5e-172(表2),表明该分离物与最佳匹配分离物的亲缘关系较远,在发育树上与同是炭团菌的分离物14、17 和25 相差甚远,独自构成一个分支。分离物5、6、10、18、21、26 同为鬼伞属,在进化树中构成同一分支,且自展值为100,较为可信。然而,分离物6、10、18、21、26 与对应分离物的序列相似性都只有96% 左右(表2),与同为鬼伞菌的分离物5 也存在一定差异。

图1 茶叶内生真菌ITS 序列的系统发育树
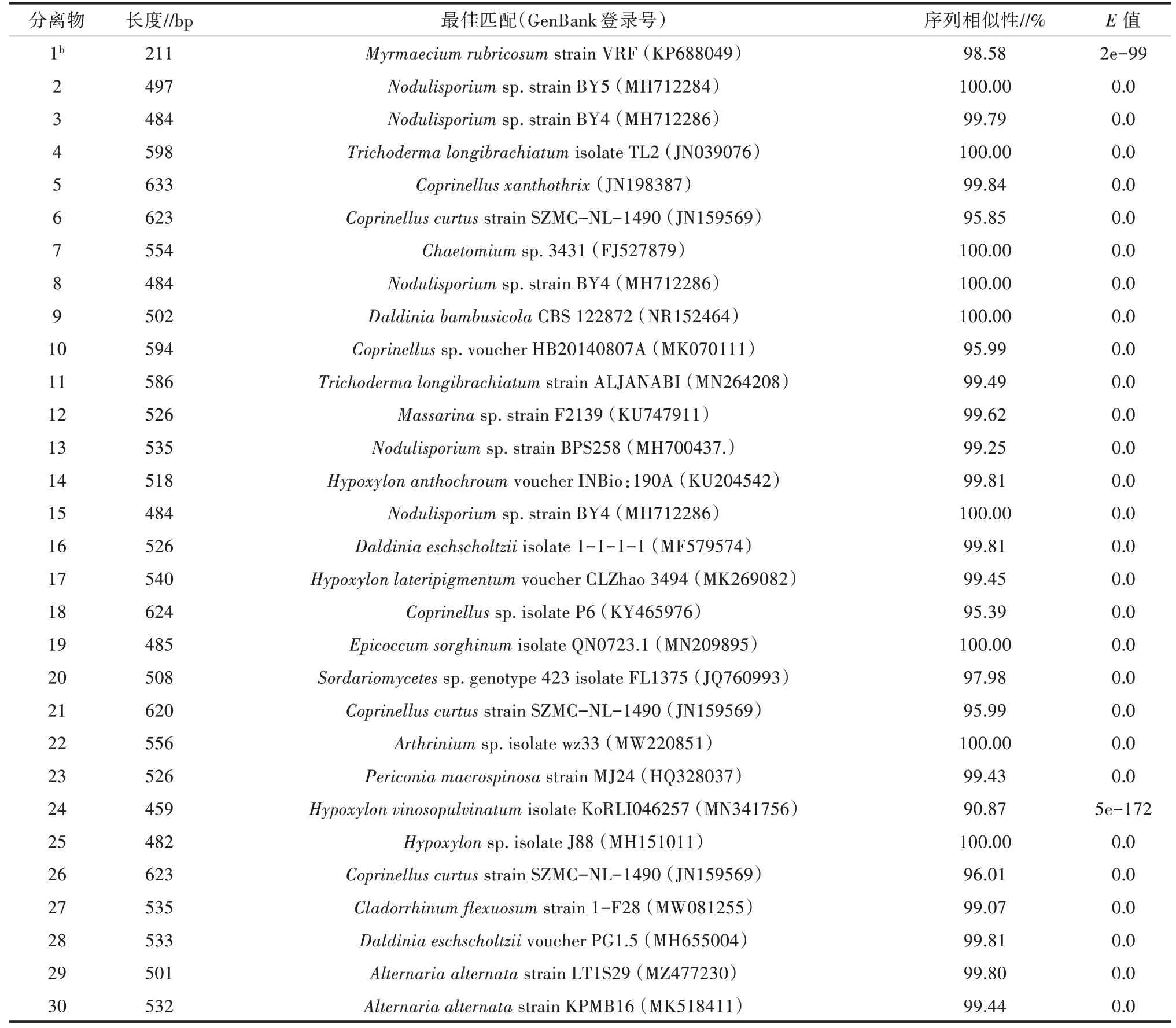
表2 茶叶内生真菌的可培养分离物a
3 讨论
本研究以云南景迈古茶园的普洱茶叶为试验材料,用平板培养法从储存3 年多的干燥茶叶样品中分离内生真菌。尽管内生真菌的分离率比较低,仅21.2%,与常规的新鲜茶叶达到80% 或更高的分离率相距甚远,但仍获得了13 个属的内生真菌分离物,初步展示了古茶园茶叶内生真菌的多样性。
与以往报道不同,本研究没有分离到常见的茶树内生真菌,如青霉菌、炭疽菌(Colletotrichumspp.)、镰刀菌(Fusariumspp.)、间座壳菌、拟盘多毛孢菌(Pestalotiopsisspp.)、茎点霉菌(Phomaspp.)、拟茎点霉菌(Phomopsisspp.),但也分离到了常见的木霉菌和链格孢菌(Alternariaspp.)[5-10]。根据现有文献报道,本研究获得的1 目4 科8 属共20 个真菌分离物是新发现的茶树内生真菌,其中所有的碳团菌、多节孢菌(Nodulisporiumspp.)、鬼伞菌等分离物都未曾在茶树植物中报道过(表3)。有报道显示,用PDA 平板培养法分离云南省一处野生茶园茶叶的内生真菌,但没有分离到这8 个属的内生真菌[11]。还有研究表明,用二代测序技术分析茶叶的内生真菌,在检测到的35 个高相对丰度的OTU(Operation⁃al Taxonomic Unit)(科一级水平)中,也没有检测到本研究分离到的这8 个属的内生真菌[12]。此外,分离物24 与对应的最佳匹配分离物的序列相似性仅90.87%,极可能是真菌界里的新种或新属,而分离物6、10、18、21、26 与对应分离物的序列相似性也只有96% 左右,可能是鬼伞属的新种,需要后续鉴定才能确定它们的分类地位。

表3 本研究新发现的茶叶内生真菌分离物
云南景迈、芒景境内的千年古茶园是目前世界上保存最完好、年代最久远、面积最大的自然茶园。古茶园有近乎封闭的自然环境,人为干预少,其内生菌种类和其他人工栽培茶园应该存在较大的区别,本研究结果证明了这一点。此外,本研究采用的干燥茶叶样品也可能是造成这种差别的重要原因,干燥可能改变了部分茶叶内生真菌的群落结构,从而导致了内生真菌在PDA 平板上的不同生长格局,最终产生了与新鲜茶叶不同的结果,显示了云南景迈古茶园茶叶内生真菌的特异性。
本研究结果只是揭示了云南景迈古茶园茶叶内生真菌多样性的冰山一角,但为后续茶树内生真菌的研究提供了参考。如果以新鲜茶树样品作试验材料、组合使用多种培养平板等,应该可以分离到更多种类的内生真菌。如果平板培养法与高通量的二代测序技术相结合,则可以更多地揭示茶树内生真菌的多样性。据此,可以解释古茶园茶树内生真菌的生态学意义,还可以发掘更多有价值的真菌种类,为未来在医药、农业、环境等应用领域提供宝贵的真菌资源。
