农杆?菌介导葡萄灰葡萄孢遗传转化条件优化
2021-11-15李廷刚巩东营
李廷刚,巩东营
(1.山东省葡萄研究院,山东 济南 250100;2.山东省农业科学院农产品加工与营养研究所,山东 济南 250100)
灰霉病是葡萄生长及贮存期的重要病害,在我国主要由灰葡萄孢(Botrytis cinerea)侵染所致[1]。灰葡萄孢在自然界中可侵染200多种植物,包括番茄、丝瓜、草莓、葡萄等[2],多以菌核在植株或者病残体上越冬,翌年通过分生孢子传播[3]。灰葡萄孢在葡萄生长过程中可侵染植株嫩茎、叶片、花穗、果实等大部分地上组织,发生严重时,可造成减产60%以上;在葡萄贮藏期是第一大病原菌,一旦发生可造成葡萄果粒腐烂,影响贮藏品质,造成严重损失[4]。灰葡萄孢寄主范围广、变异速度快、抵御不良环境能力强,因此防治极为困难。寻找灰葡萄孢致病基因、探索致病机制,可为灰霉病综合防控奠定基础。
遗传转化是研究病原菌致病基因功能的重要技术基础,农杆菌介导的遗传转化(Agrobacterium tumefaciens-mediated transformation,ATMT)是目前应用较为广泛的转化技术[5]。农杆菌可以侵染真菌细胞,利用所携带的Ti质粒,将T-DNA区随机整合到受体细胞的基因组中,转化过程受到多种小分子多糖及酚类物质等的双重调节,其中乙酰丁香酮(acetosyringone,AS)在该过程中起促进作用[6]。ATMT技术因其转化受体要求低、操作流程简单、转化效率高、转化子稳定性强、转化子单拷贝插入等优势,目前已在水稻稻瘟病菌(Magnaporthe oryzae)、玉米大斑病菌(Setosphaeria turcica)、油菜菌核病菌(Sclerotinia sclerotiorum)、橡胶树炭疽病菌(Colletotrichum musae)等多种病原真菌中得到广泛应用[7-10]。
目前,在灰葡萄孢遗传转化研究中,ATMT技术也得到了较好的应用。陶岚[11]利用ATMT技术构建了草莓灰葡萄孢突变体库,并从中筛选出463个致病力异常的转化子。王璇等[12]通过筛选基于ATMT技术构建的番茄灰葡萄孢突变体库,得到分生孢子产生缺陷转化子BCt78。范雷等[13]通过优化月季灰葡萄孢RoseBc-3的ATMT体系,筛选获得6类不同表型转化子。沈卫锋等[14]利用ATMT技术成功获得了绿色荧光蛋白重组灰葡萄孢。Zhang等[15]通过筛选番茄灰葡萄孢ATMT突变体库,得到分生孢子产生缺陷转化子BCG183,定位确定候选基因BcKMO,进一步证明该基因可参与调控细胞壁降解酶活性、毒素活性和细胞壁完整性等。不同寄主灰葡萄孢具有其自身特异性,目前鲜有关于葡萄灰葡萄孢ATMT的相关研究。本试验以分离自葡萄的灰葡萄孢BcSD3菌株为材料,研究建立并优化其ATMT体系。
1 材料与方法
1.1 试验材料
葡萄灰葡萄孢BcSD3菌株(高毒力菌株),于2020年7月分离自山东烟台‘巨峰’葡萄灰霉病花穗。根癌农杆菌EHA105菌株、质粒pBIG3C(含潮霉素抗性基因)均由本实验室保存。
1.2 试验方法
1.2.1 灰葡萄孢分生孢子制备 将灰葡萄孢BcSD3菌株接种于PDA培养基上,参照李廷刚等[16]报道的方法进行诱导产孢;使用灭菌水洗脱分生孢子,并用三层灭菌滤纸过滤去除菌丝等杂质;离心收集分生孢子,并调节至适宜浓度,保存备用。
1.2.2 根癌农杆菌菌液制备 采用热击法将pBIG3C质粒转入根癌农杆菌EHA105菌株中;筛选阳性菌斑接种于LB液体培养基(含50μg/mL卡那霉素)中,于28℃条件下摇培2 d;离心收集菌体,用诱导培养基将菌液稀释至OD600值等于0.15,继续培养直至OD600值达到0.8。
1.2.3 灰葡萄孢对潮霉素B敏感性测定 制备分别含有5、10、25、50、100μg/mL潮霉素B的PDA平板,以不添加潮霉素B的PDA平板作为对照,用打孔器打取灰葡萄孢菌饼接种在PDA平板中心位置;于23℃光暗交替条件下培养3 d,观察菌落生长情况,每个处理6个平板,设置3次重复。
1.2.4 农杆菌对头孢噻肟钠敏感性测定 制备分别含有50、100、200、300、400μg/mL头孢噻肟钠的PDA平板,以不添加头孢噻肟钠的PDA平板作为对照,取已制备的OD600值为0.15的农杆菌菌液均匀涂布于平板上;于28℃黑暗条件下培养3 d,观察菌落生长情况,每个处理6个平板,设置3次重复。
1.2.5 遗传转化条件优化 在含有不同浓度乙酰丁香酮(AS)的共培养培养基平板上平铺一张玻璃纸,取100μL农杆菌与灰葡萄孢分生孢子混合液均匀涂布于玻璃纸上,在不同温度条件下共培养不同时间,后将玻璃纸转移至新的灭菌培养皿内,覆盖PDA培养基(内含50μg/mL的潮霉素B和300μg/mL的头孢噻肟钠),在适宜温度条件下光暗交替培养5 d,查看转化子生长情况。其中所用灰葡萄孢分生孢子浓度分别为1×102、1×103、1×104、1×105、1×106个/mL;所用AS浓度分别为100、200、300、400μmol/mL,以不添加AS培养基平板作为对照;共培养温度分别为15、20、25、30、35℃;共培养时间分别为24、48、72、96、120 h。
1.2.6 转化子检测与鉴定 随机选取8个转化子接种于不含抗生素的PDA平板上,待菌落生长至平板3/4面积时,打取菌饼转接至新的不含抗生素的PDA平板上,连续转接3代。之后打取菌饼,接种至含有50μg/mL潮霉素B的PDA平板上,观察菌落生长情况,重复3次。使用CTAB法提取野生型灰葡萄孢和8个转化子的基因组DNA,分别扩增潮霉素磷酸转移酶(hph)基因的特异片段。对野生型灰葡萄孢和8个转化子的基因组DNA进行HindⅢ单酶切,酶切完成后进行琼脂糖凝胶电泳分析;以hph基因的特异扩增片段为模板,探针标记与检测方法具体试验步骤参照地高辛标记检测试剂盒(罗氏)说明书进行。
1.3 数据处理与分析
使用Microsoft Excel 2010及SPSS 19.0进行数据统计及分析。
2 结果与分析
2.1 灰葡萄孢对潮霉素B敏感性测定
不同浓度潮霉素B对灰葡萄孢抑制作用测定结果如图1所示,接种灰葡萄孢3 d后,与对照相比,5、10、25μg/mL潮霉素B可对灰葡萄孢菌丝生长产生不同程度的抑制作用,但仍可以生长;当潮霉素B浓度达到50μg/mL时,则可以完全抑制灰葡萄孢菌丝的生长。因此,本试验选择50 μg/mL潮霉素B作为转化子的筛选浓度。

图1 灰霉病菌在含有不同浓度潮霉素B的PDA培养基上生长情况
2.2 根癌农杆菌对头孢噻肟钠敏感性测定
不同浓度头孢噻肟钠对农杆菌抑制作用如图2所示,农杆菌涂布后培养3 d,对照组农杆菌遍布整个平板,随着头胞噻肟钠浓度的不断提高,存活农杆菌菌落数不断减少,抑制效果不断增强;当浓度增至300μg/mL时,可完全抑制其生长。因此,本试验选择300μg/mL头孢噻肟钠作为转化子的筛选浓度。
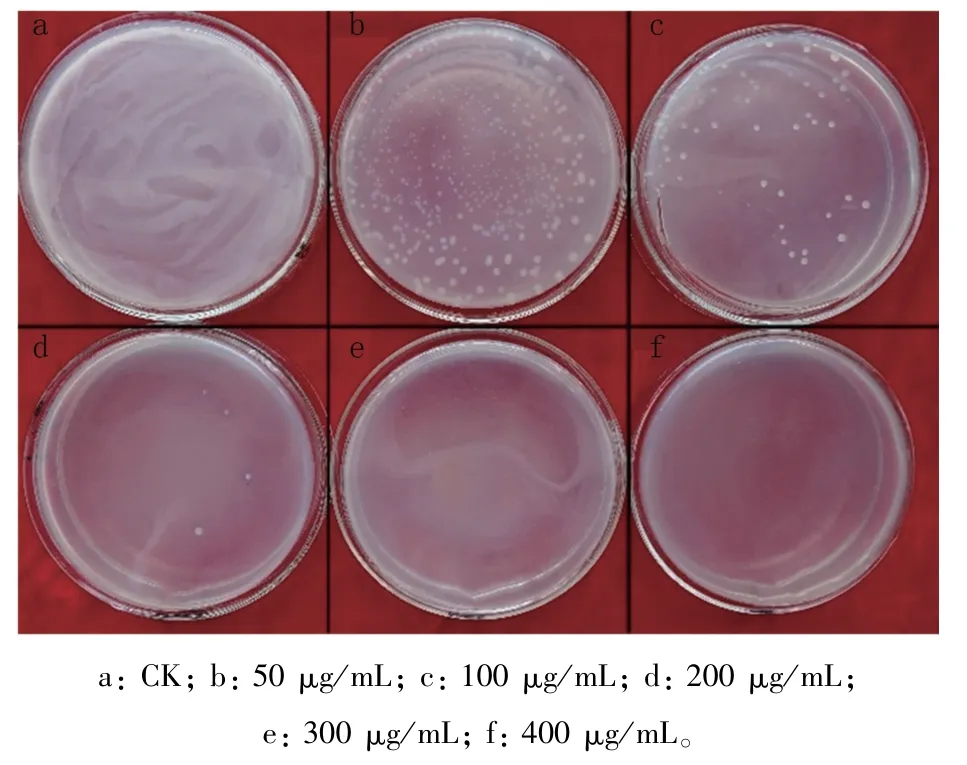
图2 农杆菌在含有不同浓度头孢噻肟钠的PDA平板上生长情况
2.3 分生孢子浓度对转化效率的影响
由图3可知,随分生孢子浓度的增加,每培养皿得到的转化子数量不断增加。分生孢子浓度为1×102、1×103、1×104、1×105、1×106个/mL每培养皿分别平均得到3、9、14、31个和67个转化子。基于试验操作和转化子特异性综合考虑,分生孢子浓度1×105个/mL为最适转化浓度。

图3 不同分生孢子浓度对转化效率的影响
2.4 乙酰丁香酮浓度对转化效率的影响
当不添加AS时,每个培养皿平均仅得到2个转化子;随着AS浓度不断提高,转化子数量不断增加,浓度为200μmol/mL时每个培养皿平均可得到33个转化子;之后,随着AS浓度不断增加转化子数量不断减少(图4)。因此,AS浓度200μmol/mL为最佳转化浓度。
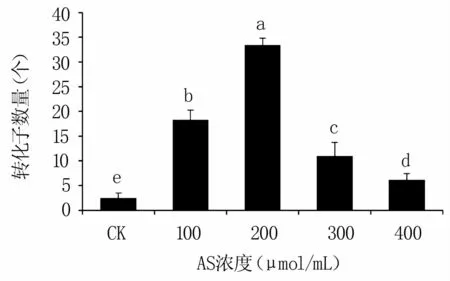
图4 不同乙酰丁香酮浓度对农杆菌转化效率的影响
2.5 共培养温度对转化效率的影响
当共培养温度为15℃时,每培养皿平均可得到7个转化子;随着共培养温度不断升高转化子数量呈先增加后减少的趋势,25℃时转化效率最高,每培养皿平均可得到32个转化子,当共培养温度达到35℃时,每培养皿平均转化子数量下降到11个(图5)。因此,25℃为最佳共培养温度。
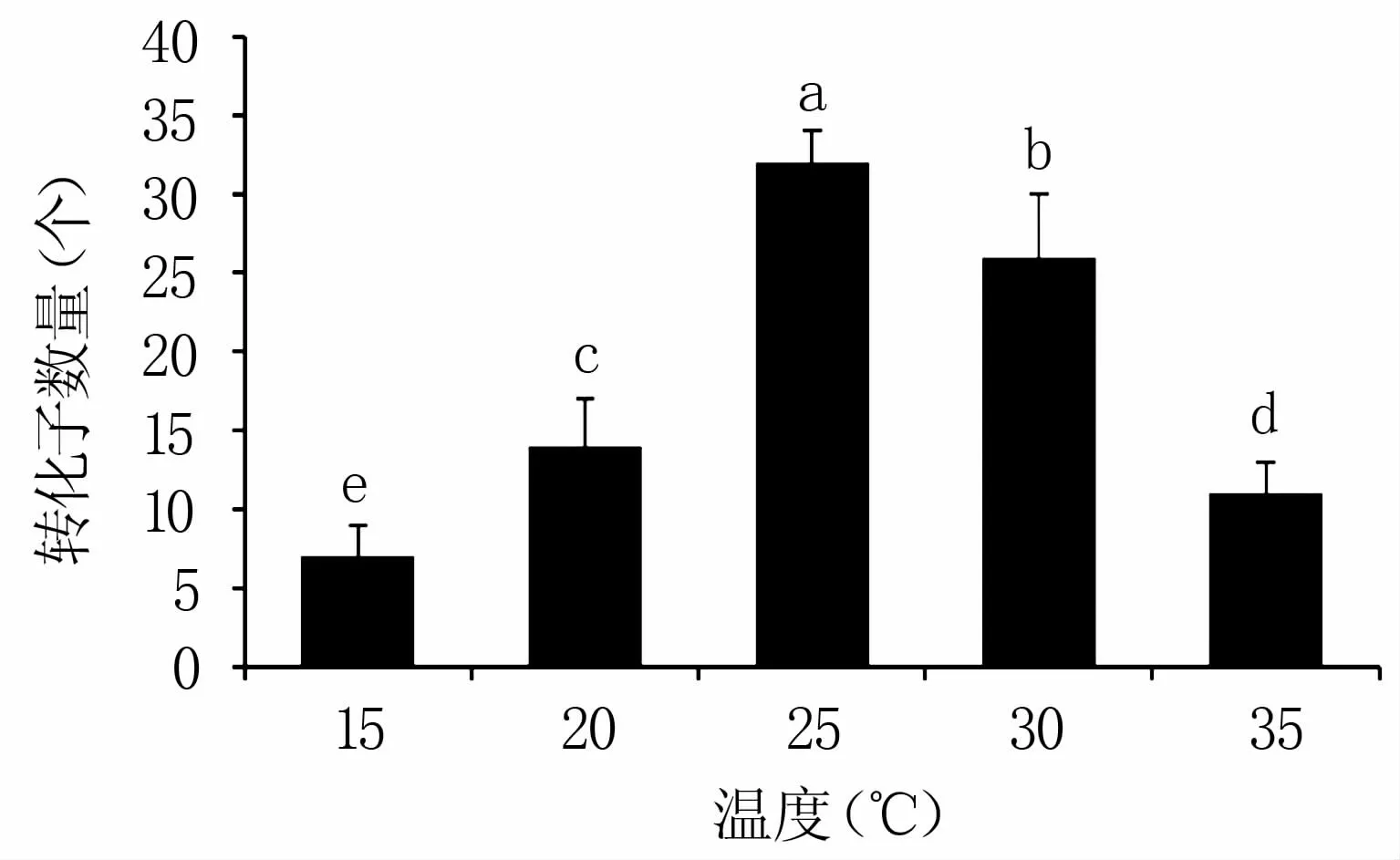
图5 共培养温度对转化效率的影响
2.6 共培养时间对转化效率的影响
当共培养时间为24、48、72、96、120 h时,每皿分别平均可得到18、33、34、26个和22个转化子;其中,共培养时间为48 h和72 h时转化效率相当,且无显著差异(图6)。共培养时间越长转化子有多拷贝插入的比例越高,因此,48 h为最适共培养时间。
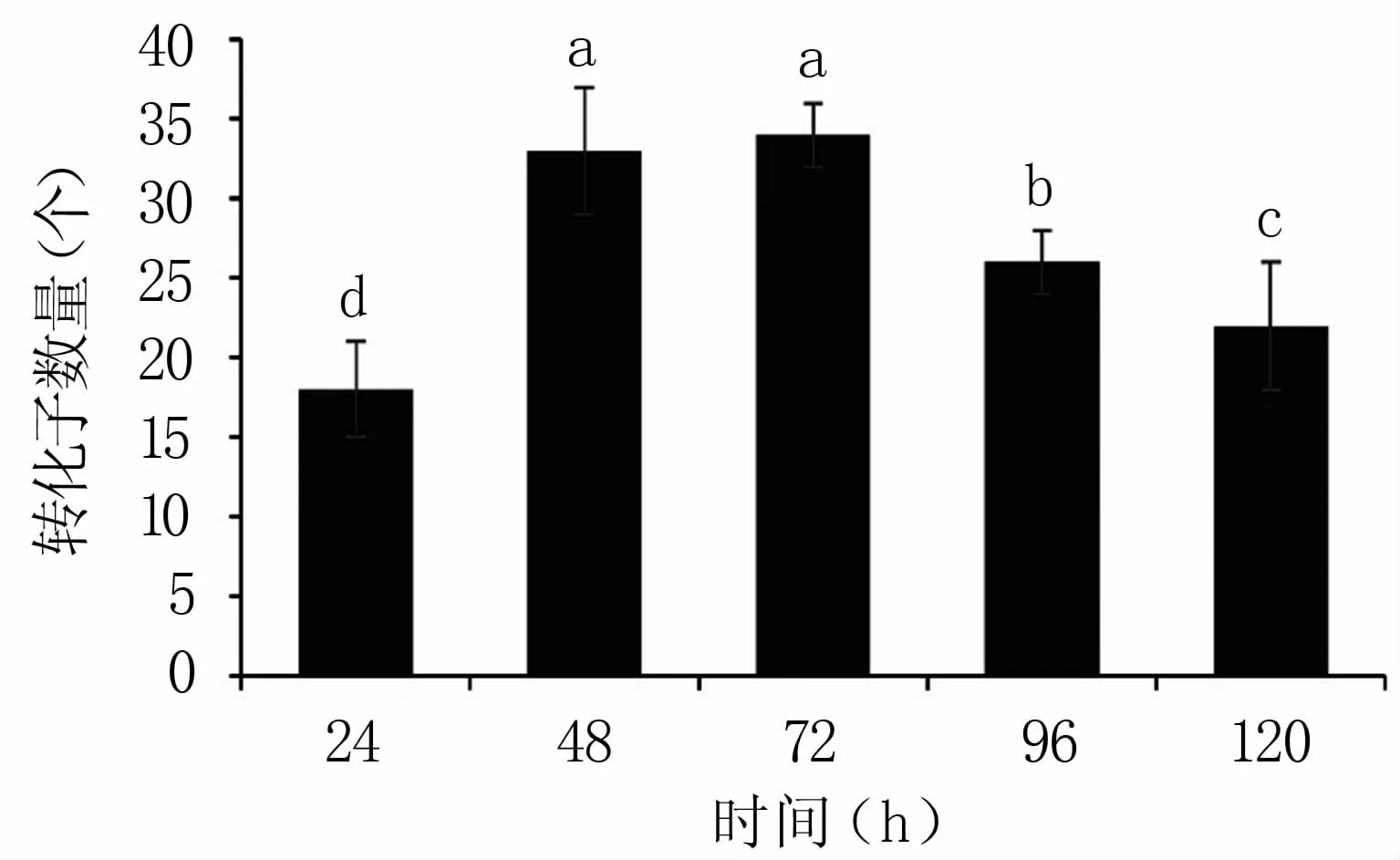
图6 共培养时间对转化效率的影响
2.7 转化子稳定性检测及分子鉴定
随机选取8个转化子进行遗传稳定性检测,结果显示,在含有50μg/mL潮霉素B的PDA培养基平板上所有转化子均可正常生长。潮霉素磷酸转移酶基因特异片段扩增结果如图7a所示,灰葡萄孢野生型中无条带,8个转化子中均可扩增到特异性条带,且大小与对照相同。表明,TDNA片段已经整合到灰葡萄孢基因组中,并且可以稳定遗传。
转化子Southern blot检测结果如图7b所示,灰葡萄孢野生型中无任何条带,8个转化子均可得到特异性条带,其中6个转化子为单拷贝插入,2个转化子为双拷贝插入,单拷贝插入比例可达到75%。表明hph基因已经整合到灰葡萄孢基因组中,且多以单拷贝形式插入。

图7 转化子PCR检测及Southern blot分析
3 讨论与结论
遗传转化是研究真菌基因功能的重要技术手段,常用的遗传转化技术包括PEG介导的原生质体遗传转化、限制酶介导的原生质体遗传转化等[17-19]。ATMT技术因其无需制备原生质体、单拷贝插入率高、操作流程简单、转化效率高等优点,在多种真菌遗传转化研究中得到了较好的应用[20,21]。但不同真菌间、甚至同一真菌不同种间的遗传转化条件存在较大差异,主要受共培养培养基中AS浓度、共培养液中分生孢子浓度、共培养温度以及共培养时间等因素影响。本研究建立了葡萄灰葡萄孢ATMT体系,为开展其基因功能研究奠定了技术基础。
分生孢子浓度与转化效率大致呈正相关趋势,这主要是因为分生孢子浓度的提高增加了农杆菌侵染的概率,从而提高了转化效率。由于一个培养皿中转化子过多会造成菌落相互覆盖,不利于后期转化子的分离纯化,因此分生孢子应选择适宜浓度。AS对Ti质粒上vir基因的活化起重要作用,因此在共培养培养基中需加入适当浓度的AS以提高转化效率。本研究中AS最佳浓度为200μmol/mL,之后随着浓度继续提高,转化效率逐渐下降。推测这可能是因为过高浓度的AS对转化子产生了毒害作用,抑或是抑制了Ti质粒上的vir基因的表达,从而导致转化效率下降。
共培养温度对转化效率的影响呈正态分布趋势,最佳共培养温度为25℃,过低或者过高均会导致转化效率下降。推测这可能是因为灰葡萄孢分生孢子具有自己最适的生长温度;同时,Ti质粒上vir基因的表达也较易受到温度的影响。本研究中最适共培养时间为48 h,共培养时间过短会导致农杆菌未能完成侵染,从而造成转化效率不高;共培养时间过长,也会导致转化效率下降。这或许是因为共培养时间过长导致转化子生活力衰弱,从而影响转化效率。此外,共培养时间过长还易导致转化子中多拷贝插入的现象,为后续开展基因功能研究带来不便[22]。
