黑点根腐病菌和镰孢菌复合侵染引起的甜瓜根腐病的鉴定
2021-11-14吴会杰严蕾艳郭珍彭斌康保珊刘莉铭古勤生
吴会杰 严蕾艳 郭珍 彭斌 康保珊 刘莉铭 古勤生


摘 要:为明确甘肃皋兰地区甜瓜根腐病的病菌,通过病菌分离、致病性测定,采用真菌形态学结合基因序列分析对该病菌进行了鉴定。结果表明,引起甜瓜根腐病的主要病原菌为尖孢镰孢菌甜瓜专化型(Fusarium oxysporum f. sp. melonis,FOM)及引起黑点根腐病的子囊真菌(Monosporascus cannonballus)。致病性分析表明,尖孢镰孢菌甜瓜专化型及M. cannonballus均可引起甜瓜胚根的坏死、腐烂,侧根不能生长;其中M. cannonballus使瓜类砧木-南瓜品种思壮12的胚根变褐,但不影响主根和侧根的生长。明确了甘肃皋兰地区甜瓜根腐病的主要致病菌,为防控该病害提供了理论依据。
关键词:甜瓜;根腐病;病原鉴定;致病性分析
中图分类号:S652 文献标志码:A 文章编号:1673-2871(2021)10-015-05
Identification of melon root rot pathogen of Monosporascus cannonballus and Fusarium oxysporum f. sp. melonis
WU Huijie1, YAN Leiyan2, GUO Zhen1, PENG Bin1, KANG Baoshan1, LIU Liming1, GU Qinsheng1
(1. Zhengzhou Fruit Research Institute, Chinese Academy of Agricultural Sciences, Zhengzhou, 450009, Henan, China; 2. Institute of Vegetables, Ningbo Academy of Agricultural Sciences, Ningbo 315040, Zhejiang, China)
Abstract: In order to clarify the pathogens of melon root rot in Gansu province of Chian, the isolation, identification and pathogenicity of the pathogens were conducted. The results showed that the main pathogens causing melon root rot were Fusarium oxysporum f.sp. melonis (FOM) and Monosporascus cannonballus. The pathogenicity test showed that the two pathogens cause necrosis and rot of melon radicle. The lateral roots could not grow in infected plant, and the main roots were damaged. Moreover, M. cannonballus can also cause the radicle of the pumpkin variety Sizhuang 12 to appear brown, but the growth of the main root and lateral roots were not affected. This result laid the foundation for the prevention and control of melon root rot.
Key words: Melon;Root rot;Pathogen identification;Pathogenicity test
甜瓜是非常典型的連作障碍极为严重的作物,甜瓜连作会导致植株生长发育缓慢,病虫害发生加重,产量及品质下降,严重时甚至导致作物绝产[1],甜瓜根腐病是甜瓜连作时发生严重且较为普遍的病害。甜瓜根腐病大多是多种病原菌复合侵染的病害,在我国常见的病原菌为尖孢镰孢菌甜瓜专化型( Fusarium oxysporum f. sp. melonis,FOM)、立枯丝核菌(Rhizoctonia solani Kuhn)[2]、瓜类腐皮镰孢菌(Fusarium solani (Mart.) App. et Wollenw)[3]及引起甜瓜黑点根腐病的子囊真菌(Monosporascus cannonballus)[4]等。其中甜瓜枯萎病是由尖孢镰孢菌甜瓜专化型引起的真菌病害,是世界类土传维管束病害[5]。M. cannonballus是Pollack 和 Uecker在1974年将从洋香瓜的病株根部分离的病原菌定名为子囊菌属的新种,命名为 M. cannonballus[6]。M. cannonballus是土传真菌,引起甜瓜根部腐烂,主要危害瓜类根系和茎基部。植株发病初期病部呈水渍状,随后至深褐色腐烂,病部不缢缩,维管束变褐色,侵染后期根部变糟,表皮脱落,仅有丝状维管,果实成熟过程中,藤蔓逐渐萎蔫直至萎凋死亡[7]。该病菌在我国甘肃首次发现(2005年)[4],随后在甘肃武威(2009年)及酒泉市金塔县(2018年)发现该病菌侵染甜瓜[8],2020年7月在甘肃皋兰发现甜瓜受害严重,病程发展非常迅速,从最初的冠顶叶子出现症状到最后植株死亡的历程为5~10 d。该病害可造成30%~50%的经济损失[4,9],严重时甚至达100%[7]。
甜瓜根腐病害是设施甜瓜栽培发生普遍且难以防治的病害,鉴别病菌是防控该病的前提条件,笔者旨在明确甘肃省皋兰县甜瓜大面积萎蔫、死亡的主要病因,为防控该病提供理论依据。
1 材料与方法
1.1 病害调查及样本采集
2020年6月份调查甘肃省皋兰县大棚种植的甜瓜品种甘甜3号表现根腐症状的甜瓜,随机采集10株。甘甜3号是薄皮甜瓜,瓜阔梨形,果皮绿色,果肉翠绿,是甘肃农业科学院选育的品种。
1.2 培养基制备
称取洗净去皮的马铃薯200 g,切成小块,加水1000 mL煮沸0.5 h,纱布过滤,加入琼脂粉15 g,加热彻底溶化后,再加入葡萄糖20 g,搅拌均匀并溶解后,加自来水至总体积为1000 mL,分装于250 mL三角瓶,121 ℃ 0.1 MPa灭菌20 min,随后倒入直径90 mm的培养皿备用。
1.3 病原菌的分离与鉴定
1.3.1 病原菌的分离 取根和茎部发生病变的组织,采用常规组织分离法,切取甜瓜根和茎基部病健交界处5 mm×5 mm的样本,先用75%酒精消毒15 s,无菌水冲洗3遍,随后再用2%次氯酸钠消毒2 min,无菌水冲洗3遍,放置于灭过菌的滤纸上,干燥,最后把组织放置于PDA培养基上,培养,3 d后挑取菌丝,纯化、培养。2020年8月将分离、纯化的菌株保存于中国农业科学院郑州果树研究所瓜类病害课题组的-80 ℃冰箱。
1.3.2 形态学鉴定 将分离的菌株接种于PDA平板上,27 ℃恒温黑暗培养6 d后,观察记录菌落特征、产孢结构及孢子形态。
1.3.3 分子鉴定 采用CTAB方法提取真菌DNA,用ITS1(5'-TCC GTA GGT GAA CCT GCG G-3')和ITS4(5'-TCC TCC GCT TAT TGA TAT GC-3')[10]为引物进行PCR扩增。扩增产物用1.0%的琼脂糖凝胶电泳检测,发现有目的片段后,送生工生物工程(上海)股份有限公司进行测序。采用ClustalX进行序列比对,采用MEGA X最大相似自然法(maximum likelihood method)进化树分析 [11]。
1.4 致病性鉴定
致病性鉴定采用胚根接种法[3]进行。接种厚皮甜瓜品种金香玉(农友种苗(中国)有限公司提供)和南瓜品种思壮12(市售)。挑选胚根长约5 mm的发芽种子移入直径90 mm的含潮湿滤纸的培养皿内,用5 mm打孔器打取新鲜培养的菌落周围,取菌饼接种到胚根位置,接种后27 ℃黑暗保湿培养,接种24 h后开始观察4 d。每个菌株接种10粒发芽种子,3次重复。
2 结果与分析
2.1 病害症状
甜瓜根腐病早期主要表现为植株萎蔫,形成发病中心,随着病害的发展,根部出现大量的褐色水渍,后水渍变褐腐烂、须根大量减少,主根腐烂,发病严重的地块植株枯萎死亡(图1)。
2.2 病原菌的分离
在PDA培养基上共获得可分离的29个纯化株系,依据形态学观察分为4种类型,其中尖孢镰孢菌甜瓜专化型有14个,检出频率为48.28%(14/29);M. cannonballus有9个,检出频率为31.03%(9/29),其他的病原菌占据20.69%(6/29)。
2.3 形态学及分子生物学鉴定
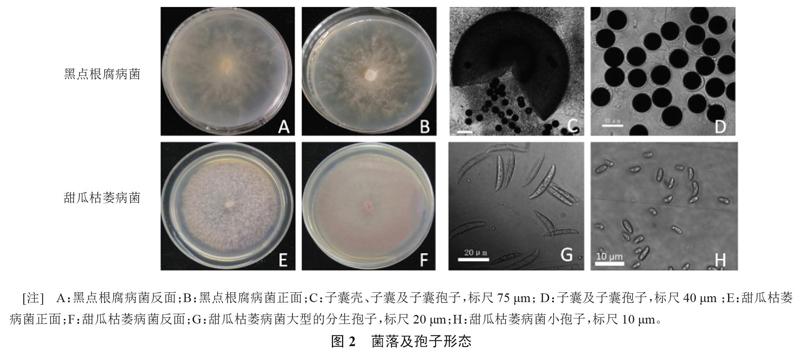
2.3.1 形态学鉴定 M. cannonballus在PDA培养基上菌丝生长速度快,27 ℃恒温黑暗培养5 d后菌落直径可达8 cm,气生菌丝白色薄绒状,不产生分生孢子,培养35 d以后才有零星的子囊壳及子囊孢子出现,每个子囊只含1个子囊孢子。尖孢镰孢菌甜瓜专化型呈浅紫色,培养7 d后在显微镜下可观察到大型的分生孢子和小孢子(图2)。
2.3.2 分子生物学鉴定 取真菌的DNA,用ITS1/ITS4扩增获得大约600 bp的条帶,将PCR产物送样测序。其中一种是尖孢镰孢菌甜瓜专化型,BLAST分析发现与Gen Bank中Fusarium oxysporum的序列一致性为99%(HE974453.1)。另外一种基因序列为608 bp,与Gen Bank中的M. cannonballus的序列一致性达99%(AM167937.1)。进化树分析表明,甘肃分离物与黑点根腐病菌为一个分支,认定为黑点根腐病菌造成甘肃甜瓜根部腐烂,植株萎蔫死亡(图3)。
2.4 致病性鉴定
将M. cannonballus和尖孢镰孢菌甜瓜专化型接种厚皮甜瓜品种金香玉的胚芽,接种72 h后,M. cannonballus接种甜瓜胚芽后接种部位表现为褐色坏死,须根减少,主根正常生长,接种5 d后根部腐烂。尖孢镰孢菌甜瓜专化型接种甜瓜后根部表现褐色,主根和须根均不能正常生长,表现出比M. cannonballus更强的致病力(图4第1行)。从2种病菌接种发病后的组织中均能再次分离到与原接种菌株一致的病原菌,空白PDA接种对照表现为正常,主根和须根均正常生长。该结果表明,2种菌株均可侵染甜瓜根部,是造成甜瓜根腐的致病菌。
将2种病原菌接种生产上常用的嫁接砧木南瓜上品种思壮12,结果表明M. cannonballus接种南瓜后,接种部位表现褐色状坏死,主根和须根生长正常,从接种发病的根部组织中可分离到该病原菌;而尖孢镰孢菌甜瓜专化型接种南瓜后,在接种部位没有观察到根部组织病变。空白PDA接种南瓜后主根和须根均正常生长。该结果说明M. cannonballus可在南瓜品种思壮12的根部定植,但南瓜主根及侧根生长依旧发达;而尖孢镰孢菌甜瓜专化型不能引起南瓜品种思壮12发病(图4第2行)。
3 讨论与结论
甜瓜根腐病是甜瓜重要的土传病害,笔者分析了造成甘肃皋兰甜瓜根部腐烂的主要病原菌并进行了致病性鉴定,结果表明,尖孢镰孢菌甜瓜专化型和黑点根腐病菌是主要致病菌。尖孢镰孢菌甜瓜专化型在甜瓜的主栽区均有发生,而M. cannonballus主要在甘肃省发生[4,8]。M. cannonballus主要适生于干旱及半干旱的环境[12],甘肃大部分地区气候干燥,全年降水少,蒸发量大,有利于黑点根腐病菌的发生,因此M. cannonballus在甘肃的发生和发展较快。此外,2016年宁波农业科学院从宁波种植的甜瓜上分离到该病菌;2020年笔者在郑州也鉴定到该病菌侵染甜瓜根部。这些结果表明,该病菌的适生范围在扩大,对我国的中部及东部沿海地区的甜瓜均有可能造成大的危害,威胁着我国中部及东部沿海地区的甜瓜生产。因此,应加强对该病害发生情况的调查,针对发生区的自然条件进行合理的水肥管理,开展该病害的综合防控,保障甜瓜产业的健康发展。
近年来,设施甜瓜高效栽培模式的推广及全年连续种植的土壤环境有利于土传病害的繁殖、传播。嫁接是最经济、高效的防控根部土传病害的有效措施之一[13],把感病香瓜和西瓜嫁接到南瓜属或葫芦属砧木上,可降低黑点根腐病的发生[14],嫁接南瓜能降低黑点根腐病在西瓜和甜瓜上的发病率,而土壤中黑点根腐病菌的孢子数量并没有下降,但南瓜根部分离出黑点根腐病菌的分离频率大大降低[15]。因而,笔者检测了该病菌对南瓜思壮12的致病性,结果表明,M. cannonballus可在南瓜根部定殖,使南瓜根部变褐,与之前发现南瓜嫁接可降低黑点根腐病发生[14]的结果不一致,分析可能是不同的南瓜砧木对病菌的抗性不同导致的差异。此外,从接种南瓜和甜瓜后的症状比较可以看出,该病菌对南瓜的致病力弱,而对甜瓜的致病力强,嫁接仍是防控该病菌的一个重要手段,需要进一步加大砧木的筛选范围,为该病害的防控奠定基础。
本试验结果明确了造成甘肃皋兰甜瓜根部腐烂的主要病原菌是尖孢镰孢菌甜瓜专化型和黑点根腐病菌;发现了M. cannonballus可使南瓜思壮12根部变褐。
致谢:感谢甘肃省农业科学蔬菜研究所程鸿研究员和杨永刚研究员协助实地调研和取样!
参考文献
[1] 阿衣加玛丽·库都热提,张以和.甜瓜连作障碍及其消减技术研究进展[J].中国瓜菜,2020,33(5):1-5.
[2] 周翠菊,侯保荣.新疆瓜类根腐病初报[J].农业科技通讯,1987(4):33.
[3] 董勤成,闵召成,孙自喜,等.瓜类根腐病的发生及防治[J].长江蔬菜,2007(11):29-30.
[4] 何苏琴,白滨.甜瓜黑点根腐病菌Monosporascus cannonballus在中国大陆的首次报道[J].植物保护,2010,36(4):116-119.
[5] 郝芳敏,严蕾艳,臧全宇,等.浙江省甜瓜根、叶部镰孢菌种类的分离与鉴定[J].中国瓜菜,2020,33(11):13-17.
[6] POLLACK F,UECKER F A.Monosporascus cannonballus an unusual ascomycete in cantaloupe roots[J].Mycologia,1974,66(2):346-349.
[7] MARTYN R D, MILLER M E.Monosporascus root rot and vine decline:an emerging disease of melons worldwide[J].Plant Disease,1996,80(7):716.
[8] 何苏琴,白滨,文朝慧,等.甘肃酒泉发现坎诺单孢菌引起的甜瓜倒秧[J].植物保护,2019,45(6):303-306.
[9] CHEW-MADINAVEITIA Y I,GAYT?N-MASCORRO A,P?REZ-HERRERA T,et al.First report of Monosporascus cannonballus on melon in Mexico[J].Plant Disease,2012,96(7):1068-1068.
[10] WHITE T,BRUNS T,LEE S,et al.Amplification and direct sequencing of fungal ribosomal RNA genes for phylogenetics[M]//INNIS M A ,GELFAND D H,SNINSKY J J.PCR protocols:a guide to methods and applications.California,San Diego:Academic Press,Inc.,1990:315-322.
[11] SUDHIR K,GLEN S,MICHAEL L,et al.MEGA X:molecular evolutionary genetics analysis across computing platforms[J].Molecular Biology & Evolution,2018,35(6):1547-1549.
[12] COHEN R,PIVONIA S,SHTIENBERG D,et al.Efficacy of fluazinam in suppression of Monosporascus cannonballus,the causal agent of sudden wilt of melons[J].Plant Disease,1999,83(12):1137-1141.
[13] 戶金鸽,孙玉萍,杨英,等.砧木对嫁接甜瓜生长及品质的影响[J].新疆农业科学,2017,54(6):1029-1035.
[14] COHEN R,BURGER Y,HOREV C,et al.Performance of Galia-type melons grafted on to Cucurbita rootstock in Monosporascus cannonballus-infested and non-infested soils[J].Annals of Applied Biology,2005,146:381-387.
[15] BELTR?N R,VICENT A,GARC?A-JIM?NEZ J,et al.Comparative epidemiology of monosporascus root rot and vine decline in muskmelon,watermelon,and grafted watermelon crops[J].Plant Disease,2008,92(1):158-163.
