近红外光响应香豆素基复合载体的构建及性能
2021-11-13信富华田梦媛
信富华 田梦媛 孙 芳,2*
(北京化工大学 1.化学学院, 北京 100029; 2.安庆研究院, 安庆 246000)
引 言
近年来,用于药物输送的光响应复合载体被广泛研究和开发,所报道的光响应复合载体包括附着有光响应邻硝基苯基团的金纳米粒子[1]、接枝双光子香豆素基的介孔二氧化硅[2]和基于苝-3-基甲醇发色团的荧光有机颗粒[3]等。在上述光响应基团中,香豆素类光扳机分子具有良好的光学活性、较高的光解量子产率以及增强免疫的生理活性,因此广泛应用于药物输送体系的构建。光扳机分子不仅可以直接与药物分子连接,而且还可以与包裹药物的高分子链连接,通过光诱导反应破坏高分子链,使被包裹的药物释放出来。Karthik等[4]利用香豆素基光扳机和Fe/Si磁性纳米粒子制备了一种用于抗癌药可控释放的光响应磁性纳米粒子(MNPs),当紫外光(UV)照射时香豆素4号位连接的亚甲基处的C—O键断裂,可实现药物的释放。Babin等[5]利用聚(环氧乙烷)亲水链段和聚([7-(二乙基胺)香豆素-4-基]甲基丙烯酸甲酯)(PDEACMM)疏水链段制备了一种装载尼罗红的光响应共嵌段胶束,在紫外光或近红外光(NIR)照射下,PDEACMM的光解导致胶束被破坏,从而释放出尼罗红。
目前报道较多的是香豆素基紫外光响应体系,但紫外光存在穿透能力弱以及长时间辐照有可能对生物体造成伤害等缺点,从而限制了香豆素基紫外光响应体系的实际应用。近红外光具有波长长、生物组织穿透能力强以及对细胞组织无毒无损伤等优势[6],因此近红外光响应体系成为目前研究的热点。上转换纳米粒子是一种特殊的发光材料,其特性是可以将近红外光转化为紫外光或可见光[7],如果在体系内部为紫外光响应凝胶加入一种能将近红外光转换为紫外光的光转换剂,就可以获得一个近红外光响应体系。
基于上述背景,本文设计并合成了粒径分布均匀的香豆素基紫外光响应凝胶,然后将上转换纳米粒子与香豆素基凝胶相结合,制备了可用于药物释放的近红外光响应复合载体,测试了其紫外吸收及荧光发射性能。将香豆素102作为模拟药物装载于光响应复合载体中,探究了复合载体在近红外光照射下的光响应释放行为,并考察了其细胞毒性。
1 实验部分
1.1 实验原料和仪器
1.1.1实验原料
氧化钇(Y2O3)、氧化镱(Yb2O3)、氧化铥(Tm2O3)、4-氯乙酰乙酸乙酯、聚乙二醇甲基丙烯酸酯(MPEGMA)(相对分子质量为500)和二甲基亚砜(DMSO),萨恩化学技术有限公司;间苯二酚、硬脂酸和氟化氢铵(NH4HF2),北京伊诺凯科技有限公司;丙烯酸,天津市福晨化学试剂厂;1,8-二氮杂二环十一碳-7-烯(DBU),北京迈瑞达科技有限公司;2-氰基-2-丙基苯并二硫(CPBD)、无水N,N-二甲基甲酰胺(DMF)和香豆素102,百灵威科技有限公司;偶氮二异丁腈(AIBN),西陇化工股份有限公司;1,4-二氧六环和二氯甲烷(DCM),天津希恩思奥普德科技有限公司;氢氧化钠(NaOH)、四氢呋喃(THF)、乙酸乙酯、甲醇、无水乙醇、浓硫酸(H2SO4)和浓硝酸(HNO3),北京化工厂;磷酸盐缓冲液(PBS,pH=7.4)、DMEM培养基、胎牛血清、双抗(青霉素+链霉素)和四甲基偶氮唑盐(MTT),Sigma公司;HeLa细胞,美国菌种保藏中心(ATCC)。以上所用的试剂均为分析纯。
1.1.2实验仪器
Avance 400M型核磁共振波谱仪(NMR), 德国布鲁克公司;Nicolet 50XC型傅里叶变换红外光谱仪(FT-IR),美国尼高力公司;1515/515型凝胶色谱仪(GPC),美国沃特世公司,实验条件:标样为聚苯乙烯,流动相为四氢呋喃,流速1 mL/min,柱温35 ℃;JEM-Z200FSC型高倍透射电子显微镜(TEM),日本JEOL公司;Nano ZS ZEN 3600型动态光散射仪(DLS),德国Malvern公司;Hitachi U-3010型紫外可见分光光度计、F-7000型荧光光谱仪,日本日立公司; FC-W-980A型980 nm近红外激光器, 长春新产业光电技术有限公司;BPN 500H型细胞培养箱,上海蓝豹实验仪器有限公司;Enspire型多功能酶标仪,珀金埃尔默医学诊断产品(上海)有限公司。
1.2 实验方法
1.2.1香豆素基光响应凝胶的合成
采用可逆加成-断裂链转移自由基(RAFT)聚合法制备香豆素基紫外光响应凝胶,其合成路线如图1所示。
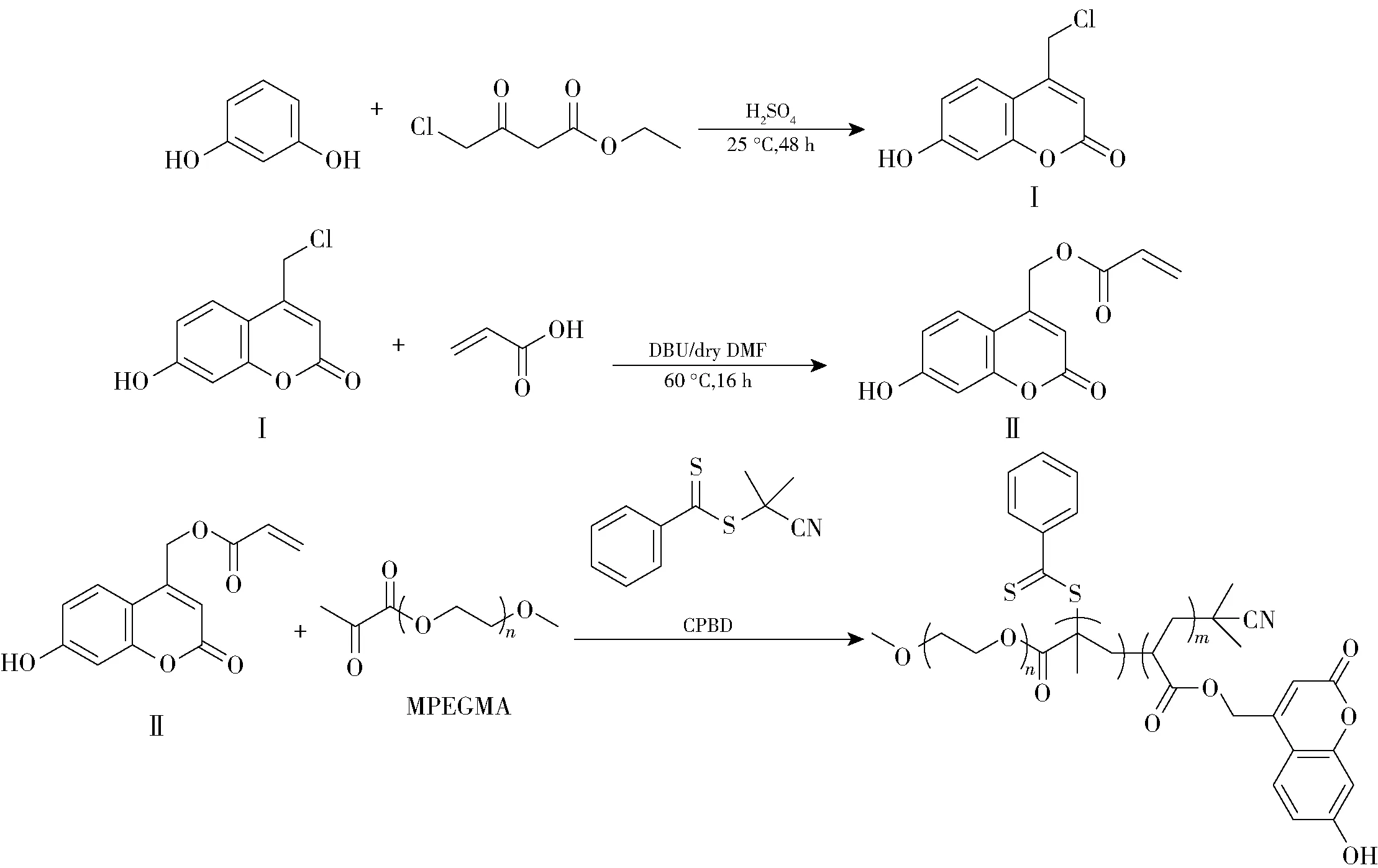
图1 香豆素基光响应凝胶的合成路线Fig.1 Synthesis of the coumarin-based photo-responsive gel
将间苯二酚(1.1 g)与4-氯乙酰乙酸乙酯(1.65 g)加入到单口瓶中,于25 ℃下搅拌40 min溶解,将10 mL浓H2SO4逐滴加入到单口瓶中。滴加结束后,常温下反应48 h。反应完毕,向单口瓶倒入20 mL乙酸乙酯,然后用水和饱和NaCl溶液洗涤,干燥后通过柱层析提纯,获得白色固体产物,于30 ℃下干燥24 h,最后得到纯净的光响应香豆素衍生物中间体I(1.89 g,产率:91%)。

将光响应香豆素衍生物中间体I(1.23 g)溶于10 mL无水DMF中,加入丙烯酸(0.36 g),然后在搅拌下加入1 mL DBU,于60 ℃下反应16 h。反应结束后,向反应瓶中加入20 mL乙酸乙酯溶解反应液,加入25 mL 1 mol/L HCl中和DBU,用水和饱和NaCl溶液洗涤,干燥后通过柱层析提纯,得到纯净的光响应香豆素衍生物II(0.73 g,产率:59.4%)。

将MPEGMA(4.38 g,8.75 mmol)、偶氮二异丁腈(0.014 g,0.09 mmol)和香豆素衍生物II(0.61 g,2.19 mmol)加入到1,4-二氧六环中,充分混合,通入氮气除去其中的氧气。向混合溶液加入CPBD(0.10 g,0.44 mmol),在氮气保护下于80 ℃反应20 h,将反应瓶放入液氮中结束反应,用乙醚沉降反应液3次,于25 ℃真空干燥24 h,得到香豆素基光响应凝胶,标记为PG。通过GPC测得光响应凝胶的相对分子质量为19 186,分散指数(PDI)为1.12。

1.2.2近红外光响应复合载体的合成
根据水热法[8]制得上转换纳米粒子(NaYF4:Yb3+/Tm3+),标记为UC。称取50 mg上转换纳米粒子和50 mg光响应凝胶,分别超声、搅拌溶解在15 mL DCM中,将光响应凝胶的DCM溶液逐滴加入到搅拌的上转换纳米粒子的DCM溶液中。滴加结束后,继续搅拌溶液使其充分混合,然后升温到50 ℃,继续搅拌直至溶剂挥发完毕,形成一层薄膜。然后加水水化,超声溶解,离心干燥后可得白色固体,即为近红外光响应复合载体,标记为UC-PG。
1.2.3装载香豆素102的光响应凝胶及光响应复合载体的制备
本文使用香豆素102作为模拟药物进行复合载体的光热响应释放性能研究[9]。用5 mL无水THF超声溶解50 mg光响应凝胶,用2 mL无水THF超声溶解20 mg香豆素102。在搅拌下向光响应凝胶的THF溶液中滴加香豆素102的THF溶液,使其混合均匀,用去离子水将混合溶液透析两天以除去THF,将没有溶解的香豆素102过滤,冷冻后冻干,得到装载香豆素102的光响应凝胶,标记为PG@C102。将上述光响应凝胶替换为光响应复合载体,重复以上操作,制得装载香豆素102的光响应复合载体,标记为UC-PG@C102。
1.2.4包封率和装载率的测定
将香豆素102配制成不同浓度的甲醇溶液,使用紫外可见分光光度计于391 nm(香豆素102的最大吸收波长)处测定其吸光度,拟合得到香豆素102溶液的标准曲线为:Y=72.069 17X+0.124 34,R2=0.999 87,其中,X为香豆素102溶液的浓度,Y为吸光度,R2为决定系数。根据文献[10]的方法,按照式(1)和(2)计算装载香豆素102的光响应凝胶和复合载体的包封率(ER)和装载率(DL)。
(1)
(2)
式中,m1为加入的香豆素102的质量,m2为光响应凝胶或复合载体所装载的香豆素102的质量,m0为光响应凝胶或复合载体的质量。
1.2.5刺激响应释放性能测试
分别取5 mL装载香豆素102 的光响应凝胶的甲醇溶液(0.02 mg/mL),在365 nm的紫外光或980 nm的近红外光下照射不同时间,然后利用荧光光谱仪测试这一系列溶液的荧光光谱,探究光响应凝胶的释放性能。同样地,分别取5 mL装载(或未装载)香豆素102 的光响应复合载体的甲醇溶液(0.02 mg/mL),于980 nm的近红外光下照射不同时间,然后测试这一系列溶液的荧光光谱,探究光响应复合载体的释放性能。
分别取5 mL装载香豆素102的光响应凝胶的甲醇溶液,在365 nm的紫外光或980 nm的近红外光下照射不同时间(0、2、5、8、10、12、15、18、20 min)。同样地,分别取5 mL装载香豆素102的光响应复合载体的甲醇溶液,在980 nm的近红外光下照射不同时间。然后利用紫外可见分光光度计测定391 nm处的吸光度,利用累加法计算香豆素102的累积释放率。
1.2.6光响应复合载体的细胞毒性测试
为了评估光响应复合载体的细胞毒性,通过MTT比色法测试其对HeLa细胞活力的影响。使用含1%双抗和10%胎牛血清的DMEM高糖培养基,将HeLa细胞置于37 ℃、含5% CO2的细胞培养箱中培养,传代至对数生长期。将HeLa细胞以每孔100 μL、105个/mL接种于96孔板,置于细胞培养箱中培养24 h,使细胞完全贴壁。吸去培养基,用PBS洗涤2次。然后将100 μL检测物(质量浓度梯度为1、5、10、15、20 μg/mL的复合载体或近红外光照射20 min后装载香豆素102的复合载体培养基)加入上述孔板中作为试验组,培养24 h,加入MTT再培养4 h。弃培养基并用PBS小心洗涤,然后每孔加入100 μL DMSO,摇床15 min。同时,设置不加检测物的孔板作为对照组,只加培养基、MTT和DMSO的孔板作为空白背景组。使用酶标仪于490 nm处测定吸光度,按照式(3)计算细胞活力R。
(3)
式中,AE为试验组的吸光度,AC为对照组的吸光度,A0为空白背景组的吸光度。细胞活力测试重复5次,结果以平均值±标准差表示。
2 结果与讨论
2.1 光响应凝胶的微观形貌及粒径
利用TEM和DLS分别测试了光响应凝胶的微观形貌及粒径,结果如图2所示。可以看到,光响应凝胶呈均匀的球状,平均水合粒径为1 328 nm,分散指数为0.172。
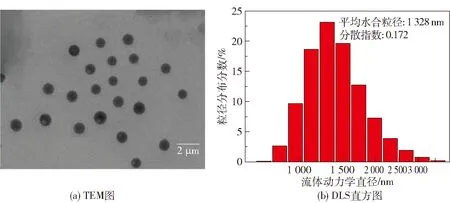
图2 光响应凝胶的TEM图和DLS直方图Fig.2 TEM image and DLS histogram of the photo-responsive gel
2.2 光响应复合载体的微观形貌及粒径
图3(a)为光响应凝胶负载在上转换纳米粒子后形成的光响应复合载体的TEM图,可以明显看出,上转换纳米粒子UC的表面包覆着一层光响应凝胶PG,表明上转换纳米粒子成功负载上光响应凝胶。由图3(b)和3(c)可知,上转换纳米粒子和光响应复合载体的平均水合粒径分别为1 238 nm和1 853 nm,与上转换纳米粒子和光响应凝胶相比,复合载体的平均水合粒径明显增大,但并不是上转换纳米粒子与光响应凝胶的水合粒径直接相加的结果,其可能的原因是在合成复合载体的过程中,光响应凝胶以一层薄膜的形式包覆在上转换纳米粒子表面,所以形成的复合载体的水合粒径比二者的水合粒径直接相加的结果要小,这进一步表明成功合成了光响应复合载体。

图3 光响应复合载体的TEM图及上转换纳米粒子、复合载体的DLS直方图Fig.3 TEM image of the photo-responsive composite carrier, and DLS histograms of upconversion particles and the composite carrier
2.3 光响应复合载体的光化学性能
利用紫外可见分光光度计和荧光光谱仪探究了光响应复合载体的紫外吸收和荧光发射性能,结果如图4所示。从紫外吸收光谱可以看出,光响应复合载体在紫外区域有较宽的吸收峰,在325 nm处的吸收峰是由光响应凝胶中香豆素类光响应基团发生n-π*跃迁产生的[11]。从荧光发射光谱可以看出,当激发波长为980 nm时,光响应复合载体在340~370 nm范围内有荧光发射峰,这是由上转换纳米粒子中Tm3+丰富的能级跃迁引起的[12]。并且光响应复合载体的紫外吸收光谱与荧光发射光谱有一定的重叠,因此光响应复合载体可以在近红外光照射下实现光裂解。

图4 光响应复合载体的紫外吸收光谱与荧光发射光谱(激发波长980 nm)Fig.4 Ultraviolet absorption spectrum and fluorescence emission spectrum of the photo-responsive composite carrier (excitation wavelength 980 nm)
2.4 光响应凝胶和复合载体载药时的粒径、装载率和包封率
未装载与装载香豆素102的光响应凝胶和复合载体的粒径、装载率和包封率如表1所示。光响应凝胶和复合载体装载香豆素102后的粒径分别为1 766 nm和2 354 nm,与未装载时相比,其粒径明显增大,表明成功装载了香豆素102。光响应复合载体的装载率(11.16%)和包封率(45.7%)略大于光响应凝胶的装载率(10.32%)和包封率(43.3%),这是由于光响应复合载体比光响应凝胶的比表面积大的缘故。

表1 光响应凝胶和复合载体的粒径、装载率和包封率Table 1 Particle size, loading rate and encapsulation rate ofthe photo-responsive gel and composite carrier
2.5 光响应复合载体的刺激响应释放性能
在激发波长405 nm下装载香豆素102的光响应凝胶和复合载体的荧光发射光谱如图5所示。

图5 在激发波长405 nm下装载香豆素102的光响应凝胶和复合载体的荧光发射光谱Fig.5 Fluorescence emission spectra of the photo-responsive gel and composite carrier loaded with coumarin 102 at an excitation wavelength of 405 nm
图5(a)显示,未结合上转换纳米粒子的光响应凝胶在近红外光下照射20 min后,在478 nm处的最大荧光发射峰的强度没有明显降低,这说明在没有上转换纳米粒子的存在下,近红外光不能使装载香豆素102 的光响应凝胶发生裂解而释放出香豆素102。另外,与光照射前相比,在近红外光照射20 min后光响应凝胶在478 nm处的荧光强度降低了约10%,原因可能是在近红外光照射的过程中产生的热量导致光响应凝胶发生了一定量的热降解[13]。如图5(b)所示,在波长365 nm、光强60 mW/cm2的紫外光照射下,装载香豆素102的光响应凝胶的光照时间越长,其在478 nm处的最大荧光发射峰的强度越低,与光照射前相比,光照20 min后的荧光强度减小了64.3%,说明在紫外光的作用下,光响应凝胶可以发生裂解,装载在内部的香豆素102分子不断被释放出来,使其荧光强度不断减小。如图5(c)所示,装载香豆素102的光响应复合载体在近红外光的照射下发生了明显的光降解现象,与照射前相比,照射20 min后在478 nm处的荧光强度减小了73.1%,说明吸收近红外光的上转换纳米粒子放出的紫外光作用于光响应凝胶使其裂解,释放出香豆素102,从而使荧光强度降低。另外,相比于光响应凝胶在紫外光照射下的情况,光响应复合载体在近红外光的照射下荧光强度降低的程度更大,这个现象是由于光响应复合载体在近红外光照射的过程中,不仅产生了紫外光作用于光响应凝胶,而且近红外光产生的热也作用于光响应凝胶使其发生了热裂解,光热双重作用使其释放出更多的香豆素102。由图5(d)可知,在405 nm的激发波长下,未装载香豆素102的复合载体裂解所产生的香豆素光解副产物的最大荧光发射波长为463 nm。在980 nm近红外光下照射20 min,463 nm处的荧光强度变化不大,说明光解副产物很少,不会影响模拟累积释放试验。
图6显示了装载香豆素102的光响应凝胶和光响应复合载体在365 nm紫外光和980 nm近红外光照射下的释放曲线。可以看出,装载香豆素102的光响应凝胶在近红外光下照射20 min后,香豆素102的累积释放率只有10.8%,此时的释放主要是由于近红外光所散发出的热量使光响应凝胶发生了部分热裂解,释放出香豆素102。与其相比,光响应凝胶在紫外光下照射20 min后可以释放出更多的香豆素102,累积释放率达51.3%。对于光响应复合载体,在近红外光的作用下,受到紫外光响应和部分热响应的双重作用,照射20 min后香豆素102的累积释放率高达72.6%,远高于光响应凝胶在紫外光下的累积释放率。因此,所合成的光响应复合载体具有优异的近红外光刺激响应释放性能,具有应用于药物释放领域的潜能。
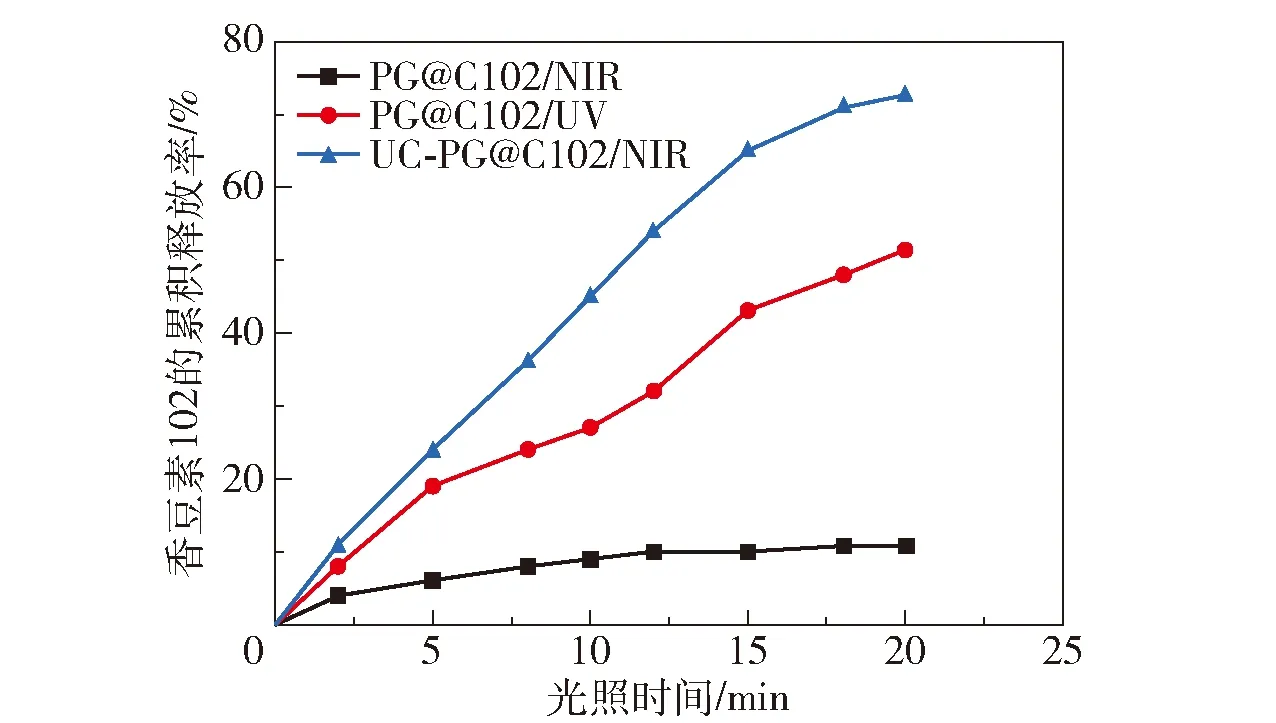
图6 装载香豆素102的光响应凝胶(PG@C102)和复合载体(UC-PG@C102)在365 nm紫外光和980 nm近红外光照射下的释放曲线Fig.6 Release profiles of the photo-responsive gel (PG@C102) and composite carriers (UC-PG@C102) loaded with coumarin 102 under 365 nm UV and 980 nm NIR irradiation
2.6 光响应复合载体的细胞毒性
光响应复合载体以及在近红外光照射20 min时装载香豆素102的复合载体对HeLa细胞活力的影响如图7所示。从图中可以看出,在光响应复合载体的存在下以及复合载体在20 min的药物释放过程中,HeLa细胞均表现出较高的活力(均大于90%),这表明光响应复合载体对HeLa细胞的毒性较低。

图7 光响应复合载体以及装载香豆素102的复合载体在近红外光照射20 min时对HeLa细胞活力的影响Fig.7 Effect of the photo-responsive composite carrier and composite carrier loaded with coumarin 102 after near-infrared light irradiation for 20 minutes on the viability of HeLa cells
3 结论
(1)通过共混法制备了上转换纳米粒子表面包覆一层香豆素基光响应凝胶的近红外光响应复合载体,其紫外吸收光谱与荧光发射光谱有一定的重叠,可以实现近红外刺激响应。
(2)光响应复合载体比光响应凝胶的装载率和包封率略大。在980 nm近红外光作用下,装载模拟药物香豆素102 的复合载体发生裂解,可以有效地释放香豆素102,照射20 min后,累积释放率达72.6%,远大于香豆素基凝胶在365 nm紫外光下照射20 min时的累积释放率(51.3%)。
(3)在光响应复合载体的存在下以及复合载体在20 min的释药过程中,HeLa细胞活力均大于90%,表明光响应复合载体对HeLa细胞的毒性较低。
