壬基酚对小鼠肝肾组织的多毒性效应研究
2021-11-11杨少青周彬邵春艳宋泉江宋厚辉王晓杜姜胜
杨少青,周彬,邵春艳,宋泉江,宋厚辉*,王晓杜*,姜胜*
(1. 浙江农林大学动物科技学院动物医学院,浙江 杭州 311300;2. 浙江省畜禽绿色生态健康养殖应用技术研究重点实验室,浙江 杭州 311300;3. 动物健康互联网检查技术浙江省工程实验室,浙江 杭州 311300)
壬基酚(nonylphenol,NP)是非离子表面活性剂壬基酚聚氧乙烯醚(NPEOs)的主要降解产物和中间体,广泛存在于土壤、空气和水中[1-2]。壬基酚具有一定的雌激素活性,属环境内分泌干扰物(EEDs)[3],能够通过水体、土壤和空气进入动物体内,并通过食物链富集放大,严重影响动物和人类健康及水生生态系统安全[4]。研究发现NP对动物和人类具有多器官毒性作用[5-9],而且在人尿样和脂肪组织中检测到NP[10-11]。最近的研究表明,接触EEDs会增加代谢紊乱的风险,如脂肪变性、肥胖和II型糖尿病等[12-15]。目前,NP对人类及动物健康的影响已不容忽视。因此,本研究探讨了NP染毒对小鼠肝肾损伤效应,为研究NP促发脂肪肝性疾病和肾脏疾病作用机制提供科学依据。
1 材料与方法
1.1 试剂
壬基酚(NP,纯度≥99%)购自上海阿拉丁生化科技股份有限公司;玉米油购自北京索莱宝科技有限公司;总抗氧化能力(T-AOC)、超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、谷胱甘肽过氧化酶(GSH-Px)和丙二醛(MDA)检测试剂盒购自南京建成生物工程研究所有限公司。
1.2 实验动物分组与处理
清洁级ICR小鼠(40只,雌雄各半,体重18~23 g)购自杭州子源实验动物科技有限公司,实验动物合格证号为20201225Abzz0105999790。小鼠饲养于温控净化实验动物房中,环境温度保持24~26 ℃,饲喂商品化颗粒饲料和清洁饮水。饲喂1周后,小鼠随机分为4组,分别为对照组(CON)和低(LNP)、中(MNP)、高剂量(HNP)NP染毒组,每组10只,雌雄各半。试验期间每天于上午9:00,采用口服灌胃法进行染毒试验,CON小鼠给予玉米油,LNP小鼠给予100 mg/kg NP,MNP小鼠给予150 mg/kg NP,HNP小鼠给予200 mg/kg NP。各组灌胃体积为0.01 mL/kg,每晚21:00禁食,连续灌胃30 d,每天1次。每日观察小鼠精神状态、饮水与采食情况、排便排尿情况等。每5 d测量小鼠的体重变化并调整灌胃量。
1.3 体重日均增重量及肝肾脏器系数测定
染毒30 d结束后,小鼠称重计算体重日均增重率,日均增重率=(试验后体重-试验前体重)/试验天数。称重结束后小鼠处死,迅速分离肝脏和肾脏进行称重,并计算肝或肾脏器系数(肝或肾脏器系数=肝或肾重量/体重×100%);取部分肝肾组织用于病理形态学分析,其余组织-80 ℃保存备用。
1.4 小鼠肝脏和肾脏组织病理学观察
每组取适量肝脏和肾脏组织至于10%甲醛溶液中固定,常规脱水,石蜡包埋,制备切片,HE染色后光学显微镜下观察肝脏和肾脏显微结构变化。
1.5 小鼠肝功和肾功参数的测定
小鼠处死前,经颌下静脉采血0.5 mL,室温静置10 min后3 500 r/min离心10 min,取适量血清,使用动物专用生化分析仪检测肝功和肾功参数:谷草转氨酶(AST)、谷丙转氨酶(ALT)、碱性磷酸酶(ALP)、总胆红素(TBIL)、总蛋白(TP)、白蛋白(ALB)、肌酐(CREA)、血尿素(UREA)和血清磷(P)。
1.6 统计学方法
试验所得数据表示为“平均值±标准差”,使用GraphPad Prism 8.0软件进行数据制图,试验数据采用单因素方差分析,运用t检验进行数据配对差异分析,P<0.05为差异显著,P<0.01为差异极显著。
2 结果
2.1 体重日均增长量及脏器系数
试验过程中,各组试验小鼠均未出现死亡,对照组小鼠精神状态良好,采食量和饮水量均正常;低剂量NP染毒小鼠精神状态未见明显异常,但采食量和排便量均稍减少,中高剂量NP染毒小鼠精神状态尚可,被毛稍显粗乱,欠光泽,采食量和排便量下降,各组小鼠活动能力未见明显异常。经过30 d染毒,各组染毒小鼠的日均增重量随着NP剂量的增加而降低,且均显著低于对照组(P<0.01);与CON比较,LNP、MNP和HNP小鼠的肝体系数显著升高(P<0.05);CON相比,各染毒组小鼠肾体系数无显著性变化(P>0.05)。总体而言,随着NP染毒剂量增加,小鼠增重量逐渐降低,增重量与NP染毒剂量呈负相关,说明NP染毒可影响小鼠的生长发育。各组小鼠体重日均增长量和脏器系数见图1。

*表示P<0.05;**表示P<0.01;***表示P<0.001。下同
2.2 肝脏和肾脏组织病理学检测
如图2所示,LNP小鼠肝脏中央静脉周围可见少量肝细胞水肿,胞质疏松淡染(黑色箭头),少量肝细胞轻度脂肪变性,胞质中可见较小的圆形空泡(黄色箭头);MNP小鼠肝细胞水肿,胞质疏松淡染(黑色箭头);局部汇管区门静脉周围可见少量淋巴细胞浸润(黄色箭头);HNP小鼠肝脏中央静脉周围可见大量肝细胞水肿,胞质疏松淡染(黑色箭头);肝细胞脂肪变性,胞质中可见较小的圆形空泡(黄色箭头)。如图3所示,LNP小鼠肾脏局部肾小囊腔内有少量嗜酸性物质(黑色箭头);MNP小鼠肾脏肾小管扩张(黑色箭头);局部可见肾小管上皮细胞轻度水肿(黄色箭头);HNP小鼠肾脏有大量肾小囊腔萎缩(黑色箭头)。

A. CON组;B. LNP组;C. MNP组;D. HNP组
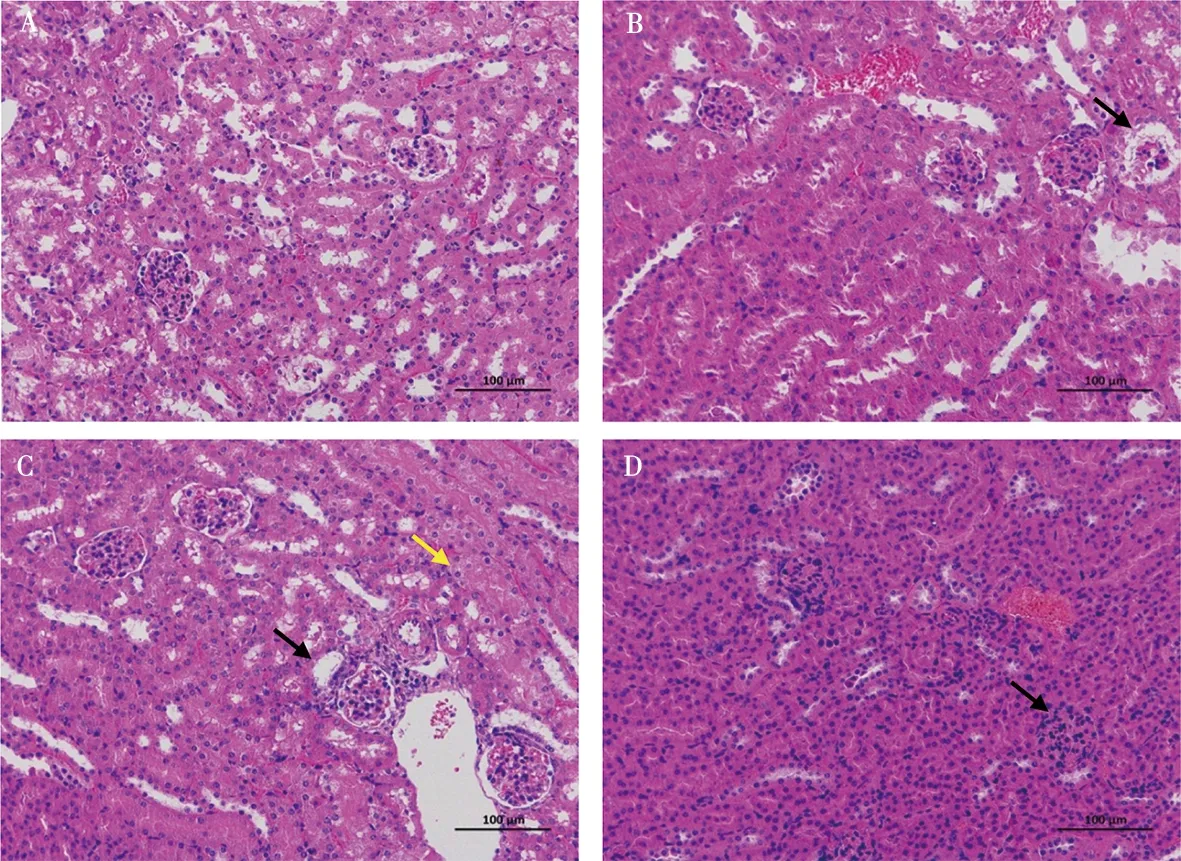
A. CON组;B. LNP组;C. MNP组;D. HNP组
2.3 肝功和肾功参数检测
小鼠经过不同剂量NP灌胃后血清肝功和肾功参数的变化见图4和图5。与CON比较,LNP、MNP和HNP小鼠血清AST和ALP含量均显著升高(P<0.05),HNP小鼠血清ALT和TP含量显著升高(P<0.01),HNP小鼠血清ALB含量显著降低(P<0.01);与LNP比较,HNP小鼠血清AST、ALT和TP含量均显著升高(P<0.05);与MNP比较,HNP小鼠血清ALT和TP含量均显著升高(P<0.05)。各组小鼠血清中TBIL含量均无显著性变化(P>0.05)。与CON比较,MNP和HNP小鼠血清UREA和血清P含量均显著升高(P<0.05),LNP小鼠血清P含量显著升高(P<0.05),LNP、MNP和HNP小鼠血清CREA含量无显著性变化(P>0.05);与LNP比较,MNP和HNP小鼠血清P含量均显著升高(P<0.01);与MNP比较,HNP小鼠血清P含量显著升高(P<0.01)。

图4 不同剂量NP对小鼠血清肝功参数的影响
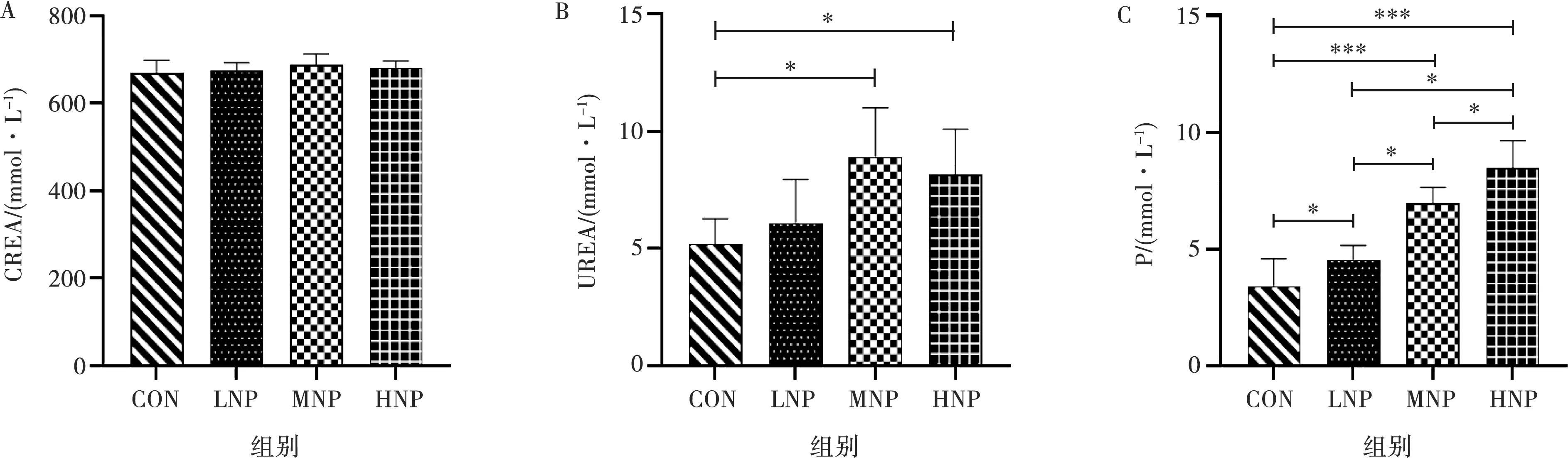
图5 不同剂量NP对小鼠血清肾功参数的影响
3 讨论
NP是一种典型的内分泌干扰物,在环境中检出率较高,而且在卵巢、肝脏、肾脏等器官及血清中容易蓄积[16]。研究表明NP能够与雌激素受体结合,破坏组织器官氧化应激平衡状态[17],从而破坏机体内分泌状态及代谢器官(如肝脏)的生理功能[18]。本研究中经不同剂量NP灌胃30 d后,小鼠体重增长量随着NP剂量的增加而降低,说明NP染毒抑制小鼠体重增长,这与大鼠的研究结果保持一致[19]。脏体系数是一种反映毒物对动物机体脏器毒害作用的综合性参数,可反映该脏器长期受影响的情况,是亚慢性毒性试验中较为常用的评价指标。组织脏体系数增加,预示该脏器可能出现增生、肥大、水肿或充血;组织脏体系数下降,预示染毒后该脏器出现了萎缩或其他退行性病变[20]。因此,脏体系数变化可提示脏器组织形态病理学的变化[21]。本研究中NP染小鼠肝脏脏体系数增加,肾脏脏体系数降低,这也与已有研究结果保持一致[21],说明肝脏和肾脏是NP毒性效应器官之一。综合小鼠体重增长量和脏体系数的变化,说明NP染毒可影响小鼠的生长发育。
肝脏是机体主要的解毒和代谢器官,参与机体的解毒、代谢、排泄等多种生理功能。AST和ALT是最为常见的表征肝功能的生物标志物[22-24]。AST通常仅存在于肝脏,而ALT也见于骨骼肌、肾脏、大脑和红细胞中。正常情况下,血中ALT和AST水平较低,但肝细胞受到损害或肝细胞膜通透性增加后,ALT和AST会由细胞中渗出,转入血液循环[25]。肝功能异常不仅表现在血清中AST、ALT升高,血中ALB降低也能说明肝功能异常[26]。当肝脏受损时,经由肝细胞合成的ALB合成量减少,因此血清中ALB水平降低显示肝细胞合成功能降低。本研究中肝脏损伤标志物AST与NP剂量呈正相关,小鼠血清AST水平随着NP剂量的增加而增加。血清中ALT和ALB水平变化虽与NP剂量未呈现正相关关系,但高剂量NP染毒小鼠ALT高于对照组,而ALB则低于对照组。因此本研究结果表明,NP染毒30 d对小鼠肝脏造成一定损伤。另外肝脏组织病理学分析结果也可印证,各组NP染毒小鼠肝脏组织均出现水肿和脂肪变性,而且发生水肿的肝细胞数量随着NP染毒剂量的增加而增加,表明NP进入小鼠体内后,在肝脏中蓄积,导致肝细胞发生水肿,进一步提示肝损伤的发生,这也与小鼠肝脏脏体系数结果相呼应。这可能跟NP具有亲脂性,容易在肝脏组织中蓄积有关[16]。研究表明,NP可破坏小鼠肝脏结构的完整性、促进肝细胞ALT和AST的释放,抑制肝细胞合成功能,导致肝损伤。
肾脏的基本功能是生成尿液,它是机体清除体内代谢产物及某些废物、毒物的重要器官。本研究结果显示,不同剂量NP染毒30 d小鼠肾脏脏体系数并未发生明显改变,无显著性差异,表明NP暴露可能并未对肾脏造成显著的形态学损伤。血中尿素和肌酐含量是指示肾功能的标志物,血中二者水平的升高提示肾功能障碍[27]。有研究发现NP具有一定的肾毒性,会导致血中与肾功能有关的指示物(如尿酸、肌酐和葡萄糖等)发生紊乱[28]。本研究结果也证实,NP染毒后,小鼠血中尿素水平显著提高,而肌酐未发生显著性变化,提示NP可能引起小鼠肾功能损伤,使得肾脏排泄尿素的能力下降。通过HE染色对肾脏组织病理学分析发现,肾脏肾小囊腔内有少量嗜酸性物质和肾小管上皮细胞轻度水肿,高剂量NP导致小鼠肾脏肾小囊腔萎缩,说明NP对小鼠肾脏组织结构造成一定损伤。这与NP暴露3周对鱼肾脏组织结构的影响结果保持一致[29]。
综上所述,NP暴露对小鼠具有肝肾多毒性效应,可引起小鼠肝脏和肾脏发生不同程度的损伤,影响肝肾功能和组织结构。但鉴于暴露方式、暴露剂量、机体代谢及环境分布等多因素变量影响,NP对肝肾毒性的具体作用机制尚未阐明,因此NP肝肾毒性机制仍需进一步研究。
