肿瘤间质比在胃癌术后患者预后评估中的价值
2021-11-11李松岩刘帛岩胡时栋林海冠杜晓辉
李松岩,刘帛岩,杨 宇,滕 达,胡时栋,林海冠,杜晓辉
解放军总医院第一医学中心 普通外科医学部,北京 100853
胃癌是全球第五大常见恶性肿瘤和肿瘤相关死亡的第三大原因[1]。肿瘤分期、大小、分化程度和淋巴结转移以及淋巴血管和神经侵犯是影响预后的明确因素。接受根治性肿瘤切除的患者5年生存率很低,约为30%[2]。显然,除了病理分期之外,仍然需要探寻新的预后标志物,以便优化患者管理及评估肿瘤患者预后。近年来,人们对肿瘤的微环境在肿瘤发生发展中的作用越发重视[3]。目前,人们认识到肿瘤间质在肿瘤发生、发展和转移中是不可缺少的,并且间质中的某些细胞成分具有影响预后的作用。肿瘤间质比(tumorstroma ratio,TSR)指肿瘤组织内肿瘤细胞与间质部分的比例,通过对术后HE染色病理切片进行评估获得,其被证明是结肠癌、前列腺癌、早期乳腺癌、卵巢癌、宫颈癌、鼻咽癌、肝细胞癌、食管癌、肺癌等不同类型肿瘤的一种新的预后因子[4]。在这些实体瘤中,肿瘤间质所占比例的增加与预后不良有关。也有研究表明,TSR在胃癌的预后评价中有重要作用[5]。本研究通过分析患者TSR与生存的关系评价TSR对胃癌患者根治性胃切除术后的预后评估价值。
资料与方法
1 资料 本研究选取2016年1月 − 2017年1月在解放军总医院第一医学中心接受根治性切除术的115例胃癌患者作为研究对象。所有患者均根据肿瘤部位和病变范围行根治性胃切除和D2淋巴结清扫术,在术前及术中均无肝等远处转移,均未接受新辅助化疗,术后均按照美国国立综合癌症网络(NCCN)指南的建议接受辅助化学治疗[6]。T分期和N分期采用美国癌症分期联合委员 会(AJCCS)手册第7版分期标准[7]。
2 病理检查 每例手术后采用4 mm厚的甲醛固定石蜡包埋组织块切片进行HE染色,每张切片都由两名病理科医师分别仔细审查。当单个肿瘤细胞或细胞团在内皮细胞包裹的血管样结构内清晰可见时,即为淋巴血管侵犯阳性。神经周围浸润是指癌细胞沿着神经和(或)存在于神经鞘的外膜周围、神经周围和神经间隙内,侵犯至少33%的神 经组织。
3 肿瘤间质比的确定 首先在40×镜下选取肿瘤浸润最明显的区域(不含癌旁组织,尽量避免坏死组织),然后在 100×镜下记录视野内肿瘤细胞以及剩余间质部分所占的百分比,进而计算TSR。每个患者至少选取2个视野进行评估,取TSR低者作为最终取值。以TSR ≤ 50%为低间质比组,T SR>50%为高间质比组。
4 随访 术后以电话方式进行随访,截止日期为2020年1月。排除手术后30 d内死亡患者以及失访患者。随访内容为患者总生存(overall survival,OS)期以及无病生存(disease-free survival,DFS)期。OS定义为手术日期至死亡日期之间的间隔,DFS定义为从手术到肿瘤局部或远处复发的时 间。
5 统计学方法 使用SPSS22.0软件进行资料分析。分类变量的比较采用χ2检验,连续变量的比较使用t检验。采用log-rank检验绘制单因素生存分析Kaplane-Meier曲线。Cox回归模型分析变量对总生存期及无病生存期的影响。P<0.05为差异有 统计学意义。
结 果
1 一般资料 本研究最终纳入115例Ⅰb/Ⅱ/Ⅲ期胃癌患者,其中女42例,男73例,平均年龄(74.1±11)岁。病理检查肿瘤平均直径(41±18) mm,切缘均为R0。术中平均回收淋巴结(23±11)枚,病理检查转移淋巴结平均(7.3±4.4)枚。23例(20%)为Ⅰb期胃癌,63例(55%)为Ⅱ期胃癌,29例(25%)为Ⅲ期胃癌。神经浸润阳性74例( 64%),淋巴血管浸润45例(39%)。
2 不同间质比组一般及临床特点比较 高间质比组53例(46.0%),低间质比组62例(54.0%)。两组年龄、性别、肿瘤部位及肿瘤大小差异无统计学意义(P>0.05)。低间质比组有较高的T3/T4局部侵袭率(65.0% vs 40.0%,P<0.05)和N2/N3淋巴结转移率(55.0% vs 26.3%,P<0.05),TNM分期较晚(34.0% vs 15.0%,P<0.05),淋巴血管侵犯的比例(52.0% vs 25.0%,P<0.05)和神经周围浸润 的比例(73.0% vs 55.0%,P<0.05)更高(表1)。
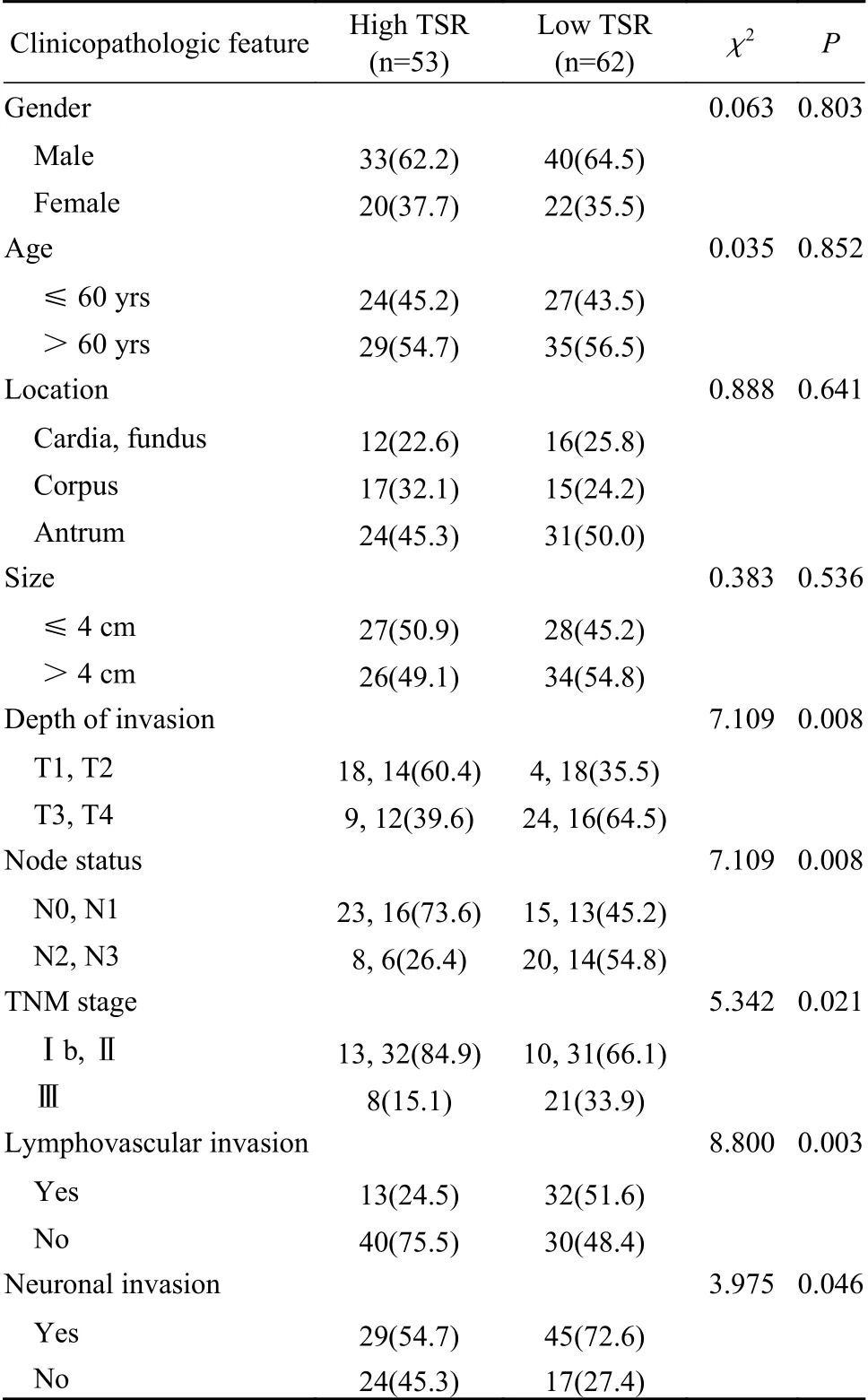
表1 胃癌肿瘤间质比与临床病理特征的关系(n, %)Tab. 1 Correlations between TSR and clinicopathologic features in the patients with gastric cancer (n, %)
3 生 存 期 中 位 随 访 时 间27(6 ~ 47)个 月。115例中,55例(48.0%)死亡,60例(52.0%)存活。1年和3年OS率分别为90.0%和49.0%。在R0切除后,73例(63.0%)复发,1年和3年DFS率分别为91.0%和44.0%。低间质比组的3年OS率(24.0% vs 70.0%,P<0.001)和DFS明显低于高间质比组(20.0% vs 62.0%,P<0.001)(图1,图 2)。

图1 高低肿瘤间质比组的总生存率比较Fig.1 Comparison of overall survival between the high TSR group and the low TSR group
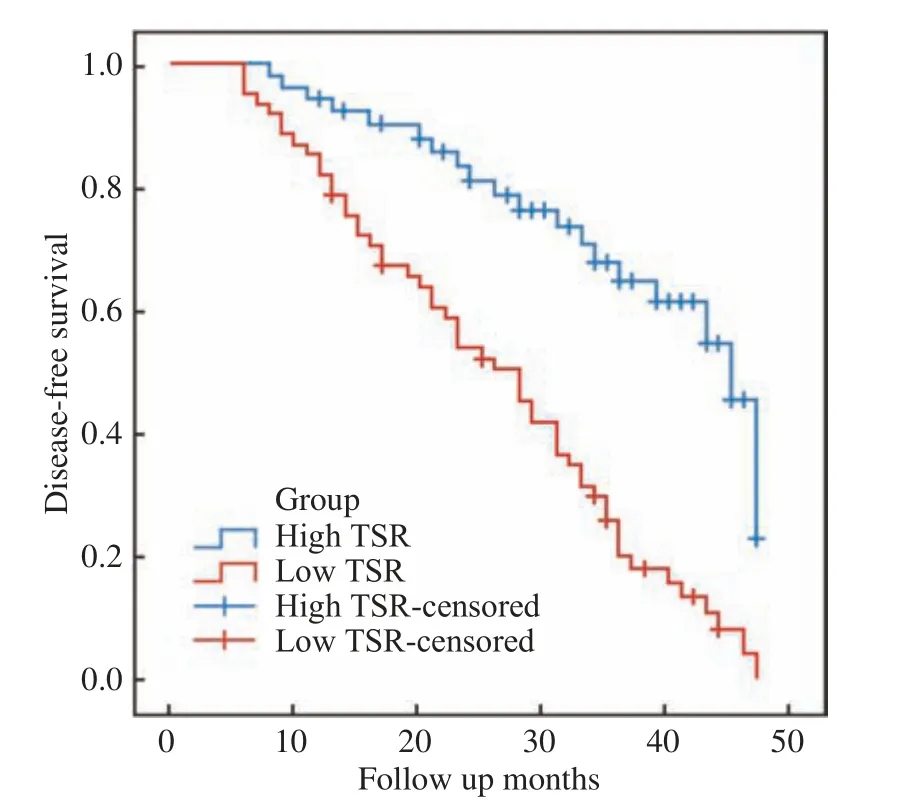
图2 高低肿瘤间质比组的无病生存率比较Fig.2 Comparison of disease free survival between the high TSR group and the low TSR group
4 危险影响因素分析 单因素分析(Cox比例风险回归)显示T分期(P=0.026)、N分期(P=0.022)、TNM分期(P<0.001)、淋巴血管侵犯(P=0.032)、神经侵犯(P=0.007)、TSR(P<0.001)与OS有关(表2),N分期(P=0.045)、TNM分期(P<0.001)、神经侵犯(P=0.013)、TSR(P<0.001)与DFS有关(表3)。Cox比例风险回归(全模回归)表明,TNM分期、神经侵犯和TSR与OS和DFS独立相关(表2,表3)。

表2 总生存期的影响因素分析结果Tab. 2 Influencing factors for overall survival

表3 无病生存期的影响因素分析结果Tab. 3 Influencing factors for disease free survival
讨 论
本研究结果显示,低间质比是与肿瘤侵袭性增强相关的病理参数。生存曲线和预后因素分析表明,高间质比组在OS和DFS方面均优于低间质比组。这与另一项回顾性研究结论相同[8]。总体上研究肿瘤间质比与胃癌患者预后关系的文章有限。
自从Mesker等[9]的研究得出低间质比(< 50%)结直肠癌患者预后较差的结论以来,人们对TSR预测肿瘤患者的预后越发重视。在高低间质比分析中,我们没有发现在人口学、手术方式等方面存在统计学差异。值得注意的是低间质比组平均转移淋巴结数目和N分期明显高于高间质比组,神经和淋巴血管浸润的比例也明显较高(P<0.05),转移淋巴结率低间质比组也明显高于高间质比组。另一方面,在高间质比组中,表现为T1肿瘤或N0淋巴结状态的患者明显更多,总体上TNM分期较低。
本研究显示,高间质比患者的3年OS和DFS分别为70%和62%,而低间质比患者的3年OS和DFS分别为49%和45%(P均<0.001)。在单因素分析中,转移淋巴结数、转移淋巴结比例、T分期、TNM分期、神经周围侵犯、淋巴血管浸润、间质比等影响肿瘤预后的因素均有统计学意义。尽管如此,在多因素分析中,只有TSR和TNM分期与OS和DFS独立相关。TNM分期已成为肿瘤预后的重要预测因子,目前已被用于对患者进行分层,以决定最佳治疗策略。我们认为TSR也可成为肿瘤预后的重要预测因子。
肿瘤组织由癌细胞和来源于正常组织的基质细胞组成。不同于正常组织中间质通过抑制肿瘤细胞的侵袭和增殖而起到屏障作用,肿瘤组织中的间质成分可以促进肿瘤的进展[10]。肿瘤间质由包括成纤维细胞(cancer-associated fibroblasts,CAFs)、免疫细胞、胶质细胞、上皮细胞等一系列细胞及细胞外基质和细胞外分子所组成。研究显示,这些非肿瘤细胞间的相互作用以及同肿瘤细胞直接或间接的相互作用通过各种分子信号通路,不仅使自身获得异常表型或功能,同时也使肿瘤间质发生功能改变,促进肿瘤发展[11]。研究表明,肿瘤相关CAFs是肿瘤间质的重要成分,可通过各种细胞因子、生长因子、炎性介质促进上皮细胞增殖,调节肿瘤细胞的生物活性,在肿瘤发生、侵袭、转移中发挥重要作用[12-13]。CAFs可分泌转化生长因子β和肝细胞生长因子诱导正常细胞发生恶变[14]。同时,转化生长因子β、基质细胞衍生因子、血管内皮细胞衍生生长因子以及细胞因子,可促进血管生成,导致肿瘤的发生[15-17]。
大部分胃癌患者即使在根治性切除后,仍有60%的局部复发率[18]。TSR与DFS独立相关,间质靶分子可以考虑用于间质比例较高的患者[19]。此外,考虑到间质在肿瘤血管生成中的作用,TSR可能是抗血管生成治疗反应的一个标志物[20]。恶性肿瘤TSR评估的优点是在常规病理评估中简单易行,重复性好[21],临床医生可以根据危险因素对患者进行分层,以评估预后和指导术后系统治疗的选择。
本研究存在一定的局限性,主要表现在样本量相对较小,为回顾性、单中心研究。因此,需要更多大规模的前瞻性研究来证实这些结果。
综上所述,TSR是胃癌患者预后不良的独立标志物。由于其评估相对简单,TSR可以很容易地纳入常规的临床病理报告,作为明确的胃癌患者根治性胃切除术后复发的敏感标志物,可为术后随访、强化辅助化疗和(或)靶向化疗提供有用的信息。
