磁共振成像DWI序列可代替增强扫描评估高强度聚焦超声治疗子宫腺肌症的即时消融效果
2021-11-10崔运能姚亮凤冯敏清张大伟
崔运能,姚亮凤,冯敏清,张 婧,张大伟
南方医科大学附属佛山妇幼保健院1放射科,2妇科,广东 佛山528000
高强度聚焦超声(HIFU)是近年来兴起的一种微创治疗技术,利用超声波的穿透性、可聚焦性和人体组织对超声波的吸收特性,将体外低能量超声波聚焦于靶区组织,通过热效应和空化效应使组织受升温或爆裂、振动的影响而发生凝固性坏死,从而达到病灶消融坏死的目的[1]。作为一种安全、有效的治疗方式,HIFU技术广泛应用于全身各部位病变治疗,如良恶性肿瘤、炎性病变等[2-4],但以在妇科疾病、尤其是子宫肌瘤及子宫腺肌症的效果更确切[5,6]。相对于子宫肌瘤,子宫腺肌症累及范围更广泛,难以实施局部切除术或动脉栓塞术,故HIFU技术可能更适合于子宫腺肌症的治疗[7,8]。
MR成像是HIFU治疗后评估即时消融效果的必不可少的影像学检查工具[9],通常是静脉注射钆对比剂后行增强扫描测量其非灌注区体积(NPV)了解其治疗效果。然而,钆对比剂的注射,不仅会增加患者经济负担,还会带来多种不良反应[10,11],故探讨不需使用钆对比剂就可评估HIFU治疗即时效果的MR技术,是放射工作者努力的方向之一。研究表明,子宫肌瘤或子宫腺肌症经HIFU治疗后即时行扩散加权成像(DWI)序列扫描时见扩散张量系数(ADC)降低,可与周围组织区分,能有效评估治疗效果[12-14],但该平扫序列能否代替增强扫描、有效评估子宫腺肌症HIFU治疗后即时消融效果,目前尚缺乏相关的报道。本研究回顾性分析我院行HIFU治疗的子宫腺肌症29例患者临床及影像学资料,通过评估DWI评估即时消融效果的可靠性,旨在探讨该序列取代增强扫描的可行性。
1 资料和方法
1.1 一般资料
回顾性分析2017年12月~2020年7月在南方医科大学附属佛山妇幼保健院诊断为子宫腺肌症并进行HIFU治疗的患者资料,均在术前、术后行MR检查,且经术前超声及MR检查提示病灶无明显变性、坏死,术后MR检查时间为HIFU治疗结束后24 h内。共获得29名患者资料,年龄30~51岁,平均40.5±5.4岁,术前检查时间3~351 d,中位时间23(9,34)d,术前子宫腺肌症病灶累及的体积为20.1~486.9 cm3,中值74.5(36.6,112.4)cm3。患者有不同程度的痛经(14例)、月经量增多(5例)、或同时受此两种症状困扰(10例)。
1.2 仪器与方法
采用JC-200型聚焦超声肿瘤治疗系统(重庆海扶技术有限公司),术前常规脱脂、脱毛。术中患者采取俯卧位,插入导尿管,适度充盈膀胱,在超声实时监控下,确保声波通路上避开肠管、膀胱等空腔器官,进行消融治疗。采用由深层至浅层逐层、由点到线、由线到面、由面到体逐步扫描治疗,以子宫腺肌症病灶的超声图像上出现明显灰度变化或能量达到阈值为治疗终点。
1.3 影像检查
使用1.5 T MR高场扫描仪(BRIVO MR355,GE)进行术前、术后检查,选择体部相控线圈,扫描序列参数为:矢状位FSE T2WI脂肪饱和序列:TR 3000 ms,TE 71 ms,视野420 mm×420 mm,矩阵288×256;冠状位FSE T2WI脂肪饱和序列,TR 2675 ms,TE 70 ms,视野300 mm×300 mm,矩阵288×256;轴位FSE T2WI脂肪饱和序列,TR 2800 ms,TE 59 ms,视野300 mm×300 mm,矩阵288×256,轴位FSE T1WI 序列:TR 680 ms,TE 12 ms,视野300 mm×300 mm,矩阵320×320,轴位DWI序列TR 3700 ms,TE 80 ms,b=800 s/mm2,视野300 mm×300 mm,矩阵96×128,矢状位DWI序列TR 3700 ms,TE 80 ms,b=800 s/mm2,视野420 mm×420 mm,矩阵96×128。上述序列的层厚6~8 mm,层间距1~2 mm。增强扫描时经肘静脉注射钆对比剂(Gd-DTPA)20 mL,注射速率为3 mL/s,注射后14 s行肝脏三维容积超快速多期动态增强扫描(LAVA)序列(TR/TE 4 ms/2 ms,FA 15°),扫描结束后进行轴位、矢状位、冠状位重建,层厚6~8 mm,层间距0 mm。HIFU治疗前、后均采用相同参数扫描。图像采集、重建后传输到图像传输与储存系统(PACS)。
1.4 影像学分析
由两名观察者在PACS上独立分析图像。术前子宫腺肌症病灶体积取两名观察者测量结果的平均值;NPV测量由第一名观察者执行;DWI图像上坏死消融区信号变化形态评估及体积测量由两名观察者独立进行,其中第一名观察者相隔至少14 d再评估一次。
选取显示靶组织的最大轴位、矢状位层面测量靶组织的左右径、前后径及上下径,利用椭圆体体积公式“π/6×左右径×前后径×上下径”计算靶组织体积[15,16]。术前子宫腺肌症病灶体积的测量在T2WI图像上进行,NPV的测量在增强扫描图像上进行。评估HIFU术后DWI序列消融坏死区形态时,将消融坏死区的信号改变的形态分为1型:斑点状或无明显信号改变(图1A),2型:斑片状(图1B),3型:环状(图1C)。测量消融坏死区体积时,可调用术前DWI及术后T2WI图像,仔细观察信号改变的边界,避免将子宫内膜的高信号误认为是消融坏死区;如术后DWI图像信号改变不明显、从而无法判断消融坏死区时,则放弃DWI图像上体积测量;观察术后增强扫描及DWI图像需要独立进行,避免两者相互影响。
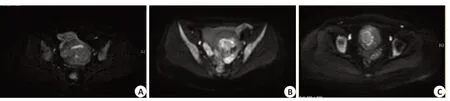
图1 基于DWI的消融坏死区形态学分型Fig.1 Morphology of the ablation area on diffusion-weighted images (DWI).A:Type 1 (spot-like) changes;B:Type 2(patchy)changes;C:Type 3(ring-like)changes.
1.5 统计学分析
使用SPSS 17.0及MedCalc 15.8软件进行统计学分析。计数资料以率标识,计量资料以均数±标准差(符合正态分布),或中位数和四分位数(不符合正态分布)表示。两名观察者对消融灶DWI信号改变形态判断的一致性采用kappa检验评估,DWI与增强扫描图像上测量消融坏死区体积的一致性、DWI上测量消融坏死区体积的观察者间、观察者内的可靠性检验参考类似研究方法、采用Bland-Altman法评估[17,18],计算差值的95%置信区间(95%CI)。对kappa值的解释遵循以下原则:<0.2为一致性很差,0.21~0.40为一致性较差,0.41~0.60为一致性一般,0.61~0.80为一致性较好,0.81~1.00为一致性良好;P<0.05认为差异有统计学意义。
2 结果
2.1 一般情况
29例患者,共计29个消融坏死区。NPV体积0.6~254.7 cm3,中位体积36.9(16.4,65.6)cm3。在DWI上经两名观察者3次评估,消融灶为1型4~5例,2型5~6例,3型19例,其中可测量的2、3型占82.8%~86.2%。
2.2 DWI序列消融坏死区的形态判断的一致性
两名观察者对1、2、3型判断结果一致的分别为4、4、18例,同一观察者不同时间对1、2、3型判断结果一致的分别为4,4,19 例。观察者间一致性的kappa 值为0.798(P=0.000),观察者内一致性的kappa 值为0.933(P=0.000),其一致性分别为较好、良好。
2.3 DWI序列与增强扫描测量消融坏死区体积的一致性
由Bland-Altman图(图2A)发现,仅1个点在95%一致性界限范围之外,一致性大于95.83%,DWI序列与增强扫描测量消融坏死区体积的一致性良好。
2.4 DWI序列测量消融坏死区体积的观察者间的可靠性
由Bland-Altman图(图2B)发现,仅1个点在95%一致性界限范围之外,一致性大于95.83%,DWI序列测量消融坏死区体积的观察者间一致性良好。
2.5 DWI序列测量消融坏死区体积的观察者内的可靠性
由Bland-Altman图(图2C)发现,仅1个点在95%一致性界限范围之外,一致性大于95.65%,DWI序列测量消融坏死区体积的观察者内一致性良好。

图2 体积测量一致性评估Bland-Altman图Fig.2 Bland-Altman plots for assessing consistency between DWI and CE (A) and the intra-(B) and inter-observer agreements of DWI(C).The full line marks the mean value of the difference between volume measurements.The dashed lines define the 95% confidence interval of the difference.
2.6 1型消融坏死区的体积
在DWI序列上经任意一次评定为1型消融坏死区共5个,体积分别为0.64、1.96、2.75、11.78、18.61 cm3,最大体积18.61cm3。
2.7 异常测量值分析
DWI序列与增强扫描测量消融坏死区体积、DWI序列测量消融坏死区体积的观察者间、观察者内可靠性分析的95%一致性界限范围之外测量值均来自于同一病例,其消融坏死区体积较大,是观察者1在DWI图像第一次测量值与其他的数值出现较大的偏差所致。
3 讨论
29例子宫腺肌症患者HIFU治疗后即时检查,DWI序列显示大部分(24~25例)病灶消融坏死区呈斑片状或环状高信号,小部分(4~5例)消融坏死区呈斑点状高信号或在DWI难以观察到信号改变,观察者间、观察者内的可靠性较高(kappa 值分别为0.798、0.933)。在DWI序列上测量斑片状或环状高信号消融坏死区体积观察者间、观察者内一致性高,与增强扫描测量的消融坏死区体积也具有较高的一致性。在DWI序列上表现为斑点状高信号或难以观察到信号改变的病灶,虽然无法直接测量其消融坏死区体积,但增强扫描证实其消融效果差。本研究结果提示,通过消融坏死区形态学观察、体积测量步骤,DWI序列可代替增强扫描评估子宫腺肌症HIFU治疗即时消融效果。
病理学证实,靶组织经HIFU治疗后,细胞发生不可逆凝固性坏死,靶区内微血管、毛细血管网组织结构遭到高温或微波效应的破坏,局部组织血流灌注减少或中断[19],这种改变,可通过超声造影或MR增强扫描观察[20]:消融坏死的靶组织因缺乏血供而无灌注、无强化,而残存的组织仍然保留血流灌注,呈显著强化,坏死组织与残存组织存在明显的区别。
超声造影检查较便利,费用相对较低,评估消融坏死区效果确切[21],但存在操作者依赖性大的缺点,其检查流程难以标准化。MRI因具有多序列、多参数和多平面成像以及良好的软组织对比度,操作者依赖性低、容易标准化评估等优点,其中增强扫描为标准成像序列广泛应用于子宫肌瘤及子宫腺肌症的消融效果评估标准[22,23]。然而,由于MR增强扫描需要静脉注射钆对比剂,为有创性操作。对比剂的使用,不仅会增加个人及社会经济负担,延长准备、扫描时间,还带来加重人体肾脏负荷、可能诱发对比剂肾病的危险[24,25]。研究显示,钆会在人体内沉积,多次注射还有累积效应,数年内仍可见注射后遗留的顺磁性改变[26,27]。故临床上需要寻找避免注射对比剂的MR平扫序列代替增强扫描,准确、方便、安全评估HIFU治疗的消融效果。
在众多MR平扫序列中,DWI序列因可检测HIFU治疗后改变、辨认消融坏死区而广为人知。胡森阳等[28]报道,HIFU治疗后子宫肌瘤在DWI上呈靶环样改变:内部呈相对低信号、外周呈高信号。Liao等[29]研究也表明,经HIFU治疗的598个子宫肌瘤,78.09%病灶表现为完整的环状,21.91%病灶表现为不完整的环状信号改变。我们在子宫腺肌症病灶上也观察到类似的改变:29例病灶经HIFU治疗后即时行MR检查,约82.8%病灶可在DWI上观察到明显信号改变,其中约24例表现为环状或斑片状改变,约5例表现为斑点状或无明显信号改变。而且,通过两名观察者的评估,观察者间与观察者内对DWI上消融坏死区信号形态判断的一致性较高(kappa值分别为0.798、0.933),说明形态分类的可识别度高,具有较高的可靠性。
靶组织消融坏死,是作为评估HIFU治疗效果的最直接体现,需在增强扫描上测量。鉴于其他序列也可以显示治疗后消融坏死区信号改变,学者尝试用这些序列代替增强扫描评估消融坏死效果。在子宫肌瘤治疗领域,Liu等[30]证实,在治疗后3月的MR检查T2*WI序列可见低信号环绕消融坏死区域,测量的体积与NPV没有统计学差异。如前所述,鉴于HIFU治疗后靶组织的ADC值降低,DWI上表现为高信号,可与周围残存病灶或子宫肌层组织相区别,勾勒消融坏死区的边界,许多学者通过DWI序列测量子宫肌瘤HIFU治疗后消融坏死区与NPV无明显区别[28,29],张俊成等[31]也证实,基于IVIM的DWI序列上消融区的D*值及f值伪彩图与增强扫描所示NPV有较高的视觉吻合。我们通过调阅术前DWI序列图像,对比治疗前后的信号改变,从而更方便辨认消融区边界。
与前述研究不同,我们发现并不是所有经HIFU治疗的子宫腺肌症病灶可在DWI序列上进行消融坏死区的体积测量,即其中4~5例表现为斑点状高信号或无明显信号改变的病灶难以确定消融边界,其原因可能为本组有一定比例的病灶治疗效果欠佳,仅表现为斑点状坏死或无明显坏死,只能在增强扫描图像上显示。在DWI序列上表现为斑片状、环状的消融坏死区的体积数值与增强扫描的消融坏死区体积相比具有较高的一致性,仅1例DWI上测量的消融坏死区体积在95%一致性界限范围之外。在衡量不同的观察者或同一观察者不同时间在DWI序列测量消融坏死区体积的一致性时,我们也发现类似的结论,提示DWI序列应用于消融坏死区体积测量具有较高的可靠性。这表明,只要在DWI序列上表现为容易辨认的信号改变(斑片状或环状),可以认为信号改变区域类似于NPV;表现为难以辨识的斑点状或者无信号改变者,在增强扫描图像上测量消融坏死区体积为0.64~18.61 cm3,消融质量较差,这证明,如病灶在DWI序列上信号改变不明显,虽然无法直接测量其消融坏死区体积,但仍可推断其治疗效果较差、达不到预期目的,需要采用其他治疗方法。
本研究存在不足之处。一是研究的样本量较小,仅为29例,可造成结果偏倚,导致可信度下降;二是本研究为回顾性分析,缺乏ADC图、故无法利用ADC图进行体积测量;三是研究使用的NPV测量方法是临床常用的椭圆体体积计算方案,操作较简便,但当NPV形态不规则时,此方案对测量结果的准确性和可重复性造成一定的影响。
总之,作为一种不需要注射钆对比剂的MR平扫序列,DWI可显示大部分子宫腺肌症HIFU治疗后的信号改变,多呈斑片状或环状高信号,DWI序列与增强扫描测量消融坏死区体积具有较高的一致性,少数表现为斑点状高信号或信号改变不明显的病灶消融效果较差。通过在DWI序列图像上消融坏死区的形态学评估、消融坏死区体积的测量,DWI 序列可评估子宫腺肌症HIFU治疗即时消融效果,代替增强扫描,减少对比剂相关副作用,减轻个人及社会经济负担,优化子宫腺肌症HIFU治疗流程。
