131I治疗分化型甲状腺癌患者的免疫变化
2021-11-10张鲁榕缪蔚冰
陈 芸, 刘 苗, 张鲁榕, 缪蔚冰
甲状腺癌(thyroid cancer,TC)是女性第5大常见癌症[1],其发病率逐年上升,其中分化型甲状腺癌(differentiated thyroid cancer, DTC)占90%以上,经手术切除、放射性碘治疗及促甲状腺素(thyroid stimulating hormone,TSH)抑制治疗,大部分患者预后较好,但仍有20%的患者预后较差[2]。近年,免疫治疗备受关注,鉴于131I治疗后产生的免疫反应(如淋巴细胞转化,抗原激活的淋巴细胞亚群及抗TC抗体滴度)的相关报道较少,本研究旨在探讨131I治疗DTC患者导致的细胞免疫及体液免疫的变化。
1 对象与方法
1.1 对象 收集2017年1-6月在核医学科住院行131I治疗的DTC术后患者74例,男性27例,女性47例,年龄中位数46.7岁(18~72岁),病理诊断均为乳头状甲状腺癌(papillary thyroid carcinoma, PTC),且均已行甲状腺全切术或近全切除术。排除131I治疗前TSH水平<30 mIU/L者,合并其他类别肿瘤者,以及不配合实验或随访失败者。本研究经医院伦理委员会批准,患者均签署知情同意书。
依据病情将74例患者分为2组:(1)清灶组(radiotherapy, RT),131I治疗后全身显像提示具有摄131I的转移病灶者,或停用左旋甲状腺素片(levothyroxine,L-T4)3周后甲状腺球蛋白(thyroglobulin,Tg)>10 μg/L者,共42例,男性14例,女性28例;年龄中位数44岁(26~52岁);9例伴肺转移,2例伴骨转移,31例伴淋巴结转移;131I治疗2次25例,治疗≥3次17例,131I剂量为(5.85±1.07)GBq(图1A)。(2)清甲组(radioiodine remnant ablation, RRA),131I治疗后全身显像提示,除甲状腺床区外无异常放射性浓聚者,或随访抑制状态(即TSH<0.01 mIU/L)下Tg<0.2 μg/L者,共32例,男性13例,女性19例;年龄中位数48岁(31~51岁);均初次行131I治疗,131I剂量为(4.4±0.59)GBq(图1B)。
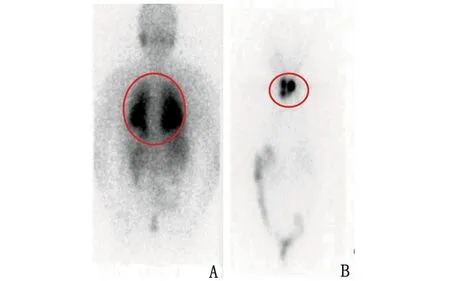
A:清灶组;B:清甲组。
1.2 方法
1.2.1 淋巴细胞转化的测定 人源TC 8305C由北京北纳创联生物技术有限公司提供,细胞培养采用含10%胎牛血清及1%青链霉素双抗的RPMI1640培养基(美国Hyclone公司),于37 ℃、体积分数为0.05的CO2、饱和湿度为95%的培养箱中培养,以0.25%胰蛋白酶+0.02% EDTA消化细胞。培养至对数生长期后,经过剂量率为200 cGy/min的直线加速器(Varian Rapid Arc Trilogy 5918,美国瓦里安医疗系统公司)照射4 min,制备出TC新型诱导性瘤苗。收集131I治疗前及治疗后45 d的外周血淋巴细胞,分成2份,以每孔1×106个细胞接种于24孔细胞培养皿中,分别设置不加肿瘤抗原(Ag-)和加入50 μg/mL的TC新型诱导性肿瘤抗原(Ag+)2组,均在含有5 μmol/L 5-乙炔基-2′脱氧尿嘧啶核苷(5-ethynyl-2′-deoxyuridine,EdU)的培养基中培养72 h。另设置1个不加EdU培养基的对照组。细胞固定化后采用1×Apo染色,上流式细胞仪(美国BD公司)检测。
1.2.2 淋巴细胞亚群变化的测定 收集TC细胞蛋白抗原刺激后的淋巴细胞,采用自身对照的方法,用FITC-抗人CD4或CD8及PE-抗人IFN-γ(美国BD Biosciences公司)进行荧光抗体单染或双染,用流式细胞仪检测染色阳性的CD4+、CD4+IFN-γ+、CD8+和CD8+IFN-γ+4组T淋巴细胞的百分比,统计每个患者不同时间点外周淋巴细胞加或不加TC抗原刺激的EdU值(即Ag+或Ag-的EdU值),并以二者的比值作为EdU值的变化倍数。
1.2.3 酶联免疫吸附测定法(ELISA-like)检测血清抗TC细胞蛋白抗体滴度 以TC细胞蛋白作为包被抗原调节至50 μg/mL的浓度,按照每孔100 μL包被于EILISA专用的酶标板(上海碧云天生物技术公司)上,放置平稳,4 ℃避光过夜,加入不同稀释倍数的一抗(131I治疗前及治疗45 d后患者的血浆)。加入1∶4 000的辣根过氧化物酶(horseradish peroxidase,HRP)-抗人IgG(北京博尔西科技有限公司),每孔100 μL,加入3,3′,5,5′-四甲基联苯胺(tetramethylbenzidine,TMB)显色液(湖南华腾制药有限公司)(按1∶10混合),每孔100 μL,在酶标仪上测定450 nm波长下的OD值。抗体滴度的判定标准:(治疗后OD值-空白对照OD值)/(治疗前OD值-空白对照OD值)≥1.2为阳性,出现阳性显色的最高稀释倍数即为抗体滴度。
2 结 果
2.1131I治疗前后的淋巴细胞转化幅度 (1)TC淋巴细胞转化幅度治疗后较治疗前明显升高,131I治疗前后EdU值的变化倍数分别为(0.95±0.49)及(1.37±0.85),二者差别有统计学意义(t=2.817,P<0.05)(图2A)。(2)131I治疗后的淋巴细胞转化与治疗前比较,清灶组升高19例,阳性率83%,清甲组升高7例,阳性率58%,2组间差别无统计学意义(χ2=2.433,P>0.05)。(3)131I治疗前后TC淋巴细胞转化实验EdU值的变化倍数,清灶组分别为(0.97±0.55)及(1.80±1.84),差别有统计学意义(t=2.593,P<0.05)(图2B);清甲组分别为(0.91±0.36)及(1.18±0.59),差别无统计学意义(t=1.136,P>0.05)(图2C)。
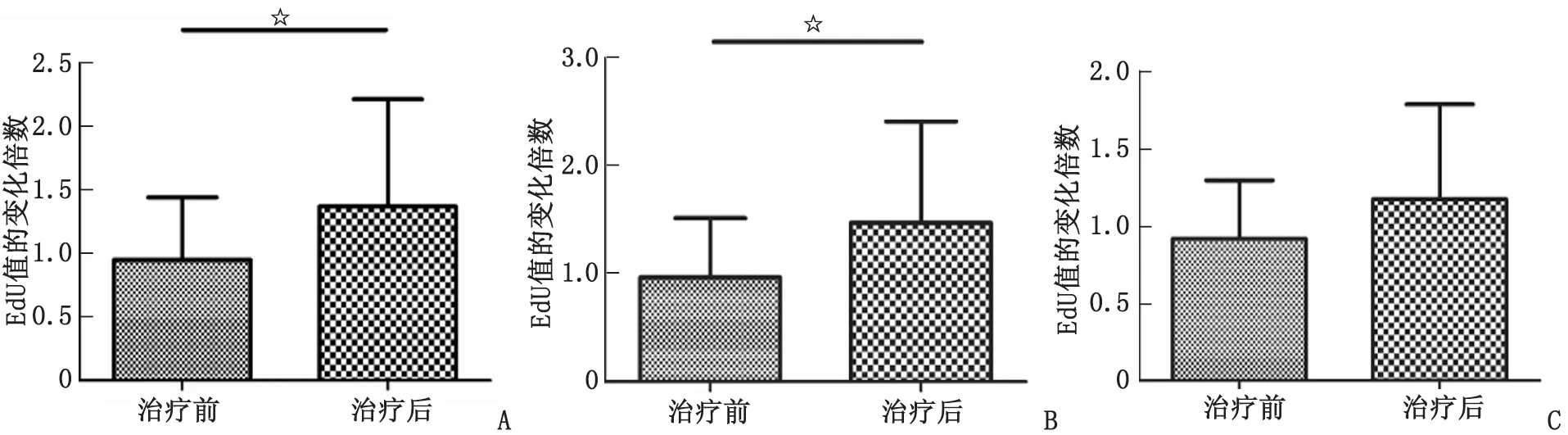
A:乳头状甲状腺癌;B:清灶组;C:清甲组。与治疗后的比较,☆:P<0.05。
2.2131I治疗前后的淋巴细胞亚群变化
2.2.1 清灶组和清甲组淋巴细胞亚群变化例数 (1)131I治疗后组内比较,清灶组CD4+、CD4+IFN-γ+、CD8+淋巴亚群降低的例数较多,而CD8+IFN-γ+升高的例数较多;而清甲组4个淋巴亚群均以降低为主;(2)2组间比较,清灶组CD8+IFN-γ+升高比例较清甲组明显增高,差别有统计学意义(P<0.05),其余亚群2组间比较差别无统计学意义(表1)。

表1 清灶组和清甲组淋巴亚群治疗前后变化例数比较
2.2.2 清灶组和清甲组淋巴细胞亚群变化幅度131I治疗后,清灶组CD4+IFN-γ+、CD8+、CD8+IFN-γ+淋巴亚群均升高,CD4+淋巴亚群降低,但与治疗前比较,差别均无统计学意义;而清甲组4个淋巴亚群均降低,其中CD8+淋巴亚群降低幅度与治疗前比较差别有统计学意义(表2)。
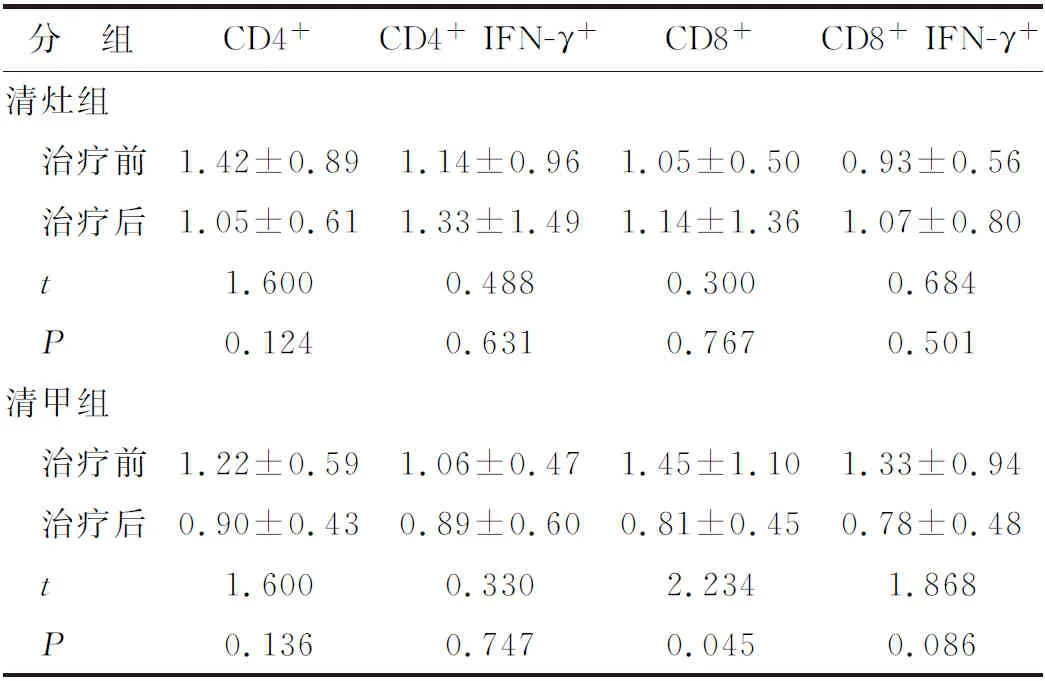
表2 清灶组淋巴亚群治疗前后比较
2.3131I治疗前后血清抗TC细胞蛋白抗体的变化
2.3.1131I治疗诱导的特异性抗体滴度回归分析 将性别、年龄、131I等进行二元Logistic回归分析,以抗体滴度为因变量。在滴度为1∶80 000时,治疗后OD值/治疗前OD值≥1.2为阳性。年龄赋值根据目前分期为标准进行划分。以抗体滴度为因变量(Y),以可能影响滴度的所有因素为自变量(X),包括性别、年龄和131I剂量。131I为滴度阴阳性的影响因素(P<0.05),即131I剂量越高,抗TC细胞蛋白抗体滴度呈现阳性的可能性越大。131I剂量每增加1 Bq,滴度阳性率增加1.018倍(95% CI:1.000~1.036,P<0.05)。
2.3.2 清灶组和清甲组131I治疗诱导的特异性抗体滴度阳性率 清灶组与清甲组均产生了抗TC细胞蛋白抗体,第一期结果显示,当抗TC细胞蛋白抗体最高滴度达1∶80 000,清灶组和清甲组的阳性率分别是64%和56%;第二期结果显示,当抗TC细胞蛋白抗体最高滴度1∶640 000,清灶组和清甲组的阳性率分别是38%和33%。2组在引起体液免疫反应上差别无统计学意义(χ2=0.546,P>0.05,表3)。
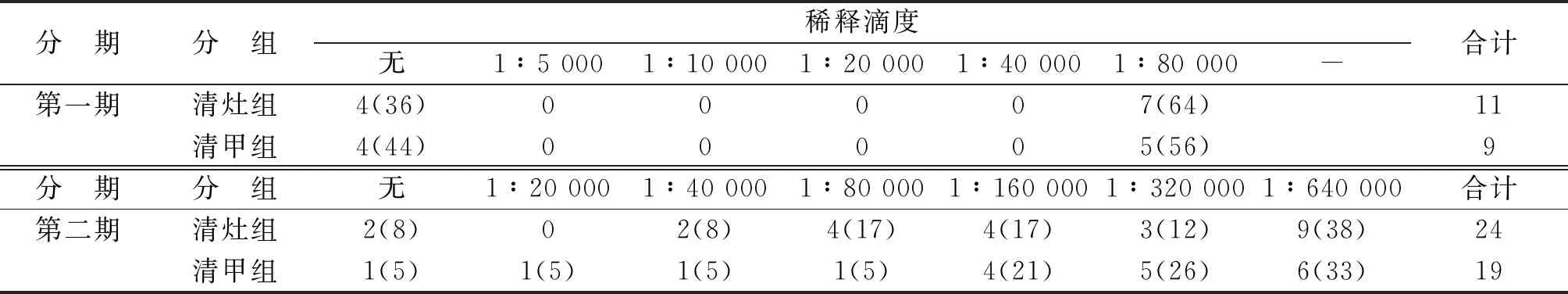
表3 清灶组和清甲组抗甲状腺癌细胞蛋白抗体滴度的变化
3 讨 论
过去报道的淋巴细胞转化实验多为非特异性,即使用刀豆素(concanamycin,ConA)、植物血凝素(phytohaemagglutinin,PHA)作为免疫刺激原[3-4],仍无法用于探讨131I治疗后特异性抗TC细胞免疫的改变。本研究采用的抗肿瘤细胞免疫的创新检测方法[5],能够动态监测TC131I治疗后特异性抗TC的细胞免疫及体液免疫的变化。
免疫治疗包括主动免疫治疗和被动/过继免疫治疗。癌症被动/过继免疫治疗的障碍之一是免疫激活不足,免疫效应物质消失后,疗效大多不能持久维持[6]。主动免疫反应主要是利用肿瘤细胞的免疫原性,采用各种有效的免疫手段使宿主免疫系统产生特异性针对肿瘤的主动免疫效应[7],在体内诱导机体的免疫反应,直接杀灭肿瘤。研究发现,外照射(常规放射,立体定向放射治疗)和内照射(射频消融,90钇放射性栓塞)均可通过不同的特性引起肿瘤细胞免疫原性死亡,引起“疫苗效应”,增强免疫反应[8-10],尤其是90钇放射性栓塞,可通过释放β射线杀伤肿瘤细胞,引发主动免疫效应,与131I的治疗原理一致。
机体发挥抗肿瘤的效应是由于肿瘤抗原被抗原提呈细胞摄取,提呈给淋巴细胞,使之活化、增殖,进而活化为CD4+IFN-γ+或CD8+IFN-γ+的T淋巴细胞亚群,从而发挥抗肿瘤主动免疫效应。本研究发现,DTC患者131I治疗后,淋巴细胞转化升高,且发挥抗肿瘤作用的CD8+T细胞在清灶组和清甲组间呈现不同的趋势,清灶组CD8+T细胞呈上升趋势,清甲组则为下降趋势,并且清灶组的CD8+IFN-γ+T淋巴细胞升高例数的比率高于清甲组(56%vs8%,P<0.05),说明清灶组在131I治疗后能够较好地诱导活化的CD8+T细胞,从而更好地杀灭甲状腺癌细胞,这与文献报道一致[11],认为放疗前后CD8+T细胞升高与放疗的疗效呈正相关,CD8+T细胞可侧面反映机体抗肿瘤的情况。本研究发现,131I治疗后清灶组和清甲组的CD4+T细胞均未升高,原因可能是CD4+T淋巴细胞(即Th1、Th2和Th17细胞,Treg细胞和T滤泡辅助细胞)的每个子集发挥不同的对抗肿瘤免疫力的效应。可见T淋巴细胞亚群可能在一定程度上反映131I治疗后肿瘤细胞死亡产生的“原位瘤苗”的量对细胞免疫的刺激强度及改变程度。笔者认为,131I治疗与放疗类似,不仅是因为辐射产生抗肿瘤效应,还因为激活了机体的抗肿瘤免疫效应。
131I治疗产生的“原位疫苗”不仅能够诱导细胞免疫反应,而且能够诱导体液免疫反应。Fallahi等[12]提出,年龄、性别、组织学类型等因素对131I的治疗疗效无显著影响。本研究结果显示,年龄、性别不影响抗TC细胞蛋白的抗体滴度。而131I剂量越高,抗TC细胞蛋白抗体滴度的阳性率可能越高。本研究中,清灶组患者多伴有甲状腺外转移灶,肿瘤病灶越大,131I剂量越大,经131I治疗后释放的肿瘤抗原越多,出现效应的时间更快,升高的幅度更高,效应持续的时间也更长。这与文献有相似之处,文献认为,高剂量组131I治疗TC的成功率高于低剂量组,表明131I的治疗可通过在适当范围内施加较高剂量来实现更高的成功率[12]。
本研究还发现,清灶组和清甲组在131I诱导的体液免疫反应的差别不大,原因可能是:(1)样本量不够导致统计学无差异,(2)从免疫学角度看,0.5 mg的蛋白抗原即可诱发免疫反应,但清甲组可能存在影像学(SPECT/CT、彩超等)未发现的少量TC细胞,故能够激发与清灶组(CT上显示病灶至少需要1 g组织,即109个细胞)相似的抗体产生反应,(3)机体是个复杂的体系,虽然射线能够刺激机体的免疫反应,但是由于辐射对免疫细胞也有一定的杀伤作用,对肿瘤微环境也有抑制作用,故未呈现明显的免疫反应[13]。
本研究尚存在局限:研究时间短,未采集多个时相的标本,无法分析131I治疗后机体完整的免疫应答过程;收集的病例数不多。但沿着本研究开创的方向继续深入探讨131I治疗后的免疫改变,将有助于揭示内照射与免疫抗癌的规律,为将来研究碘难治性TC患者的免疫治疗提供理论基础。
