斑地锦黄烷酮-3-羟化酶基因及启动子的克隆与分析
2021-11-09钟小菊吴晴阳张永康饶泽昌黄胜和
钟小菊,吴晴阳,张永康,饶泽昌,王 飞,黄胜和*
(1 江西中医药高等专科学校 医学基础部,江西抚州 344000;2 南昌大学 抚州医学院,江西抚州 344000)
斑地锦(EuphorbiamaculataL.)是一年生大戟科(Euphorbiaceae)大戟属(EuphorbiaL.)草本植物,分布于江西、新疆、河南和浙江等地区[1],具有清热解毒、利湿退黄、凉血止血等功效,主治痢疾、泄泻、尿血、便血、疮疖痈肿、湿热黄疸等[2]。斑地锦主要含有黄酮类、萜类、酚酸类和生物碱类等成分,其中槲皮素是主要药效成分之一[3]。目前,斑地锦研究主要集中在成分分离、药用价值以及临床应用等方面[4-5],分子生物学相关研究报道较少。
槲皮素属于黄酮类化合物,其生物合成经由苯丙烷代谢途径,而黄烷酮-3-羟化酶(flavanone 3-hydroxylase,F3H)是苯丙烷代谢途径的关键酶之一,催化柚皮素(naringenin)生成二氢山奈酚(dihydrokaempfero,DHK)。DHK是合成黄酮醇和花青素的重要中间物质,阻断F3H基因的表达,可导致拟南芥植株体内黄酮及花色素等含量变低[6]。目前,F3H基因已在金鱼草(AntirrhinummajusL.)[7]、丹参(Salviamiltiorrhiza)[8]和白芨(Bletillastriata)[9]等多种植物[10]中被克隆,但斑地锦F3H基因克隆还未见报道。该实验根据已知的植物F3H基因进行序列比对,在高度保守区设计简并引物,PCR法结合RACE技术、热不对称PCR(Tail-PCR)[11]克隆斑地锦F3H基因及其启动子,利用qRT-PCR技术检测在苗期、花期和果期不同组织中的表达情况,为进一步研究斑地锦F3H基因表达调控和完善斑地锦槲皮素生物合成途径提供便利条件。
1 材料和方法
1.1 实验材料
实验植株采集于江西中医药高等专科学校实验田,经江西中医药高等专科学校药学系中药教研室鉴定为斑地锦(EuphorbiamaculataL.)。分别采集苗期(未开花)、花期(开3朵以上的花且未结果)和果期(结3个以上的果)等的根、茎、叶以及果期的果实,样品采集后立即置-80 ℃冰箱备用。
1.2 主要试剂与仪器
植物总RNA提取试剂盒(Spin Column Plant Total RNA Purification Kit)、基因组DNA抽提试剂盒(Spin Column Plant Genomic DNA Purification Kit)、质粒DNA小量抽提试剂盒(SanPrep柱式)、胶回收试剂盒(SanPrep Column DNA Gel Extraction Kit)、引物合成、测序等,生工生物工程(上海)股份有限公司;反转录试剂盒(PrimeScript RT Reagent Kit with gDNA Eraser)、荧光定量PCR试剂盒(PrimeScript RT Master Mix)等,宝日医生物技术(北京)有限公司;Pfu酶(TransStart FastPfu DNA Polymerase)、Taq酶、Marker(Trans2K®Plus Ⅱ DNA Marker)、T-载体(pEASY-Blunt Simple Cloning Kit)等,北京全式金生物技术有限公司。该实验所用引物见表1。
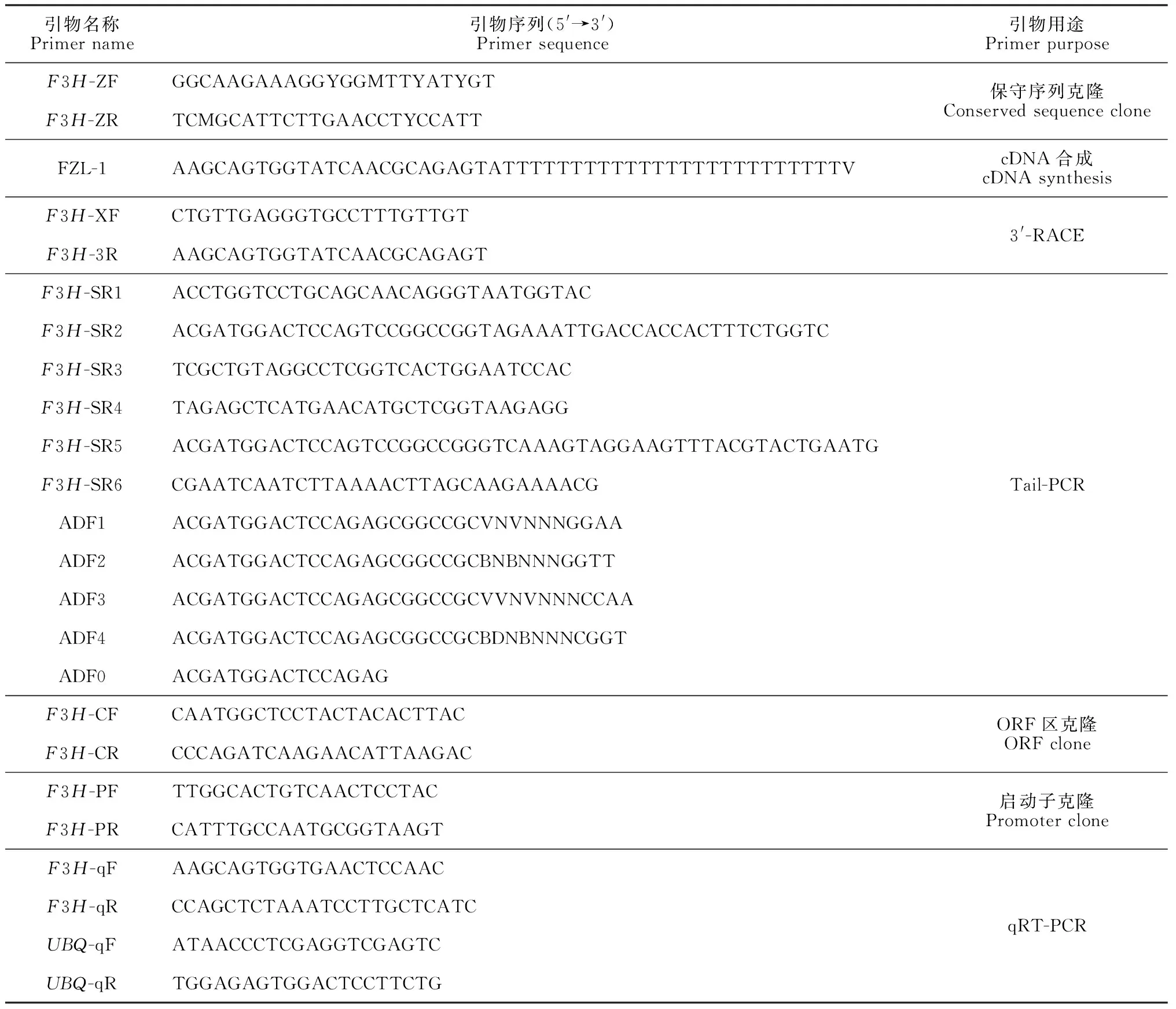
表1 实验所使用的引物
普通PCR仪(S1000TMThermal Cycler)、荧光定量PCR仪(CFX96 Real-Time)等,美国Bio-Rad公司;超微量分光光度计(NanoDrop One),美国Thermo Scientific公司。
1.3 实验方法
1.3.1 总RNA提取、cDNA合成和DNA的提取斑地锦总RNA提取、DNA提取和cDNA合成均按试剂盒说明书进行。总RNA提取后经1%琼脂糖凝胶电泳检测RNA质量,超微量分光光度计测定RNA浓度。
1.3.2F3H基因片段的获得在GenBank中查找麻风树(JatrophacurcasL.)、非洲菊(GerberajamesoniiBolus)和乌桕(Triadicasebifera)等植物的F3H基因序列,比对找出高度保守区,Primer Premier5.0软件设计简并引物F3H-ZF和F3H-ZR,以引物FZL-1对总RNA反转录得到的cDNA为模板,PCR扩增斑地锦F3H基因保守序列。反应体系(25 μL):5×GC缓冲液5 μL,dNTPs 2 μL,F3H-ZF、F3H-ZR各2 μL,cDNA模板2 μL,Pfu酶0.3 μL,灭菌超纯水11.7 μL。反应程序:94 ℃ 5 min;94 ℃ 30 s,50 ℃ 30 s,72 ℃ 40 s,35个循环;72 ℃ 5 min。PCR产物电泳后胶回收试剂盒回收,连T-载体,转化大肠杆菌DH5α感受态,菌液PCR筛选阳性后送测序。
1.3.3F3H基因ORF区的获得根据保守序列测序结果设计正向特异引物F3H-XF,根据反转录引物FZL-1设计反向引物F3H-3R,进行3′-RACE。反应体系(25 μL):5×GC缓冲液5 μL,dNTPs 2 μL,F3H-XF、F3H-3R各1 μL,cDNA模板1 μL,Pfu酶0.3 μL,灭菌超纯水14.7 μL。反应程序:94 ℃ 5 min;94 ℃ 30 s,55 ℃ 30 s,72 ℃ 1 min,30个循环;72 ℃ 5 min。PCR产物电泳后胶回收测序。
根据保守序列测序结果设计特异引物F3H-
SR1、F3H-SR2、F3H-SR3,与随机引物ADF1/ADF2/ADF3/ADF4,以及引物ADF0进行Tail-PCR扩增F3H基因5′端。Tail-PCR第一轮PCR,反应体系(25 μL):10×缓冲液2.5 μL,dNTPs 2 μL,ADF1(/ADF2/ADF3/ADF4)2 μL,F3H-SR1 1 μL,基因组DNA模板1 μL,Taq酶0.3 μL,灭菌超纯水16.2 μL。第二轮PCR反应体系(25 μL):10×缓冲液2.5 μL,dNTPs 2 μL,ADF0、F3H-SR2各1 μL,稀释100倍的第一轮PCR产物1 μL,Taq酶0.3 μL,灭菌超纯水17.2 μL。第三轮PCR反应体系(25 μL):10×缓冲液2.5 μL,dNTPs 2 μL,ADF0、F3H-SR3各1 μL,稀释100倍的第二轮PCR产物1 μL,Taq酶0.3 μL,灭菌超纯水17.2 μL。Tail-PCR反应程序见文献[11]。根据第二轮和第三轮PCR产物电泳结果选择长度合适的条带进行胶回收测序。
将所获得的F3H保守序列、5′端序列和3′端序列用DNAstar软件拼接,结合GenBank中的blast结果,获得ORF区序列,设计特异引物F3H-CF、F3H-CR,用Pfu酶进行PCR扩增并送测序。
1.3.4 生物信息学分析F3H蛋白的理化性质预测采用ExPASy Proteomics Server提供的在线工具Protparam (https://web.expasy.org/protparam/),NCBI的 conserved domain database(https://www.ncbi.nlm.nih. gov/Structure/cdd/wrpsb.cgi)预测蛋白保守结构域。TMHMM 2.0(http://www.cbs.dtu.dk/services/TMHMM)进行跨膜结构域预测,Phyre2 (http://www.sbg.bio.ic.ac.uk/phyre2/html/page.cgi?id=index)进行结构域三维建模[12],NCBI中的Distance tree of results(https://blast.ncbi.nlm.nih.gov/Blast.cgi)进行系统进化树分析。
1.3.5F3H基因不同生长期组织表达差异分析根据F3H基因ORF区序列设计荧光定量PCR引物F3H-qF、F3H-qR,分别提取斑地锦苗期、花期和果期的根、茎、叶以及果实的总RNA,经琼脂糖凝胶电泳和超微量分光光度计检测后,反转录试剂盒合成cDNA,以UBQ为内参基因[13],进行荧光定量PCR扩增。反应体系(20 μL):2×TB Green Premix Ex Taq(TliRNaseH Plus)10 μL,上下游引物各0.4 μL,cDNA模板2 μL,灭菌水7.2 μL;扩增条件:95 ℃ 5 min;95 ℃ 30 s,53 ℃ 30 s,72 ℃ 30 s,40个循环;每个反应体系重复3次。利用Excel分析处理实验结果。
1.3.6F3H基因启动子序列的获得与分析根据5′端序列设计特异引物F3H-SR4、F3H-SR5、F3H-SR6,以基因组DNA为模板,采用Tail-PCR进行染色体步移,扩增EmF3H基因的启动子,反应体系和反应程序与1.3.3相同。根据Tail-PCR产物测序结果设计特异引物F3H-PF、F3H-PR,用Pfu酶进行PCR扩增并送测序。序列分别用Plantcare(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)和PLACE(https://www.dna.affrc.go.jp/PLACE/?action=newplace)分析序列特征。
2 结果与分析
2.1 斑地锦F3H基因的克隆
试剂盒提取斑地锦总RNA,琼脂糖凝胶电泳检测质量良好(图1)。由图1可知,同源克隆法设计简并引物F3H-ZF和F3H-ZR,PCR获得预期510 bp左右的斑地锦F3H基因保守序列,3′-RACE法得到约530 bp的3′端序列;Tail-PCR进行染色体步移,第三轮产物比第二轮产物小120 bp左右,将第三轮产物测序获得保守序列上游约2 000 bp,其中包含基因5′端序列;将保守序列、3′端序列、5′端序列用DNASTAR软件进行组装,根据组装结果设计特异引物F3H-CF和F3H-CR扩增ORF区。测序结果显示,斑地锦F3H基因ORF区包含1 092 bp,编码364个氨基酸,其中氨基酸序列与油桐(Verniciafordii)、乌桕(Triadicasebifera)的序列相似性高达85.5%、85.4%。将此基因命名为EmF3H, GenBank登录号为MW767838。
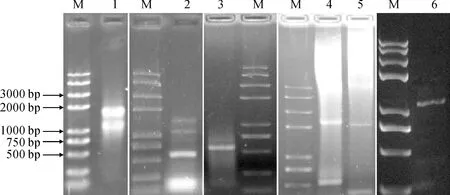
M. Trans2K® Plus Ⅱ;1.总RNA;2.保守序列;3.3′-RACE;4-5.5′-Tail第二、三轮产物;6.ORF 图1 EmF3H基因的克隆M. Trans2K® Plus Ⅱ; 1. Total RNA; 2. Conserved sequence; 3. 3′-RACE; 4-5. The second and third round products of 5′-Tail-PCR; 6. ORFFig.1 Cloning of EmF3H
2.2 EmF3H的生物信息学分析
用在线工具Protparam分析斑地锦F3H蛋白的理化性质,等电点(pI)为5.47,相对分子质量为40.93 KDa,不稳定系数47.89,脂肪指数为86.54,平均亲水性为-0.371,表明EmF3H为相对稳定的疏水性蛋白。保守结构域预测显示该蛋白属于2-酮戊二酸铁依赖的双加氧酶(2-oxoglutarate/iron-dependent dioxygenase,2-ODD)超家族,与其他植物F3H的保守结构域相似。TMHMM 2.0预测EmF3H不含跨膜区域。Phyre三维建模结果见图2,以克拉维胺合成酶(Clavaminate synthase,PDB ID:d1gp6a)的晶体三维结构为模板建模,三维模型覆盖率为91%,序列的一致性为31%。利用NCBI在线BLAST工具将F3H 与GenBank 中其他植物F3H蛋白进行比对,选择相似性最高的17种F3H蛋白,用Distance tree of results中的Neighbor Joining法构建系统进化树(图3),不同物种来源的F3H蛋白在进化上归属不同的分支,类似于蔓花生、大花悬铃果的F3H,EmF3H也为相对独立的一个分支。
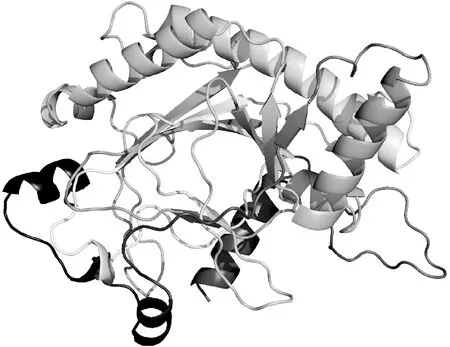
图2 EmF3H蛋白三维结构预测Fig.2 The deduced three-dimensional structure of EmF3H
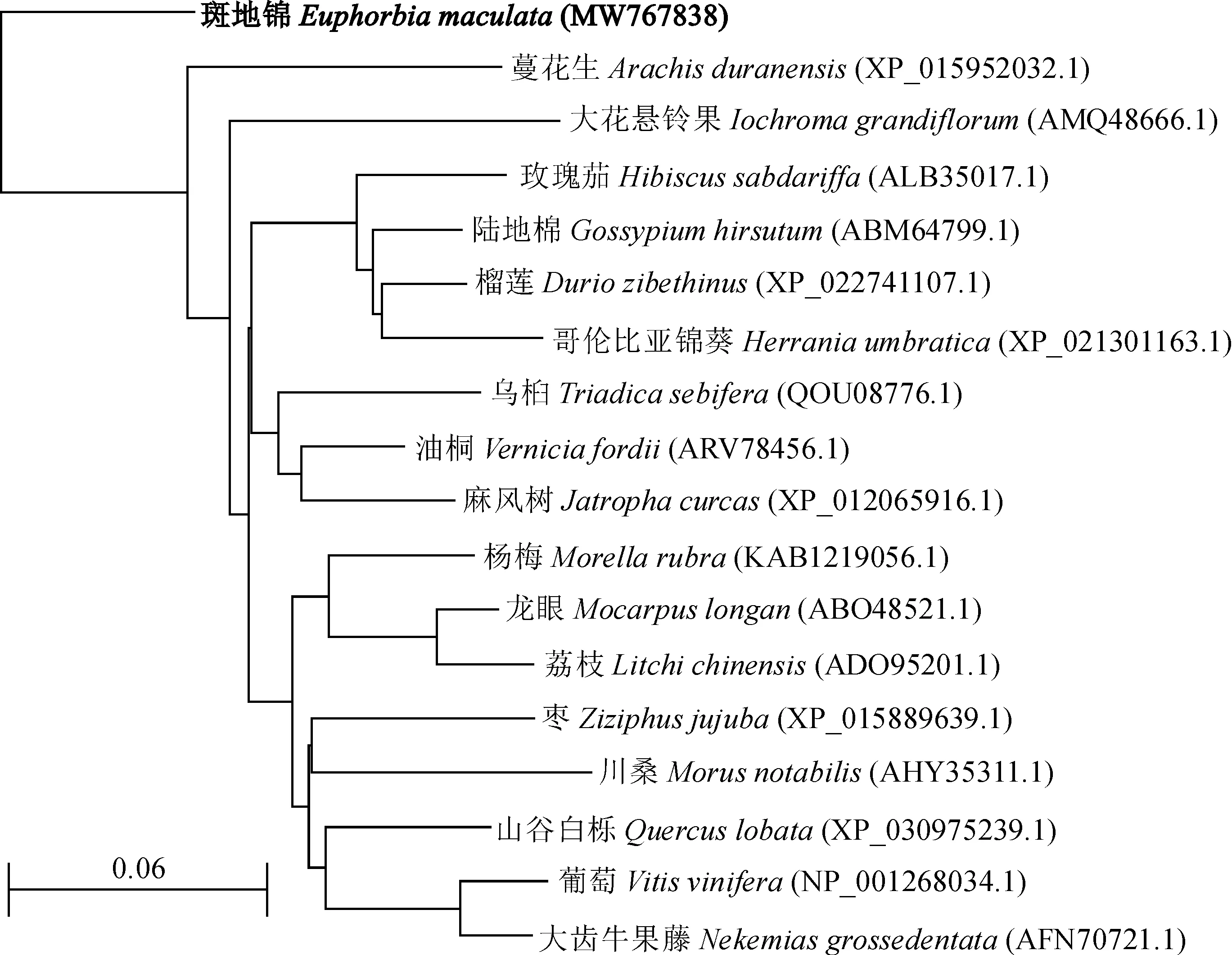
图3 EmF3H和其他F3H蛋白的系统进化树Fig.3 Phylogenetic tree analysis of EmF3H protein and other plant F3H proteins
2.3 EmF3H基因在不同生长期组织表达模式
分别提取斑地锦不同生长期(苗期、花期、果期)根、茎、叶、果的总RNA,以UBQ为内参基因,进行qRT-PCR扩增。结果显示,EmF3H在不同生长期各组织中均有表达,但表达量有显著差异,其中花期的根和果期的果实中表达量最高,其次为苗期的根和果期的根、茎,在各生长期的叶、苗期的茎和花期的茎内表达水平较低(图4)。另外,在茎中随生长期表达有不断增强的趋势,在根内表达量先上调后下降。
2.4 EmF3H基因启动子序列的获得与分析
以斑地锦基因组DNA为模板,Tail-PCR法进行染色体步移(图5),将第三轮约2 000 bp的PCR产物胶回收后连接T-载体测序。根据测序结果设计特异引物F3H-PF、F3H-PR,Pfu酶进行PCR扩增并送测序,结果获得约1 604 bp的EmF3H启动子序列,用Plantcare和PLACE分析显示内含TATA-box、CAAT-box等基本启动子序列,也含有Box 4(ATTAAT)、G-Box(CACGTG)、GATA-motif(AAGATAAGATT)、AE-box(AGAAACAA)、I-box(TGATAATGT)、TCT-motif(TCTTAC)等光反应元件,LTR(CCGAAA)低温反应元件,TC-rich repeats(GTTTTCTTAC)应激反应元件,circadian(CAAAGATATC)昼夜节律调控元件和ABRE(ABA反应元件)、P-box(GAs反应元件)、TGA-element(生长素反应元件)等激素反应元件。
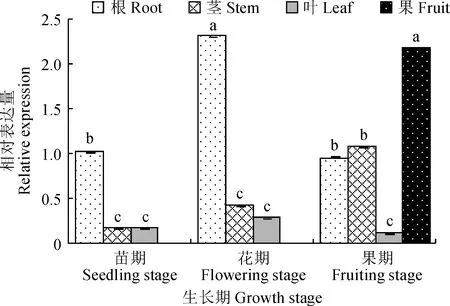
不同小写字母表示差异显著(P<0.05)图4 不同生长期不同组织中EmF3H的相对表达量Different normal letters indicate significant difference at 0.05 level (P<0.05)Fig.4 The relative expression levels of EmF3H from different tissues in different growth stages
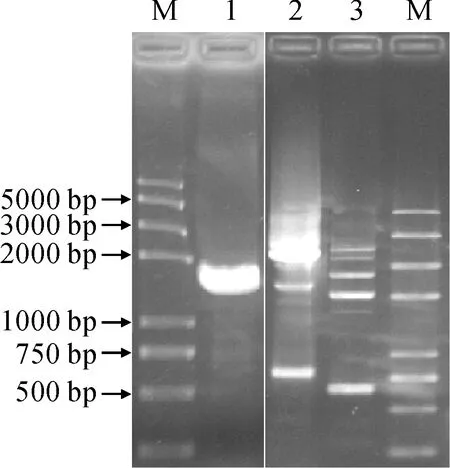
M. Trans2K® Plus Ⅱ;1.启动子;2-3.Tail-PCR第二、三轮产物图5 EmF3H基因启动子的克隆M. Trans2K® Plus Ⅱ; 1. EmF3H promoter; 2-3. The second and third rounds products of Tail-PCRFig.5 Cloning of EmF3H promoter
3 讨 论
苯丙烷代谢途径是植物重要的次生代谢途径之一,该途径以苯丙氨酸为底物,先后在苯丙氨酸解氨酶(PAL)、肉桂酸-4-羟化酶(C4H)、4-香豆酰-CoA连接酶(4CL)、查尔酮合成酶(CHS)、查尔酮异构酶(CHI)、黄烷酮-3-羟化酶(F3H)、类黄酮-3′-羟化酶(F3′H)、黄酮醇合成酶(FLS)等一系列酶的催化作用下,合成黄酮类、木质素及花青素等多种次生代谢产物[14-15],而F3H是其中的关键酶之一,催化柚皮素生成二氢山奈酚。F3H的克隆与功能研究已有一些报道[7-10],烟草中超表达枸杞LcF3H提高了黄烷-3-醇的含量和对干旱胁迫的耐受性[16];转基因高粱胚轴中,SbF3H将部分碳流转移到了3-羟基黄酮的生产上[17]。
该研究从斑地锦中克隆了一个F3H基因编码区及其启动子。蛋白质EmF3H与油桐VfF3H、乌桕TsF3H的序列相似性分别为85.5%、85.4%,初步证明EmF3H属于F3H基因家族,氨基酸序列聚类分析结果表明其为相对独立的一个分支,说明EmF3H在进化上有明显的种属特性。研究表明F3H基因在不同植物不同生长期和不同组织中表达水平有差异,柠条锦鸡儿CkF3H在根、茎和叶中均有表达,没有组织特异性[18],而茶菊CmF3H在花中表达量最高,其次为茎、叶,根中表达量最低[10];EmF3H在花期的根和果期的果实中表达量最高,随着植物的生长,表达量在茎中逐渐上升,在叶内一直较低,说明该基因表达在斑地锦中存在组织特异性,同时预示着F3H可能参与多种物质的生物合成,且在不同植物中功能侧重点不同,其具体功能有待于进一步挖掘。在EmF3H启动子序列内预测有TAAT-box等基本启动子序列和光反应元件、应激反应元件、激素反应元件等,表明EmF3H可能参与胁迫应答,但是否能够响应不同胁迫,进而影响槲皮素等黄酮类化合物的合成,还需进一步研究基因表达调控。因此,该研究结果丰富了F3H基因资源,也对探讨斑地锦苯丙烷类次生代谢途径(包括黄酮类化合物生物合成途径)奠定了一定的基础。
