葡萄NIP基因家族的鉴定与表达分析
2021-11-09卢世雄任家玄马宗桓
吴 宙 ,卢世雄,任家玄,马宗桓,毛 娟
(甘肃农业大学 园艺学院,兰州 730070)
水通道蛋白AQP(aquaporin protein,AQP)是位于质膜和液泡膜上参与运输水分及一些小分子物质的主要内在蛋白,属于古老的通道蛋白MIP(major intrinsic protein,MIP)超家族[1-3]。广泛存在于动物和微生物之中,主要参与介导不同类型细胞水分的跨膜运输、维持水分平衡、逆境调控等多种生长发育过程[4-5]。根据其序列相似性,主要可分为4类:质膜内在蛋白(plasma membrane intrinsic proteins,PIPs)、液泡膜内在蛋白(tonoplast intrinsic proteins,TIPs)、类根瘤菌26膜内在蛋白(nodulin 26-like intrinsic proteins,NIPs)和小分子膜内在蛋白(small basic intrinsic proteins,SIPs),不同亚类生物学功能存在较大差异[6-7]。
NIP家族成员Nod26是植物中第一个被发现的水通道蛋白,定位于大豆与根瘤菌的共生体膜上,NIP蛋白也存在于非豆科植物的质膜或内质网中[8-10]。结构上,NIP蛋白具有高度保守的结构序列,6个跨膜结构域TM1-TM6(transmembrane,TM)由5个亲水环连接,第二个和第五个环含有一段由3个氨基酸组成的高度保守序列NPA(天门冬酰胺-脯氨酸-丙氨酸,Asn-Pro-Ala),两个NPA序列间形成狭窄的水通道,其大小决定底物与蛋白的特异性识别并直接参与水通道的形成[11-13]。在NPA序列外侧存在芳香族氨基酸/精氨酸(aromatic/arginine,ar/R)选择性过滤结构,决定运输底物的特异性[14-16]。另外,NIP蛋白不仅参与尿素、甘油等小分子物质的运输,还对硼、砷、硅等非金属元素具有渗透性,除Nod26蛋白外,大部分NIP对水的通透性较差或不透过水[17-18]。其中,拟南芥(Arabidopsisthaliana)AtNIP5;1和AtNIP6;1具有转运硼酸的作用[19-20];水稻(Oryzasativa)OsNIP2;1[21]、OsNIP2;3[22]以及玉米(Zeamays)ZmNIP2;1、ZmNIP2;1具有转运硅元素的作用[23];拟南芥AtNIP1;1和水稻OsNIP1;1都能转运砷[24-25]。此外,干旱、高盐、低温等非生物胁迫均可调控NIP基因的表达,从而增强对逆境的耐受力。例如,水稻OsNIP2;1在干旱胁迫下和ABA诱导下表达下调,但在盐胁迫下表现为上调[26-27]。另外,过表达的AtNIP1;2能够提高拟南芥植株对铝胁迫的耐受力[28],拟南芥AtNIP3;1可提高植株对砷胁迫的耐受力[29]。
葡萄(VitisviniferaL.)是世界四大水果之一,也是中国重要的落叶果树之一,具有较高的经济价值,但是逆境胁迫会对葡萄品质提升和种质范围的拓展造成很大的影响[30]。近年来,有关水通道蛋白与抗逆性的关系在拟南芥、烟草(Nicotianatabacum)、玉米以及苹果(Malusdomestica)和葡萄等木本植物上都有报道,但这些研究往往只侧重于某几个或某一类家族成员[31-32]。不同的品种或物种应对逆境的方式有差异,不同水通道蛋白成员在植株水分吸收中的调节作用也不尽相同。因此,有必要从整个基因家族层面,研究葡萄NIP基因对环境胁迫的响应机理并对其进行生物信息学分析,为进一步探索该亚类基因成员的功能及抗逆分子改良提供参考。
1 材料和方法
1.1 试验材料与处理
供试葡萄品种为‘黑比诺’(Vitisvinifera‘Pinot Noir’)试管苗。配制培养基(MS+0.2 mg·L-1IAA),pH5.8~6.0,接种实验材料的单芽茎段部分;培养条件为:25 ℃,16 h光照,20 ℃,8 h黑暗培养35 d。然后转入10% PEG、200 mmol·L-1NaCl的MS培养基,同时在培养箱中进行5 ℃下低温处理,每种处理设置3组重复,对照为等体积蒸馏水处理,对照与处理时长均为24 h。采集经过处理的葡萄试管苗叶片随后混匀、称量并置于液氮中速冻,然后放入-80 ℃冰箱中保存。RNA提取采用植物提取试剂盒(中科瑞泰)。
1.2 试验方法
1.2.1 葡萄NIP家族成员的鉴定及序列分析以拟南芥NIP蛋白的氨基酸序列为参考序列,在葡萄基因组数据库(http://www.genoscope.cns.fr/)中同源比对获得葡萄NIP家族成员的候选序列,在Pfam(https://pfam.xfam.org/)中进行结构域比对,去除不含NIP家族成员特定结构域(PF00230)的序列片段,再根据系统发生树结果,参考其他植物水通道命名法对鉴定到的葡萄NIP家族成员进行命名。在葡萄基因组数据库下载基因全长、CDS序列、氨基酸序列。
利用ExPASy(https://www.expasy.org/)对葡萄NIP氨基酸序列进行等电点、分子量、氨基酸数目分析;使用TMHMM Server 2.0(https://www.cbs.dtu.dk/services/TMHMM/)预测跨膜结构数目;采用Cell-PLoc2.0(http://www.csbio.sjtu.edu.cn/bioinf/Cell-PLoc/)进行亚细胞定位预测;使用NetPhos 3.1 Server(http://www.cbs.dtu.dk/services/NetPhos/)预测家族成员磷酸位点数目。
利用GSDS(http://gsds.cbi.pku.edu.cn/)进行基因结构分析;采用MEME在线软件(http://meme-suite.org/tools/meme)对葡萄NIP家族成员氨基酸序列进行motif分析;利用DNAMAN进行蛋白多序列比对分析。
1.2.2 系统进化树、启动子顺式作用元件、蛋白互作网络分析根据葡萄NIP家族基因的氨基酸序列和从GenBank数据中下载获得的拟南芥和水稻NIP家族成员的氨基酸序列,使用MEGA7.0软件邻接法(neighbor-joining)构建NIP家族系统发育树,Bootstrap值设置为1 000。
下载葡萄NIP各基因启动子上游2 kb的序列,利用在线软件PlantCARE(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)统计分析各基因启动子区顺式作用元件的数量和种类。
使用STRING(https://string-db.org)网站对葡萄NIP成员蛋白的互作网络进行分析,选取模式植物拟南芥作为参考,最低交互评分选择high confidence(0.700)。
1.2.3 表达谱分析、荧光定量PCR分析和基因克隆从葡萄EFP数据库(http://bar.utoronto.ca/ efp_grape/cgi-bin/efpWeb.cgi)中收集葡萄NIP基因在11种组织和器官中的芯片表达数据,表达式数据进行log2转换,热图由TBtools软件制作。
在生工生物工程(上海)股份有限公司网站,将葡萄NIP家族基因的CDS序列进行在线引物设计,并将设计好的引物交由该公司合成(表1)。cDNA合成用Prime Script RT reagent Kit(Perfect Real Time)试剂盒(TaKaRa)。反转录产物cDNA在-20 ℃下保存备用。实时荧光定量PCR(qRT-PCR)用Light Cycler 96实时定量PCR仪,用设计的引物进行PCR扩增,以葡萄GAPDH基因为内参,进行特异性表达分析。扩增体系含20 μL,分别包含3 μL cDNA,上、下游引物各0.8 μL,SYBR MIX 10 μL,5.4 μL ddH2O;反应程序为:95 ℃ 30 s,95 ℃ 10 s,58 ℃ 30 s,72 ℃ 20 s,共40个循环,试验3次重复。采用2-ΔΔCT法对基因相对表达量进行计算,用Excel 2010处理数据,用SPSS 20.0对数据进行显著性分析,并用Origin 9.0绘图。
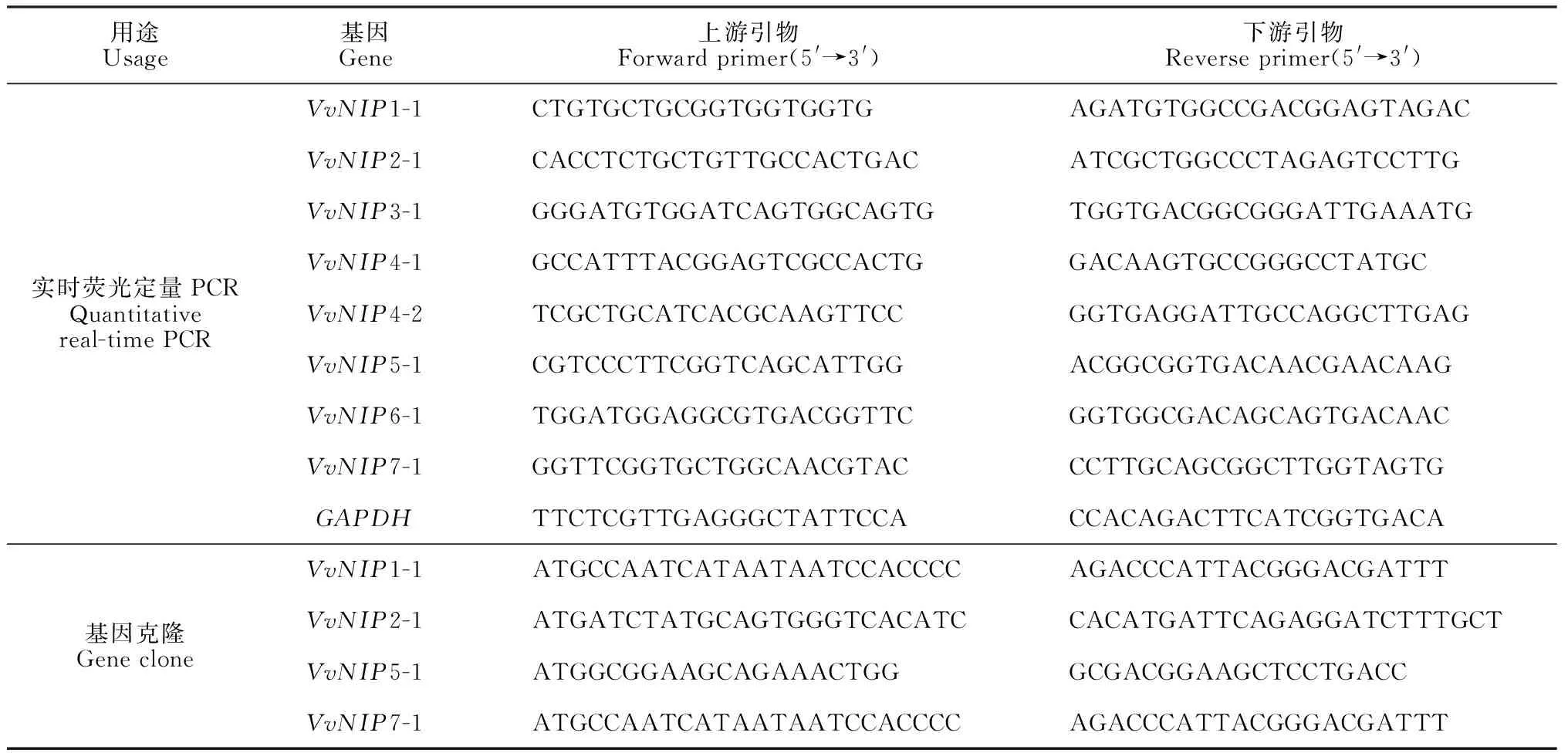
表1 葡萄NIP基因家族表达分析的实时荧光定量和克隆引物
根据葡萄基因组数据库下载的NIP基因CDS序列设计克隆引物,以‘黑比诺’葡萄叶片cDNA为模板进行PCR扩增,PCR反应体系(20μL):cDNA1.5 μL,上、下游引物各1 μL,ddH2O 6.5 μL,Green Taq Mix酶10 μL。PCR扩增程序设置为95 ℃预变性5 min,95 ℃变性30 s,58 ℃退火42 s,72 ℃延伸2 min,40个循环,最后72 ℃延伸10 min。将 PCR 产物切胶回收后送测序,根据测序结果验证目的基因序列的正确性。
2 结果与分析
2.1 葡萄NIP基因家族的鉴定及蛋白质基本理化性质的分析
通过同源比对共鉴定出8个葡萄NIP基因(表2),根据系统发生树结果,参考其他植物水通道命名法将葡萄8个NIP家族成员分别命名为VvNIP1-1、VvNIP2-1、VvNIP3-1、VvNIP4-1、VvNIP4-2、VvNIP5-1、VvNIP6-1、VvNIP7-1,其中葡萄2、5、10、14号染色体上各存在1个NIP基因。葡萄NIP家族蛋白的基本理化性质分析结果显示:绝大多数家族成员氨基酸数量在201~354之间,其成员氨基酸数量差异性不大;家族成员蛋白等电点在6.98~9.45之间,说明NIP家族蛋白大多编码碱性氨基酸。葡萄NIP家族基因主要集中在质膜中表达,其次VvNIP4-1、VvNIP4-2在液泡中也有表达,推测与其执行相关跨膜运输功能有关。另外,该家族蛋白含有4~6个跨膜结构域,符合水通道蛋白的典型跨膜结构。
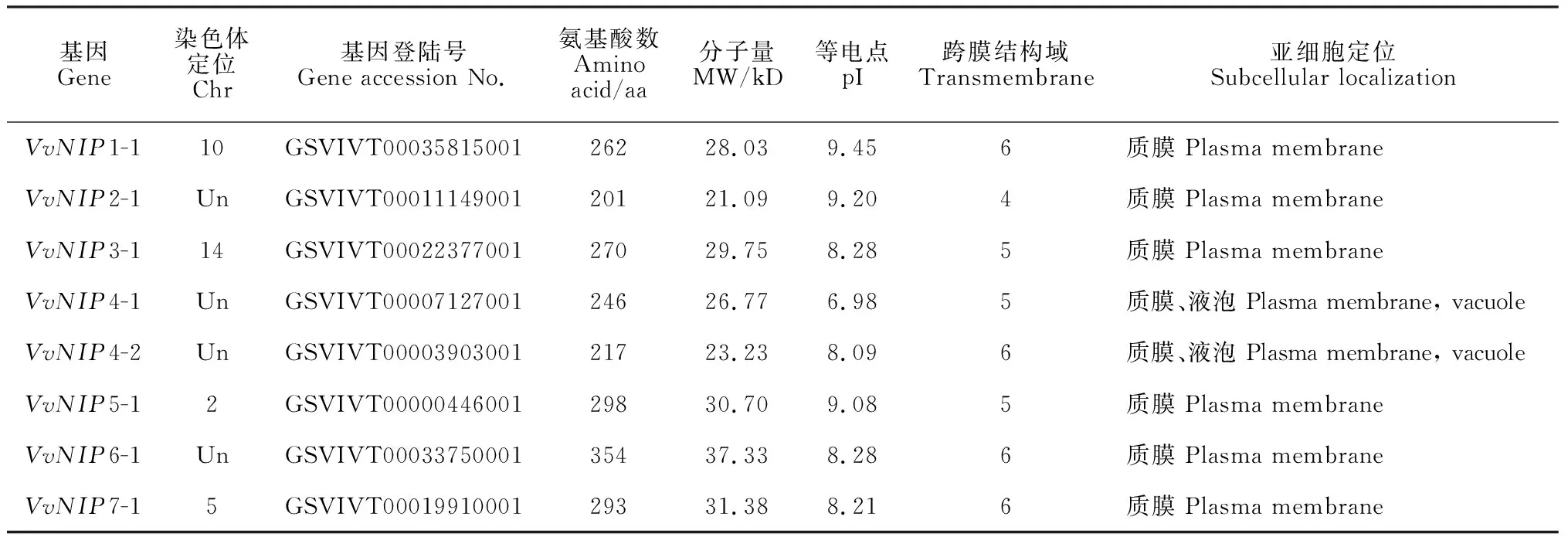
表2 葡萄NIP基因家族信息及理化性质
葡萄NIP蛋白磷酸化位点分析结果表明(表3),葡萄NIP蛋白的活性受磷酸化调控,氨基酸序列中存在很多个丝氨酸、苏氨酸和酪氨酸磷酸化位点,且以丝氨酸为主。其中,VvNIP6-1磷酸化位点最多,为39个,包括24个丝氨酸、14个苏氨酸和1个酪氨酸;VvNIP4-1和VvNIP4-2最少,有18个。蛋白质磷酸化可提高植物应对非生物胁迫的能力,因此推测NIP在植物细胞间传递胁迫信号并进行生理和分子水平适应机制中发挥重要作用。
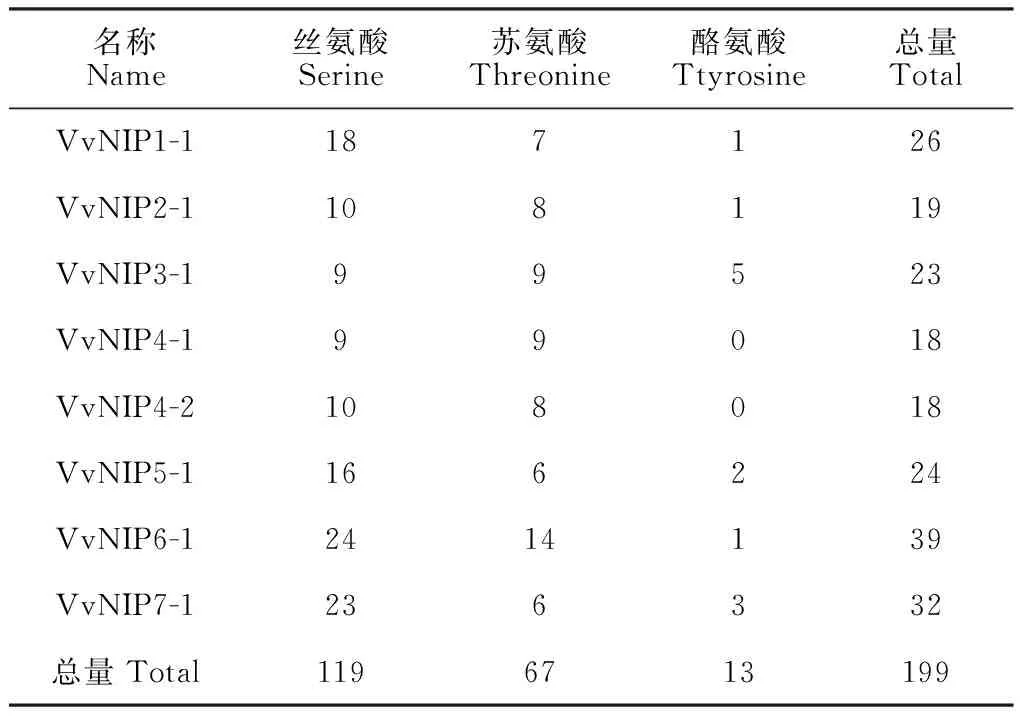
表3 葡萄NIP蛋白潜在磷酸化位点
2.2 基因结构及保守基序分析
葡萄NIP家族基因结构分析显示(图1):该家族基因含有外显子数为4~6个,除VvNIP1-1、VvNIP4-1基因含有4个内含子外,其余均含有3个内含子。另外,仅VvNIP7-1包含基因的上下游外,NIP家族成员序列内含子长度相似,外显子长度和位置差异明显,这可能会影响基因功能的差异。
利用MEME软件在线分析葡萄NIP家族基因保守特征结构域(图1),共找到6个motif,其中VvNIP1-1、VvNIP4-1、VvNIP4-2、VvNIP5-1、VvNIP6-1、VvNIP7-1所含氨基酸保守序列种类的数量均相同,具有高度的保守性,推测其功能基本相似。另外,VvNIP2-1、VvNIP3-1分别含有4个和3个motif,所有NIP家族成员均含有motif4。
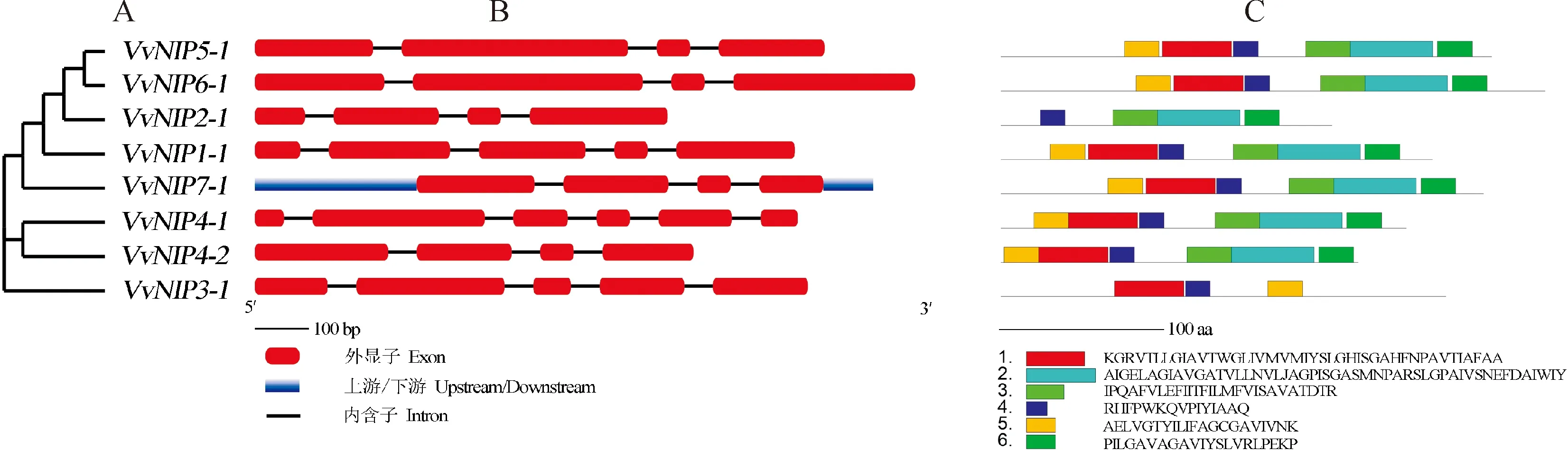
图1 葡萄NIP基因结构分析及保守基序分析Fig.1 Gene structure analysis and analysis of conserved motifs of grape NIP family
2.3 多序列比对及系统进化分析
为了更好地了解葡萄NIP的蛋白结构,对葡萄NIP蛋白进行多序列比对分析(图2)。结果显示,8个VvNIP结构域保守,其中有4个成员含有6个跨膜结构域(TM1-TM6)。除VvNIP3-1外它们都含有两个高度保守的氨基酸序列天冬酰胺-脯氨酸-丙氨酸(Asn-Pro-Ala,NPA),且两个NPA主要在第三个氨基酸易发生突变,其中VvNIP5-1、VvNIP6-1、VvNIP7-1中的NPA突变成NPS-NPV,但是由于缬氨酸(V)和丙氨酸(A)同为不带电荷的非极性氨基酸,所以NPV不会改变蛋白质的空间结构,而且其芳香族氨基酸/精氨酸所形成的ar/R选择过滤器对底物同样具有选择透过性。

红色框为NPA保守结构域;黑色线条为跨膜结构域图2 葡萄NIP蛋白结构域多序列比对分析The red boxes are the conserved domains of NPA;The black lines are the transmembrane domainsFig.2 Multiple sequence alignment analysis of domains in grape NIPs
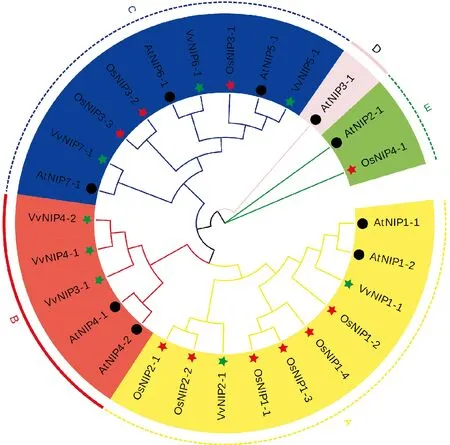
Vv. 葡萄;At. 拟南芥;Os. 水稻图3 葡萄和其他物种NIP系统进化分析Vv. Vitis vinifera;At. Arabidopsis thaliana;Os. Oryza sativaFig.3 Phylogenetic tree analysis of grape NIPs and other species
为了进一步了解葡萄NIP家族进化及功能特点,对葡萄、拟南芥、水稻NIP家族基因(AtNIP、VvNIP、OsNIP)构建系统发育树(图3),将其分为5个亚族(A-E)。其中,A亚族包括VvNIP1-1、VvNIP2-1和5个水稻以及2个拟南芥NIP家族基因;B亚族只含葡萄和拟南芥NIP家族基因(2个AtNIP、3个VvNIP);C亚族则包含3个物种的NIP基因(3个AtNIP、2个VvNIP、3个OsNIP);D亚族只含1个拟南芥基因AtNIP3-1;E亚族含有AtNIP3-1、OsNIP4-1两个基因。在各分支中,葡萄和拟南芥的NIP基因有较高的同源性,进化关系较近,初步表明其进化的保守性,推测直系同源基因之间具有相同的功能。
2.4 葡萄NIP基因启动子顺式作用元件分析
葡萄NIP基因家族成员顺式作用元件预测结果显示(表4):各个基因启动子中具有多种应答逆境和激素的顺式调控元件,且不同基因的种类和数量均存在较大的差异。8个NIP基因启动子区域均含有较多的与光感知应答有关的LR作用元件,说明这些成员可能分别在细胞周期调控或光敏色素表达中起到重要的作用。此外,63%的成员含有与干旱有关的MBS作用元件,50%的成员含有水杨酸TCA和脱落酸ABRE作用元件,37%的成员含有响应茉莉酸甲酯的作用元件和响应赤霉素应答的TATC-box作用元件。因此,葡萄NIP基因可能参与植物的逆境及激素胁迫应答过程。
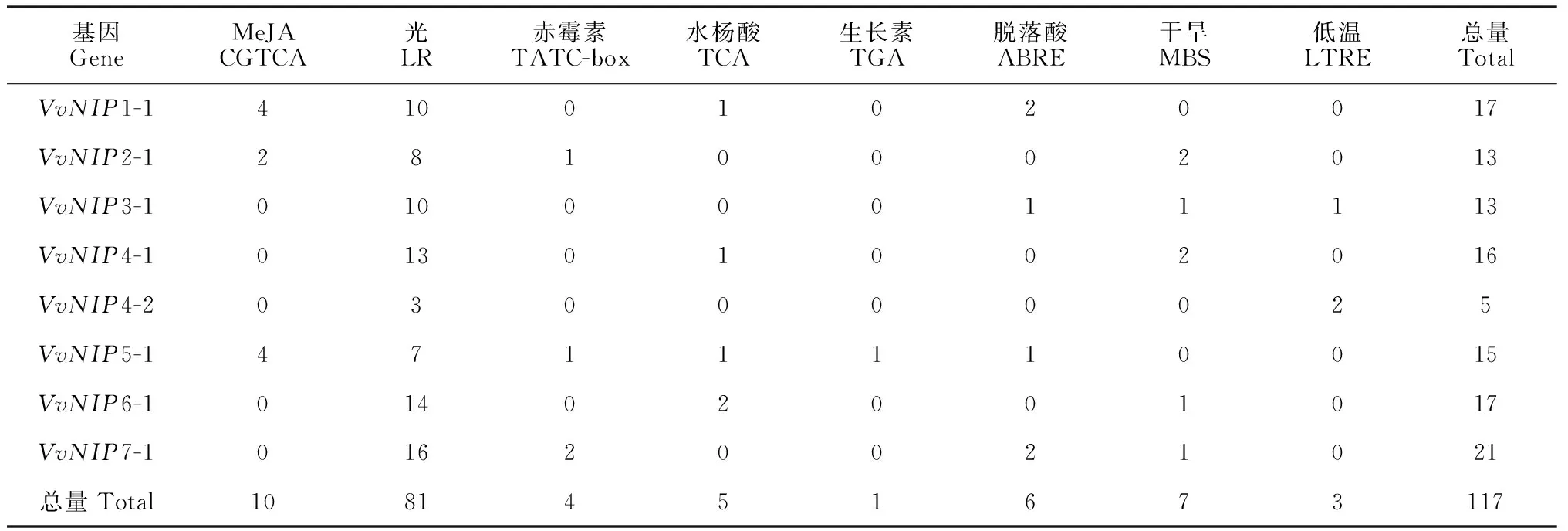
表4 葡萄NIP基因启动子顺式作用元件分析
2.5 葡萄NIP蛋白互作网络分析
葡萄NIP成员蛋白质互作预测结果表明,NIP家族成员间蛋白互作关联性较强,与其他AQP亚家族间有着广泛的互作关系,其中,与SIP亚族和PIP亚族成员联系尤为紧密。另外,PIP亚族成员还与受ABA上调转录的植物联合蛋白(SYP)有较强的互作关系。NIP亚家族部分成员还与硼转运蛋白(BOR)之间也存在着互作关系,推测其可能参与硼酸等物质的转运,硼酸是花粉管发育、受精等生殖生长中必不可少的微量元素(图4)。
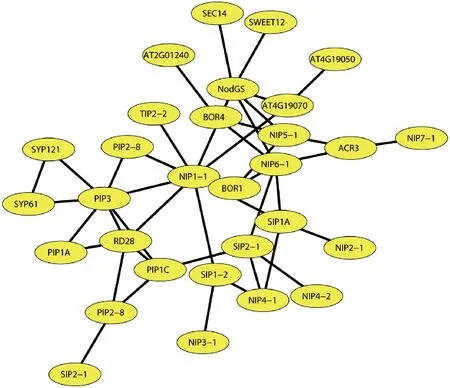
图4 葡萄NIP蛋白互作网络分析Fig.4 Grape NIP proteins interaction network analysis
2.6 葡萄NIP家族基因在不同组织中的表达分析
组织特异性表达分析发现(图5),8个VvNIP在不同组织或同一组织不同生长时期的表达量存在着一定的差异。VvNIP5-1在所有组织中表达量都很高,在盛花期和幼苗期表达量较高,分别为322.64和298.18,在衰老叶中表达量最低为17.18。VvNIP7-1在所有组织中表达量都相对较低,其中在萌芽初期和潜伏芽中的表达量最低,分别为1.84和1.93。VvNIP2-1表达量逐渐增加,在盛花期表达量最高达到485.42。随着叶的生长,VvNIP2-1的表达量下调,在幼叶中表达量最高达到249.24,随后下调至14.39,而VvNIP4-1、VvNIP6-1、VvNIP7-1表达上调。在衰老叶中,VvNIP1-1的表达量最高为135.91。在叶中多数基因在生长前期的表达量显著高于生长后期。

图5 葡萄NIP基因表达分析Fig.5 Expression profiles of grape NIP family
2.7 葡萄NIP家族基因荧光定量分析及基因全长克隆
为了进一步研究葡萄NIP家族基因对非生物胁迫的响应,本研究对葡萄分别进行了盐、干旱和低温胁迫处理,结果发现8个NIP家族基因成员在3种胁迫下均有基因响应,且各处理间相对表达量存在着显著差异(图6)。200 mmol·L-1NaCl处理下,VvNIP2-1、VvNIP4-2呈上调表达,分别为对照的5.1倍、2.7倍;VvNIP1-1、VvNIP3-1、VvNIP4-1、VvNIP5-1、VvNIP6-1、VvNIP7-1呈下调表达。10% PEG诱导后,VvNIP4-2表达量显著上调,为对照的4.7倍,VvNIP2-1上调为对照的1.4倍,VvNIP1-1、VvNIP3-1、VvNIP4-1、VvNIP5-1、VvNIP6-1、VvNIP7-1呈下调表达。5 ℃诱导后,VvNIP1-1、VvNIP2-1、VvNIP3-1、VvNIP4-1、VvNIP5-1、VvNIP6-1、VvNIP7-1显著下调,推测该基因家族可能受到低温胁迫抑制。

不同小写字母表示同一处理下不同基因间的表达差异(P < 0.05)图6 葡萄NIP基因在不同处理下的表达分析Different normal letters indicate the expression differences between different genes under the same treatment at 0.05 levelFig.6 Expression of grape NIP gene family under different treatments
以‘黑比诺’葡萄叶片cDNA为模板,利用设计好的4对PCR引物进行VvNIP1-1、VvNIP2-1、VvNIP5-1、VvNIP7-1的扩增,分别获得长度为789、606、897、789 bp的片段(图7),大小均与预期目的条带一致。纯化回收目的条带,测序结果显示成功克隆葡萄VvNIP4-1、VvNIP5-1、VvNIP6-1、VvNIP7-1基因,且分别编码262、201、298、293个氨基酸。
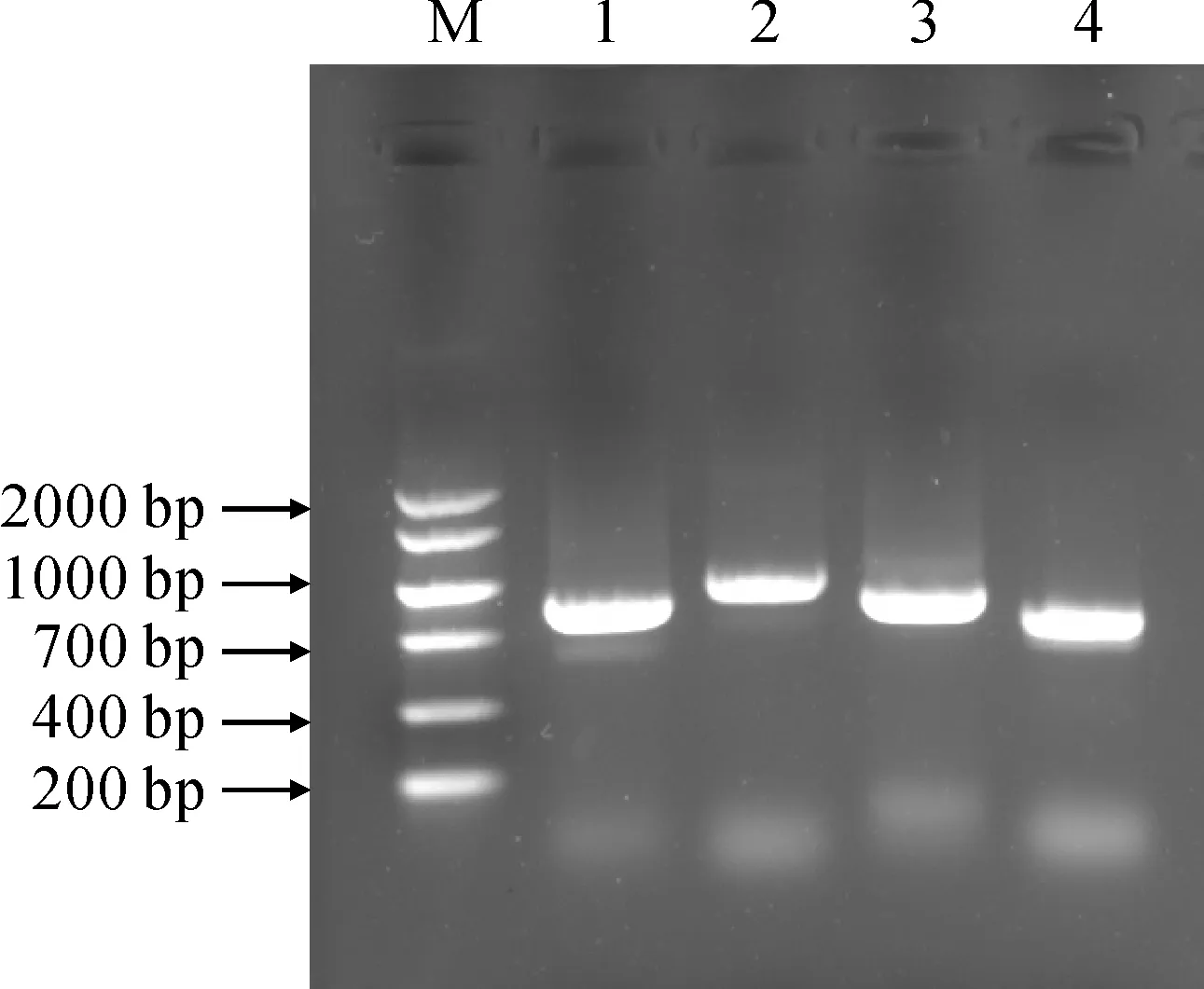
M. DL2000;1. VvNIP1-1;2. VvNIP5-1;3. VvNIP7-1;4. VvNIP2-1图7 葡萄VvNIP1-1、VvNIP2-1、VvNIP5-1、VvNIP7-1基因扩增PCR产物Fig.7 PCR products of VvNIP1-1, VvNIP2-1, VvNIP5-1 and VvNIP7-1 genes in grape
3 讨 论
水通道蛋白在植物体内水分运输、逆境胁迫应答、调节气孔运动中发挥重要的作用[33]。NIP属于水通道蛋白的一个亚类,其家族的演化是对环境适应的结果[34]。目前已报道的NIP拟南芥中有9个[35]、水稻10个[36]、玉米5个[37]、小麦(Triticumaestivum)4个[38]、大豆14个[39],本研究参照拟南芥NIP亚类基因,通过葡萄全基因组分析,共鉴定到8个葡萄NIP基因,其数量与拟南芥和水稻接近。对葡萄NIP家族进行亚细胞定位预测得出,该家族成员主要定位于质膜,符合NIP蛋白的细胞分布特点[9-10]。磷酸化是植物应对非生物胁迫的重要机制,在葡萄NIP中存在多个潜在磷酸化位点,可通过蛋白质的磷酸化迅速对外界胁迫作出反应[40]。经对葡萄NIP进行蛋白多序列比对分析发现,所编码蛋白均含有保守的跨膜螺旋区和特定的保守结构域,且都含有对NPA基序,其中VvNIP5-1、VvNIP6-1、VvNIP7-1中的两个NPA基序进化为NPS-NPV,与拟南芥AtNIP5;1和AtNIP6;1一致,因此推测二者会参与硼酸的吸收和转运[19-20]。蛋白质在氨基酸序列及空间结构上具有相似性,使其在功能上也具有一定相通性。因此,推测葡萄NIP对小分子物质或其他非金属元素拥有渗透性,但是其分子机理需要进一步研究。
葡萄的系统进化可分为5个亚族,其中葡萄与拟南芥同源性较高,例如葡萄VvNIP5-1和AtNIP5;1,VvNIP6-1和AtNIP6;1基因在亲缘关系方面比较接近,推测他们都参与硼酸的吸收和转运[19-20]。启动子元件分析表明多数VvNIP含有响应多种胁迫和激素应答元件,推断它们会参与植物激素的调控网络,并且能够对葡萄逆境胁迫作出应答。葡萄组织表达结果表明VvNIP亚族中多数成员在叶中表达水平较高在茎中较低,这与西洋梨表达模式有一定的相似性[41]。不同基因在不同阶段的表达,可能与生长发育中参与不同的生物过程有关。
本研究克隆得到葡萄VvNIP1-1、VvNIP2-1、VvNIP5-1、VvNIP7-1共4个基因,分别编码262、201、298、293个氨基酸。荧光定量结果表明,葡萄NIP家族基因在低温胁迫下均呈现下调表达趋势,这与李青云[42]在烟草中多数NtNIP基因于低温处理后下调或不表达结果类似。推测在低温胁迫中可能通过降低该基因的表达量来降低蛋白的活性,从而减少植物体内水分的流失,维持植物体的水分平衡,提高植物对逆境的耐受力。Alexandersson等[43]研究表明多数AtNIP家族基因在干旱胁迫下表达下调。本试验中VvNIP4-2、VvNIP2-1表达上调,其余多数基因表达呈显著下调,该结果与毛竹(Phllostachysedulis)PeNIP2-1在干旱处理下上调一致[44]和小麦TaNIP4-1干旱处理下调一致[45]。推测下调时其可以通过调节保卫细胞的运动,减少蒸腾作用,控制气孔开闭来应对干旱环境,上调则是在逆境中保证植物正常生命活动的关键基因。盐胁迫下,VvNIP2-1、VvNIP4-2呈上调表达,其余基因呈下调表达,这与玉米在盐胁迫下的多数基因表达下调结果类似[46]和小麦盐胁迫下TaNIP4-1表达下调一致[45]。不同逆境胁迫下同一基因的表达存在差异,进一步说明VvNIP功能的多样性,而其在葡萄生长发育以及逆境胁迫中的作用机制仍需进一步探究。本研究对葡萄NIP基因家族进行了全基因组鉴定及生物信息学分析,并对盐分、干旱与低温胁迫下的响应进行初步分析,这不仅为今后NIP基因的功能分析和葡萄抗逆性基因资源的挖掘利用提供了有价值的信息,也为葡萄和其他植物的基因家族扩展和进化提供参考。
