基因组编辑技术在水稻育种中的应用进展
2021-11-09朱文银焦晓真姜明松张士永周学标徐建第
陈 峰,朱文银,焦晓真,姜明松,张士永,周学标,徐建第*
(1.山东省农业科学院湿地农业与生态研究所,山东 济南 250100;2.中国水稻研究所,浙江 杭州 311006)
基因组编辑技术已经在单子叶模式作物水稻中得到成功应用,主要包括锌指核酸酶(ZFNs)系统、类转录激活效应因子核酸酶(TALEN)系统、成簇规律间隔的短回文重复序列/核酸内切酶(CRISPR/Cas)系统以及近年来快速发展的单碱基编辑技术[1]。
利用基因组编辑技术可实现对基因组的高效精准修饰,其巨大的技术优势将会成为现代作物育种和农业生物技术研发的一项革命,成为作物遗传育种研究的重要手段[2]。水稻是主要的粮食作物以及重要的单子叶模式作物,基因组编辑技术已成为水稻农艺性状改良及基因功能研究的重要手段。本文介绍了基因组编辑技术及其在水稻性状改良与基因功能研究中的应用进展。
1 基因组编辑技术概述
锌指核酸酶(ZFNs)[3]和类转录激活因子效应物核酸酶(TALENs)[4]最先被应用于基因组定点编辑。ZFN特异性较低,并且操作较为繁琐,费用较高。TALEN技术与ZFN相比,操作较为简单、成本较低。
CRISPR/Cas9系统是通过一段向导RNA和配套的核酸酶对特定的基因组序列进行定点编辑。CRISPR/Cas9具有载体构建简单易行、成本低、能够实现多个靶点的同时定点编辑以及效率高等优点。Hu等对spCas9蛋白进行了改进,改进后可以识别不同的原间隔基序结构(protospacer adjacent motif,PAM),使CRISPR/Cas9系统能识别范围更为广泛的靶点[5]。表1列出了3种工程核酸酶的特点。
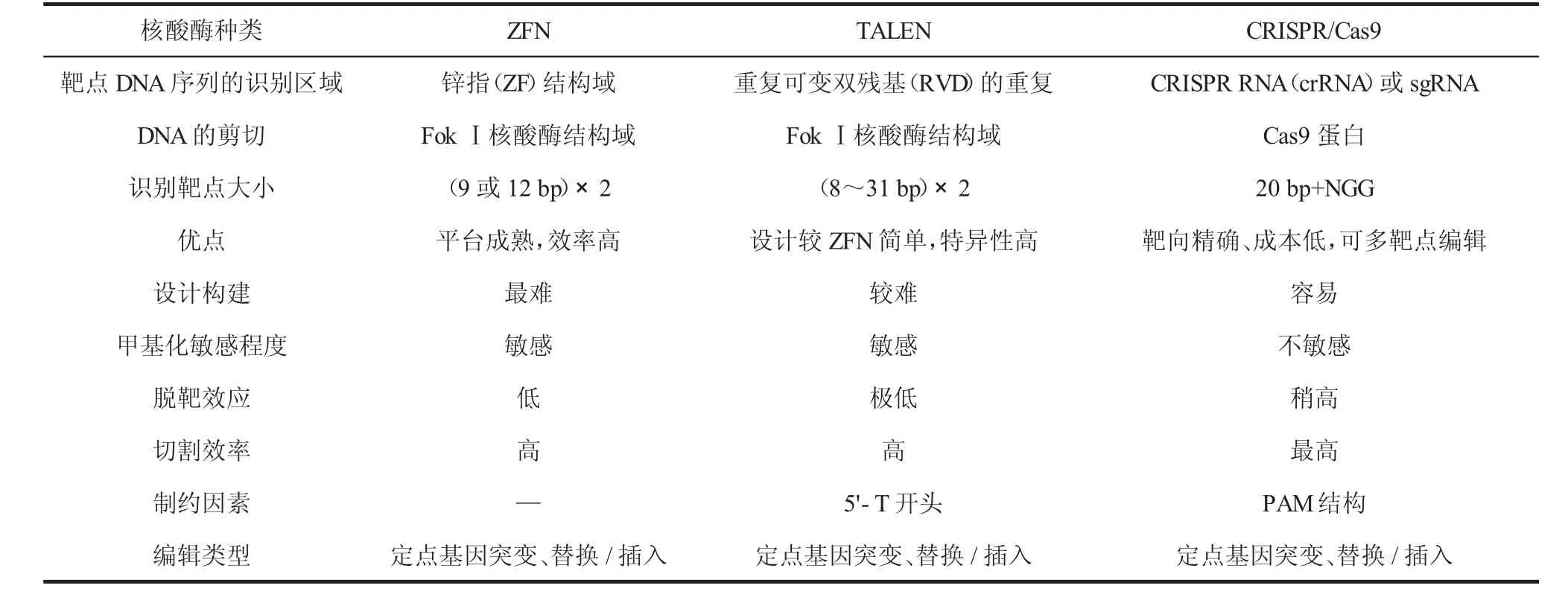
表1 3种工程核酸酶ZFN、TELEN、CRISPR/Cas9的比较
Zetsche等研究发现,Cpf1核酸内切酶包括AsCpf1、FnCpf1和LbCpf1 3种[6]。相比于CRISPR/Cas9系统,Cpf1更简单、更小、更容易进入细胞;Cpf1的PAM是靶序列为5′端连续的2个或3个胸腺嘧啶(T),扩大了基因组编辑的范围;Cpf1不仅可以切割DNA,还可以切割RNA,有利于构建多基因编辑的载体。
Komor等开发了3种不同的碱基编辑器,分别是胞嘧啶碱基编辑器(cytosine base editor,CBE)、腺嘌呤碱基编辑器(adenine base editor,ABE)和先导编辑器(prime editor),这些碱基编辑器在工作时不依赖双链DNA断裂(double strand breaks,DSB)的产生,也不需要供体DNA的参与[7]。朱健康团队在水稻中首次应用了腺嘌呤碱基编辑器(ABE)[8],利用用于大肠杆菌的ABE结构能显著提高腺嘌呤碱基编辑器在水稻中的编辑效率[9]。
2 基因组编辑技术在水稻遗传育种中的应用
利用基因编辑技术对水稻进行改良,在保证其原有优良性状的基础上,可以快速获得具有高产、稳产、优质、多抗等优良性状的水稻种质。
TALEN技术可以用于水稻抗病及优质材料的创制。Li等应用TALEN技术对蔗糖转运蛋白基因OsSWEET14启动子区与白叶枯病原菌效应蛋白结合顺式元件定点突变,降低OsSWEET14的启动子与白叶枯病原菌分泌的效应蛋白的结合能力,获得了对白叶枯病原菌的抗性[10]。Cai等利用TALEN技术编辑Os09g29100基因启动子中的Tal7结合位点,提高了水稻细菌性条斑病的抗性[11]。Shan等在水稻原生质体及愈伤组织中共转化2对TALENs,实现了OsBADH2a和OsBADH2 b2个基因双突变,得到了同一染色体上2个位点间大片段缺失的突变体[12]。
在水稻品质性状编辑方面,利用CRISPR/Cas9基因编辑系统实现了直链淀粉含量、香味等基因的突变。周鑫等利用CRISPR/Cas9基因编辑系统,获得了新型糯稻种质[13-15]。Huang等挖掘出一个稀有Wx等位基因waxyabe2,利用2种碱基编辑系统(ABE-NG和CBE-NG),获得了直链淀粉含量(amylose content,AC)范围为0.30%~29.43%(野生型对照为19.87%)的一系列新的Wx等位基因,其中waxyabe2等位基因编码的GBSSI蛋白上第237位氨基酸由T突变为A,使稻米表现出“软米”的表型,改善了蒸煮食味品质(eating and cooking quality,ECQ)和外观品质[16]。Huang等通过CRISPR/Cas9技术编辑Wx基因启动子上的关键顺式作用元件,创制了多个可微调直链淀粉含量的新Wx等位基因,为水稻优质育种提供了新种质与新方法[17]。邵高能等通过CRISPR/Cas9技术对香味基因Badh2进行了编辑,实现对稻米香味性状的定向改良[18-21]。周文甲等利用CRISPR/Cas9技术对绥粳14的抽穗期基因Hd2、香味基因Badh2进行编辑,获得了抽穗期缩短的香稻种质[22]。
利用CRISPR/Cas9基因编辑系统创制了多种水稻株型发育及产量相关性状的突变材料。Miao等通过密码子优化Cas9蛋白在水稻中高效获得了叶绿素合成基因CAO1和分蘖夹角控制基因LAZYJ突变的植株[23]。Shan等对水稻不同性状的多个基因进行突变,包括OsBADH2、OsDEP1、OsCKX2、OsSD1,获得了可以用于水稻育种的种质材料[24]。Feng等对水稻ROC5、OsWaxy基因进行突变,创制出卷叶及糯性种质[25]。盛夏冰等利用CRISPR/Cas9技术对水稻落粒性主效基因qSH1定点编辑,降低了受体品种的落粒性[26]。Huang等通过CRISPR/Cas9技术对水稻高产基因(Gn1a和DEP1)进行编辑,对Gn1a和DEP1基因随机突变进行表型筛选,获得了多个高产Gn1a和DEP1等位基因[27]。王加峰等应用CRISPR/Cas9系统对调控水稻产量基因TGW6定点编辑,部分tgw6的缺失突变能显著提高千粒质量(幅度大于5%),为水稻的高产稳产奠定了重要的材料基础[28]。沈兰等利用CRISPR/Cas9系统,构建了共敲除载体pC1300-2×35S::Cas9-gGS3-gGn1a,成功地实现了对粒型基因GS3和每穗粒数基因Gn1a的定点编辑[29]。孟帅等利用CRISPR/Cas9技术编辑粒长基因GS3,获得了花时早于短粒粳稻野生型的材料[30]。张浩等利用CRISPR/Cas9技术编辑DTH8基因改良了粳稻99-25的抽穗期,获得了抽穗期提前的DTH8突变体材料[31]。胡雪娇等利用CRISPR/Cas9系统,以SD1基因为靶基因,构建基因编辑载体CRISPR-SD1,定向改良了恢复系申繁17和申繁24的株高[32]。
利用CRISPR/Cas9基因编辑系统创制了多种水稻抗病突变材料,为水稻抗性改良提供了种质。卿冬进等利用CRISPR/Cas9基因编辑方法敲除水稻恢复系“GH998”的Bsr-d1基因,获得无转基因成分的纯合突变株系,为进一步研究Bsr-d1基因在杂交水稻上的功能提供了理论依据和种质资源[33]。刘维等利用CRISPR/Cas9技术,靶向编辑抗病基因OsCOL9的CDS起始区域以及外显子末端,在T1代获得了类型丰富的OsCOL9(CONSTANS-Like 9)突变体,为水稻抗病育种奠定了重要材料基础[34]。徐鹏应用CRISPR/Cas9系统,以稻瘟病抗性基因Pita、Pi21和ERF922为靶基因,构建共编辑载体,获得了具有较高稻瘟病抗性的长粒粳稻恢复系L1014纯合突变株系,为稻瘟病抗性改良提供了良好的材料[35]。杨海河等应用CRISPR/Cas9技术对日本晴稻瘟病基因pi21进行编辑,获得了pi21隐性突变株系,稻瘟病抗性得到提高[36]。王芳权等针对Pi21基因的2个靶位点构建基因敲除载体,转化南粳9108,利用CRISPR/Cas9技术成功敲除了水稻Pi21基因,为培育广谱抗稻瘟病的水稻新品系奠定了基础[37]。Wang等利用CRISPR/Cas9技术编辑编码AP2/ERF类转录因子的基因OsERF922,获得了抗稻瘟病空育131株系[38]。
利用CRISPR/Cas9基因编辑系统创制了抗除草剂、低镉积累种质。Li等利用CRISPR/Cas9技术对5-烯醇丙酮酰莽草酸-3-磷酸合成酶基因OsEPSPS进行编辑,获得了具有草甘膦除草剂抗性的水稻种质[39]。Sun等利用CRISPR/Cas9技术对乙酰乳酸合酶基因OsJiS进行了定点编辑,获得了抗嘧啶羧酸类除草剂的水稻种质[40]。Xu等应用CRISPR/Cas9系统编辑苯达松抗性基因BEL,获得了对苯达松敏感的水稻材料[41]。Tang等利用CRISPR/Cas9系统,敲除金属转运基因OsNramp5,创制出低镉积累籼稻新种质[42]。
另外,CRISPR/Cas9基因编辑系统在水稻生长发育调控的分子机制方面也取得了重要进展。杨宏等根据OsSUTs基因序列信息设计靶位点,构建CRISPR/Cas9载体,获得5个OsSUTs基因的阳性敲除苗,为研究OsSUTs基因的分子功能及其调节关系提供了良好材料[43]。彭廷等利用CRISPR/Cas9基因编辑技术,得到miR1866的CRISPR/Cas9表达载体,利用农杆菌介导法导入日本晴,研究了miR1866对水稻生长发育的调节作用,对研究miRNA调控途径和分子机制具有重要的意义[44]。陈会杰等利用CRISPR/Cas9技术原理,构制PHYB的CRISPR/Cas9表达载体,转化粳稻品种日本晴,对PHYB基因进行了定点编辑,为进一步研究PHYB在水稻中的功能提供了依据[45]。黄小贞等利用CRISPR/Cas9系统,分别构建TIFYlb及其同源基因TIFYla(LOC_Os03g47970)的单基因和双基因敲除载体,成功实现了转录因子TIFYla和TIFYlb的基因编辑,获得不同类型单基因突变株系以及双基因突变株系,为研究TIFY1响应低温应答的机制提供了依据[46]。张宗飞等采用CRISPR/Cas9技术,成功创建了2个已鉴定了的水稻果糖激酶OsFRK家族基因的敲除突变体,为研究OsFRK1和OsFRK2的生物学功能提供了材料[47]。沈兰等利用CRISPR/Cas9多基因编辑系统成功构建共敲除水稻中8个农艺性状基因的载体,还在T0代获得了纯合的六突突变株、七突突变株、八突突变株,表明CRISPR/Cas9系统在作物育种过程中可快速引入遗传多样性[48]。中国水稻研究所王克剑团队利用CRISPR/Cas9基因编辑技术在杂交水稻春优84中同时敲除PAIR1、REC8、OSD1和MTL4个生殖相关基因,得到了杂交稻的克隆种子,完成了杂合基因型的固定,实现了杂交稻无融合生殖从0到1的关键突破,具有重要的理论和实践意义[49]。
3 问题与展望
以CRISPR/Cas9系统为代表的基因组编辑技术提高了作物定向遗传改良效率,广泛地应用于作物的精准遗传改良。当然,基因组编辑技术也面临技术以及监管方面的一些问题,目前的研究多局限于理论研究及新材料的创制,随着基因组编辑技术的完善可望在生产应用方面发挥重要作用。
3.1 扩大基因组编辑范围
最常用的Cas9来自于产胺链球菌(Streptococcus pyogenes),被称为SpCas9。SpCas9能够识别的PAM序列主要是NGG,限制了CRISPR/Cas9系统在基因组的可编辑范围[50]。Hu等通过定点突变的方法对SpCas9蛋白进行改造,获得2种SpCas9变体VQR和VRER,可以识别NGA以及NGCG 2个PAM序列,在水稻中可编辑范围拓展到现有的2倍以上,2种变体也可以同时对多基因进行有效的编辑,为进行更广泛的基因组编辑提供了新的可选工具[5]。辛高伟等利用改进后的CRISPR/VQR系统对水稻中3个相对低效的VQR靶位点NAL1-Q1、NAL1-Q2和LPA1-Q进行了编辑,结果表明,改进的CRISPR/VQR系统可以高效编辑NGAC PAM位点,并产生丰富的突变类型[51]。这为水稻及其他植物相关基因NGAC PAM位点的编辑提供了理论依据。
Zetsche等通过生物信息学手段发现了新的V型CRISPR基因编辑系统CRISPR/Cpf1,有效地扩展了基因组编辑范围[6]。研究结果表明,CRISPR/Cpf1在植物基因组编辑上具有广阔的应用前景。除了SpCas9,还有一些不同来源的CRISPR/Cas系统,也具有基因编辑能力[45]。
3.2 无外源DNA污染的植物基因编辑技术应用
常规植物基因组编辑手段存在脱靶效应及外源DNA污染的风险[50]。Woo等将Cas9蛋白和gRNA在体外组装成核糖核蛋白复合体,再通过聚乙二醇转化法将核糖核蛋白复合体转入原生质体,成功对目的基因进行了编辑,T0代获得了无外源DNA残留的基因编辑植株[52]。Liu等报道了一种对外源成份进行精确分析的工具FED(foreign element detector),有望为全球基因组编辑生物的应用和安全监管提供重要工具平台[53]。
3.3 监管政策方面的问题
基因编辑技术的出现为作物分子育种提供了极好的机遇,但对于基因编辑作物是否属于转基因生物,目前国际上尚未有明确一致的定论,其监管标准存在较大争议[54]。美国农业监管部门认为,基因编辑作物是通过细胞自我修复机制产生的突变体,不被定义为转基因生物[55]。2020年6月,美国农业部给出了对基因编辑技术的支持性指南,可通过监管豁免和未来豁免决定监管状况程序来监管基因编辑产品。截止到2020年底,美国农业部已批准了70种以上的基因编辑作物,不再额外实施监管。除美国以外,采用类似政策的国家有加拿大、巴西、阿根廷、澳大利亚、智利、哥伦比亚、以色列等。日本和俄罗斯原本都是反对转基因作物种植的国家,但都对基因编辑技术持积极态度。2020年,日本批准其国内第一个基因编辑西红柿可以商业化生产和食用。
鉴于基因编辑技术在农业生物育种中的巨大优势和潜力,建议相关部门加强基因编辑作物研发支持力度,同时尽快出台更科学合理的基因编辑作物监管政策,从而有序推进生物育种产业化应用。
