铜胁迫对粉葛幼苗生长及生理指标的影响
2021-11-09冀中英
高 昆, 冀中英
(1.山西大同大学 生命科学学院,山西 大同 037009;2.山西大同大学 设施农业技术研发中心,山西 大同 037009)
铜作为植物体内的微量营养元素之一,对植物进行正常的生命活动是十分重要的[1],铜也构成了某些金属蛋白酶,参加植物很多的生物反应[2],但铜过量会破坏细胞膜结构和功能,抑制植物的抗氧化物酶系统和植物的光合作用[3],从而导致植物的生物量减少、生长发育遭到妨碍,严重会引起萎黄病和坏死[4]。除此之外,含量过高的铜还会对植物矿质营养元素的吸收和运输造成一定的影响[5]。在韦美玉,熊思,董丽欣等人的研究中发现,低浓度CuSO4对芹菜、玉米幼苗、年幼的苹果树木的正常生长发育具有积极的影响,而高浓度CuSO4对它们会产生一定的阻碍作用,进而导致它们的质量和产量下降[6~8]。
在现今的生活中,铜的使用量越来越多,导致了铜污染物排放也越来越多,铜已经成为了影响生态环境的元素之一[9]。 根据2014年《全国土壤污染调查公报》[10]的报道显示,铜是耕地和金属冶炼工业园区及其周边土壤的主要污染物[11]。一般情况下,土壤中铜的总含量为15~40 mg·kg-1,但当土壤中铜的总含量为150~400 mg·kg-1,会给植物带来毒害作用[6]。
葛(Puerarialobata)是多年生豆科(Leguminosae)藤本植物,主要分布于热带和温带,中国拥有丰富的葛属植物种质资源,约有9个种,2个变种,其中野葛(Puerarialobata(Willd.) Ohwi)和粉葛(Puerarialobata(Willd.) Ohwi var.thomsonii(Benth.) Vaniot der Maesen)在中国的开发应用最广,分布也最广[12]。葛的各部分均具有使用价值,葛的根、叶、花都可以入药,葛根还可以被开发为保健食品;葛藤纤维可用于织物与造纸;葛叶可被用作天然的优质饲料。除此之外,葛还具有保持和改良水土的生态作用[12~13]。并且在本次新冠肺炎疫情中,葛根汤颗粒在预防以及早期治疗过程中发挥了重要作用。
实验选用的葛品种是粉葛(P.thomsoniiBenth),它的叶呈绿色,块根比较粗大、形状类似长棒形或纺锤形[14]。粉葛适合生长在相对温暖、湿润的气候,能抵抗一定程度的寒冷和干旱[15]。它的适应性也比较广,病虫害也相对较少,在大多数土壤中均可栽培,但黏土与碱性土除外[15]。粉葛的主要利用部位是根部,即葛根。葛根的地上部分含有葛根素[16], 在临床上被大量应用,可用于治疗冠心病、偏头痛等[17]。研究表明,葛根可以使心率减慢,血压降低[18],还可以使脑血管扩张,改善大脑供氧[19]。除此之外,葛根也能够使脑微循环障碍得到改善,降低血脂,调节血糖[20]。
近些年来,葛在发掘种质资源、改善栽培技术以及临床应用等方面的研究颇多,还未见重金属胁迫对葛幼苗生长和生理特性的影响方面的报道。本实验研究铜胁迫时对粉葛生长及其生理指标的影响,以期为葛根安全规范种植和保证药材的品质提供一定的理论根据。
1 材料与方法
1.1 材料
本实验所选用的粉葛幼苗购买于广西藤县绿州农业发展有限公司,所购的幼苗带有一部分根和叶。
1.2 方法
1.2.1 粉葛幼苗的栽培 挑选粗细一致且无病虫害的粉葛幼苗,先用自来水冲洗至洁净,然后置于装有常温自来水的透明玻璃瓶中培养5 d,进行缓苗。
1.2.2 粉葛幼苗的铜胁迫 Cu2+以CuSO4·5H2O的形式提供,选取生长势基本一致的粉葛幼苗,并将其分成5组,每组3瓶,每瓶2株,5组分别如下:
处理①——对照(不施CuSO4溶液);
处理②——施0.01 mg·L-1CuSO4溶液;
处理③——施0.03 mg·L-1CuSO4溶液;
处理④——施0.06 mg·L-1CuSO4溶液;
处理⑤——施0.1 mg·L-1CuSO4溶液;
②~⑤组各添加100 mL上述浓度的CuSO4溶液, ①组添加100 mL的蒸馏水作为对照。每瓶上做好溶液体积的刻度标记,胁迫处理期间,若溶液体积低于刻度线,则需要及时添加适量的蒸馏水以补充损失的水分,保持铜离子浓度恒定。在铜胁迫0 d,3 d,6 d,9 d,12 d时,对5组分别取样测定。
1.2.3 形态观察 观察并记录各组粉葛幼苗铜胁迫处理12 d后叶片的形态特征,并将铜胁迫对粉葛幼苗的影响程度分为5个级别:
1级——叶尖、叶缘焦枯并有小部分叶脱落;
2级——叶尖、叶缘变黄;
3级——生长正常(无叶尖、叶缘变黄和叶片脱落现象);
4级——小部分叶片舒展、叶色浓绿;
5级——大部分叶片舒展、叶色浓绿。
1.2.4 测定生长指标 叶长、叶宽的增长率:各组随机选取3株幼苗,在铜胁迫0 d,3 d,12 d时,用直尺测定同一叶位同一叶片的叶长、叶宽(精确到0.1 cm),并计算增长率(A),计算方法按潘雪峰[21]的方法测定,方法如下:
式中,A——叶长(或叶宽)的增长率,C——铜胁迫0d时的叶长(或叶宽),D——铜胁迫3 d,12 d的叶长(或叶宽)。
1.2.5 测定各项生理指标 各组随机摘取粉葛幼苗长势相近的叶片,然后测定各项生理指标。处理①~⑤各重复3次,各指标及其测定的方法如下:
(1)在铜胁迫3 d,6 d,9 d,12 d后用SPAD-502PLUS叶绿素计测定叶片铜胁迫下的SPAD值;
(2)在铜胁迫12 d后按照考马斯亮蓝G-250染色法测定可溶性蛋白质含量[22];
(3)在铜胁迫12 d后采用硫代巴比妥酸法测定丙二醛(MDA)含量和可溶性糖含量[23];
(4)在铜胁迫12 d后采用电导仪法[24]测定膜的相对透性。
1.2.6 数据处理 用SPSS 19.0进行显著性分析,用Excel 2010进行绘图。
2 结果与分析
2.1 铜胁迫对粉葛幼苗外观形态的影响
由表1可知,铜离子浓度不同,对粉葛幼苗生长形态的影响有所不同,其中0.01 mg·L-1和0.03 mg·L-1浓度下,粉葛幼苗叶片的外观形态良好,而0.06 mg·L-1和0.1 mg·L-1浓度下,粉葛幼苗叶片的外观形态与对照组相比较差。

表1 不同浓度铜离子对粉葛幼苗叶片的影响程度及叶片症状
2.2 铜胁迫对粉葛幼苗生长指标的影响
由图1可知,粉葛幼苗叶片的叶长增长率表现出先升高后下降的趋势,并且在高浓度铜离子处理的条件下,时间越长,浓度越大,叶长增长率下降越明显,处理②~⑤组与对照组均形成极显著差异(P<0.01)。在处理3 d时,处理③的粉葛幼苗叶片的叶长增长率达到最大值,为8.33 %,而处理⑤的叶长增长率降至最低,为6.80 %。在处理12 d时,粉葛幼苗叶片的叶长增长率在处理③和处理⑤条件下,分别达到最大和最小值,分别为8.54 %、6.67 %。当施用的铜离子浓度低于0.03 mg·L-1时,处理12 d的叶长增长率均高于3 d,而当施用的铜离子浓度高于0.03 mg·L-1时,处理12 d的叶长增长率均低于3 d。根据表2可知,处理天数和处理浓度之间存在互作,浓度的作用效果十分显著,而天数的作用并不明显。处理12 d并且处理浓度为0.03 mg·L-1的条件对粉葛幼苗的促进效果最明显,而在处理12 d且外施铜离子浓度为0.1 mg·L-1时,对粉葛幼苗的抑制作用最显著。这说明,低浓度铜离子会促进粉葛幼苗的生长,而高浓度铜离子则会抑制其生长。

图1 不同浓度铜离子对粉葛幼苗叶长增长率的影响
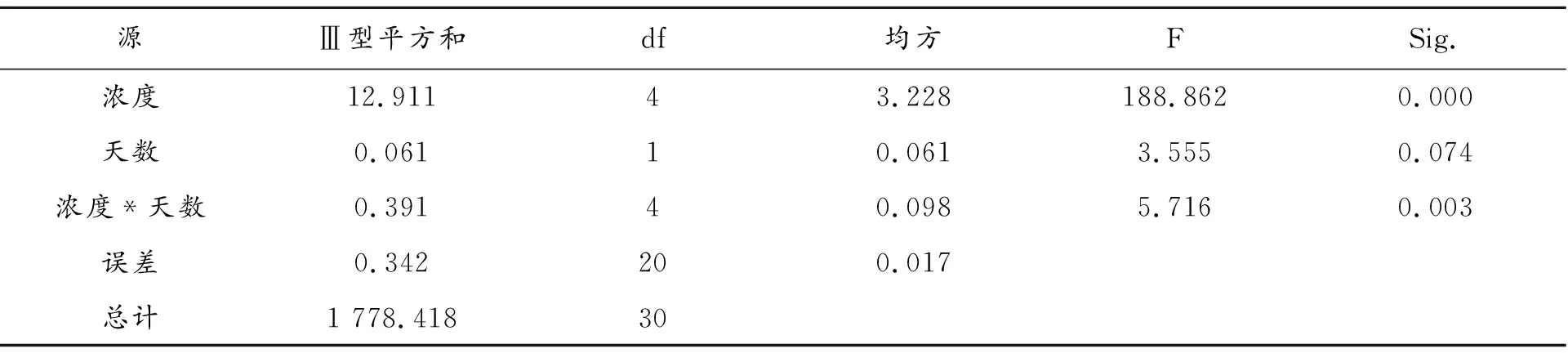
表2 主体间效应的检验 因变量:叶长
由图2可知,粉葛幼苗叶片的叶宽增长率呈先上升后下降的趋势,并且在高浓度铜离子处理的条件下,时间越长,浓度越大,叶宽增长率下降并不明显,各组与对照组均形成极显著差异(P<0.01)。在处理3 d时,处理③的粉葛幼苗叶片的叶宽增长率达到最大值,为8.76 %,而处理⑤的叶宽增长率降至最低,为7.66 %。在处理12 d时,粉葛幼苗叶片的叶宽增长率在处理③和处理⑤条件下,分别达到最大和最小值,分别为8.83 %、7.64 %。在铜离子浓度低于0.03 mg·L-1时,处理12 d的叶宽增长率均高于3 d,而当铜离子浓度高于0.03 mg·L-1时,处理12 d的叶宽增长率与处理3 d相差不大,并无显著差异。根据表3可知,浓度和天数之间存在互作,浓度和天数的作用效果均比较显著。处理12 d并且处理浓度为0.03 mg·L-1的条件对粉葛幼苗的促进效果最明显,而在处理12 d且外施铜离子浓度为0.1 mg·L-1时,对粉葛幼苗的抑制作用最显著。这说明铜胁迫对粉葛幼苗的生长具有低促高抑的作用。

图2 同浓度铜离子对粉葛幼苗叶宽增长率的影响
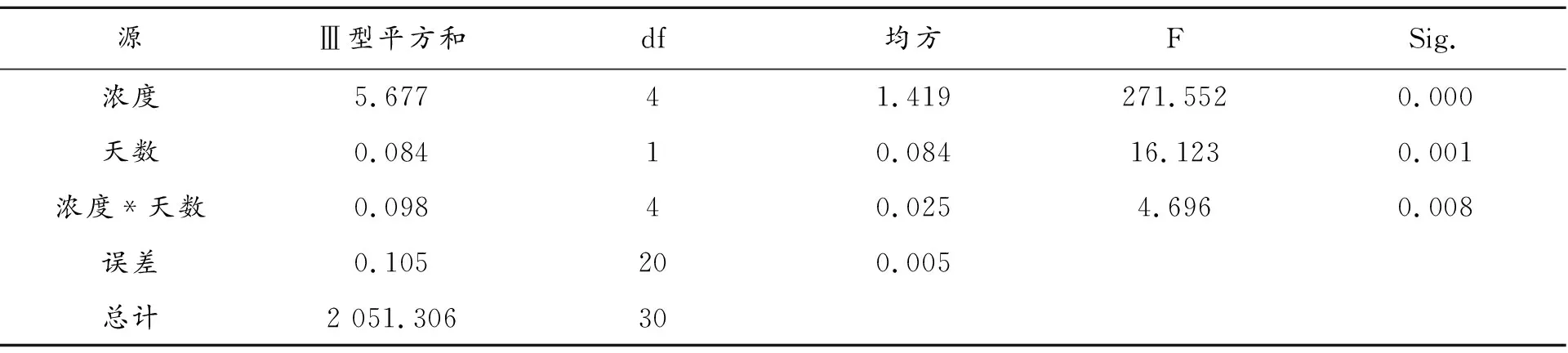
表3 主体间效应的检验 因变量:叶宽
2.3 铜胁迫对粉葛幼苗生理指标的影响
2.3.1 对粉葛幼苗SPAD值的影响 SPAD值能够用来反映粉葛幼苗叶片的叶绿素含量。由图3可知,在施用低浓度铜离子的条件下,SPAD值随着时间的延长呈上升趋势,而在高浓度铜离子处理条件下,SPAD值则随着时间的增加表现出下降趋势,并且时间越长,浓度越大,下降程度越明显。在处理②和处理③中,时间越长,SPAD值越大,且均与对照组(处理①)形成极显著差异(P<0.01),处理③比处理②增加的程度更大。在处理②中,SPAD值升至最高为46.87,在处理③中,SPAD值升至最高为48.63。在处理④和处理⑤中,随着时间的增加,SPAD值表现出下降的趋势,并且两个处理组均与对照呈极显著差异(P<0.01)。在处理④中,SPAD值降至36.53,达到最小值,处理⑤中的SPAD值均低于处理④,并且最小值为33.60。根据表4可知,处理浓度和处理天数之间存在互作,并且浓度和天数的作用效果均十分显著。在处理12 d并且处理浓度为0.03 mg·L-1的条件下,粉葛幼苗的SPAD值增幅最明显,而在处理12 d且外施铜离子浓度为0.1 mg·L-1时,粉葛幼苗的SPAD值的降低最显著。这说明,粉葛幼苗能抵抗一定浓度的铜胁迫,但超过一定限度后,SPAD值会出现下降,即叶绿素含量下降。

图3 不同浓度铜离子对粉葛幼苗SPAD值的影响
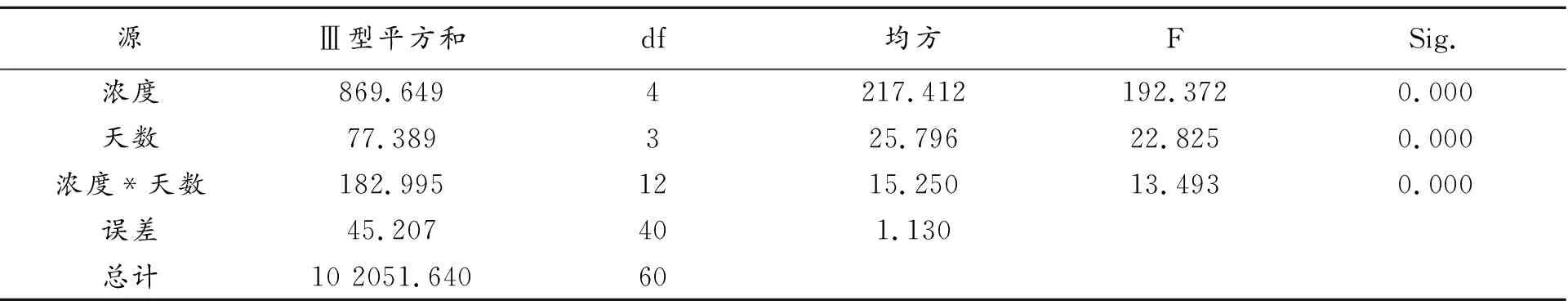
表4 主体间效应的检验 因变量:SPAD
2.3.2 对粉葛幼苗可溶性蛋白含量的影响 由图4可知,粉葛幼苗叶片中可溶性蛋白质的含量会随着Cu2+浓度的增加而表现出先增加后下落的趋势,并且与对照组形成极显著差异(P<0.01),处理②与处理③的增幅并没有明显差异。处理②~处理⑤可溶性蛋白的含量分别为16.43 mg·g-1、17.13 mg·g-1、13.90 mg·g-1、13.16 mg·g-1,并且在0.03 mg·L-1铜离子处理条件下,粉葛幼苗叶片的可溶性蛋白质含量达到最大,与对照相比升高了13.57 %,而在0.1 mg·L-1铜离子处理条件下,可溶性蛋白质含量降至最小值,比对照组降低了12.73 %。这说明,低浓度Cu2+可以提高粉葛幼苗中可溶性蛋白质的含量,而高浓度Cu2+会使粉葛幼苗中的可溶性蛋白质的含量出现下降的情况。
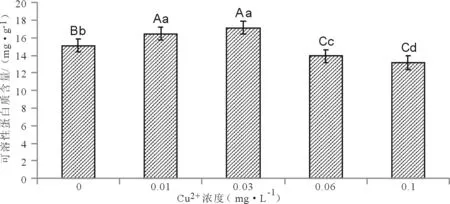
图4 不同浓度铜离子对粉葛幼苗可溶性蛋白质含量的影响
2.3.3 粉葛幼苗丙二醛(MDA)、膜相对透性的变化 由图5可知,粉葛幼苗叶片中的MDA会随着Cu2+浓度的升高而表现上升趋势,其中处理②、处理③与对照组之间没有形成显著差异(P>0.05),处理④和处理⑤与对照组差异极显著(P<0.01),处理④与处理⑤之间没有很明显的差别。在外施的铜离子浓度为0.1 mg·L-1时,粉葛幼苗叶片的MDA含量升到最高,并且比对照组提高了31.18 %。这说明,外施铜离子会使粉葛幼苗叶片的MDA含量提高,并且铜离子浓度越大,MDA含量的提高,从一定程度上反映了细胞膜的受害程度。
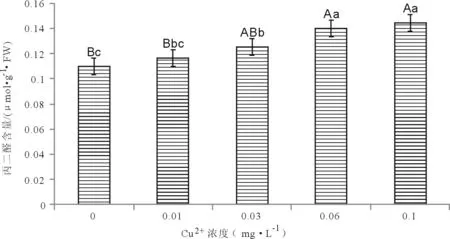
图5 不同浓度铜离子对粉葛幼苗丙二醛含量的影响
膜的透性可以用电导率来反映[33]。图6反映出,粉葛幼苗叶片的相对电导率表现出升高的趋势,其中处理②与对照组(处理①)之间没有形成显著差异(P>0.05),处理③~④组均与对照呈极显著差异(P<0.01),各组之间均有明显的差别。在处理⑤时,相对电导率上升到最大,为29.61 %,比对照组提高了181.73 %。这说明,高浓度铜离子会损伤粉葛幼苗的细胞膜。
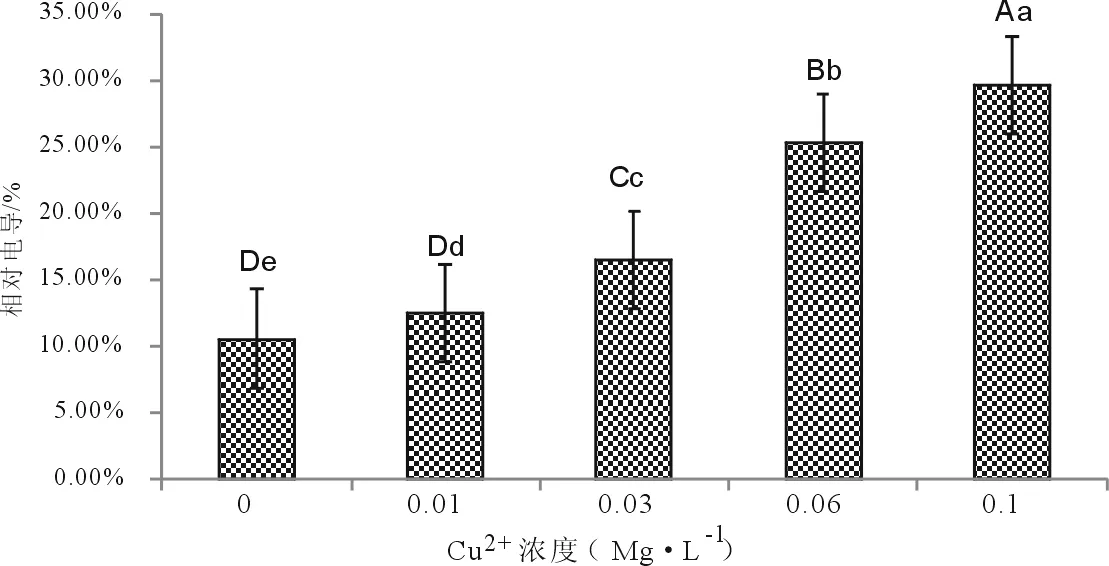
图6 不同浓度铜离子对粉葛幼苗相对电导率的影响
2.3.4 对粉葛幼苗糖含量的影响 从图7可以得到,随着铜离子浓度增大,粉葛幼苗叶片中的可溶性糖含量逐渐攀升,铜离子浓度达到0.1 mg·L-1时,增幅最明显,处理②、处理③与对照组形成的差异并没有那么显著(P>0.05),处理④与对照组形成了较为显著的差异(P<0.05),处理⑤则与对照组形成了极显著差异(P<0.01)。处理②~处理⑤可溶性糖的含量分别为0.38 μmol·g-1·FW、0.40 μmol·g-1·FW、0.44 μmol·g-1·FW、0.60 μmol·g-1·FW,相对于对照组(处理①)分别增加了5.04 %、12.89 %、22.97 %、68.52 %。这说明铜离子浓度高低会影响粉葛幼苗中可溶性糖的含量。
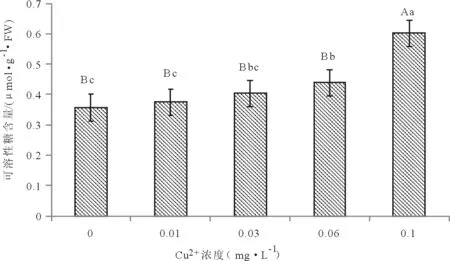
图7 不同浓度铜离子对粉葛幼苗可溶性糖含量的影响
3 结论与讨论
重金属的毒害作用会导致植物体内的生命活动发生混乱,从而阻碍植物的生长,严重会引起死亡。然而,大部分植物都会对重金属的毒害作用表现出应激保护效应,如植物具备的细胞渗透调节机制[26],提供重金属离子的附着位点[4],液泡隔离、吸收重金属离子[4]等。铜离子在不同植物中的含量不同,粉葛中铜含量为0.03 mg·L-1[27]。
本研究发现,粉葛幼苗在低浓度铜离子条件下(0.01 mg·L-1和0.03 mg·L-1),叶片长势好,叶色浓绿,然而,随着铜离子浓度的增加叶尖、叶缘逐渐变黄、焦枯,甚至有一小部分脱落死亡。除此之外,本研究还发现,随着铜离子浓度的逐渐上升,粉葛幼苗叶片的叶长和叶宽增长率均呈现出先升后降的趋势,这与潘雪峰[21]、赵艳[28]、周娜娜[29]等人的研究结果一致,并且在铜离子浓度达到0.03 mg·L-1时,叶长和叶宽的增长率均达到最大值。这可能是由于在低浓度铜离子处理条件下,激活了粉葛幼苗的抗逆性反应,从而促进了其叶片的生长,而高浓度的铜离子会使植物体内的代谢紊乱,从而阻碍了叶片的生长。
根据乔润雨[30]、宋慧[31]等人的报道显示,用SPAD值来反映不同蔬菜和甜瓜幼苗不同位置叶片的叶绿素含量是可靠的,两者之间表现有正相关性[32],并且方法操作简单。本研究发现,低浓度铜离子处理条件下,SPAD值随着时间的延长而逐渐上升,但是,在施用高浓度铜离子的情况下,SPAD值则会随着时间的增加而逐渐下降,并且时间越长,浓度越大,下降越明显。这说明,低浓度铜离子会促进叶绿素含量的增加,而高浓度铜离子则会降低叶绿素含量。这可能是由于铜是电子传递链中的质体蓝素的组成成分[33],并且少量的铜离子有助于叶绿素的合成。但是,铜离子不是越多越好,铜离子浓度过高一方面会引起铜离子替代叶绿素中的镁离子,从而阻碍了叶绿素的合成,另一方面也会破坏叶绿体的结构,影响类囊体膜的组成和光系统之间的协调功能,最终妨碍了光合作用的进行[26]。
本研究发现,粉葛幼苗叶片中的可溶性蛋白质含量在低浓度铜离子条件下有所增加,而在高浓度铜离子处理条件下则显著下降,这与朱健[34]等人的研究结果一致。表现出这种趋势的原因可能是在粉葛幼苗体内产生了一些抵抗逆境胁迫 的蛋白,使得可溶性蛋白质含量升高。然而,铜离子的积累会阻碍蛋白质的正常合成,最终导致可溶性蛋白质的含量出现降低的情况。
膜脂过氧化作用的产物主要是MDA[35]。用电导率来反映质膜透性也是可靠的,它们之间表现有一定的正相关。因此,以上两种方法均可以用来衡量粉葛幼苗细胞膜受铜胁迫伤害的程度。本研究发现,无论是丙二醛含量还是相对电导率都在逐渐上升,与赵淑玲[33]、马晓华[26]等人的研究结果一致。这可能是由于铜胁迫造成粉葛幼苗细胞膜受到破坏,从而造成丙二醛含量增加,与此同时,膜的透性程度增加,引起一些电解质向胞外渗出,相对电导率也相应增大。
可溶性糖是植物在逆境条件下为保护细胞的渗透调节物质[35]。本次的研究发现,可溶性糖的含量会随着铜离子浓度的不断增大而逐渐升高,这可能是由于粉葛幼苗为提升细胞的渗透调节能力而采取的一种手段。综上,铜胁迫会影响粉葛幼苗的生长及生理指标,铜离子浓度低时,会促进粉葛幼苗的生长及生理响应,而高浓度的铜离子会使叶绿素和可溶性蛋白的含量出现降低的情况,电解质也易向胞外渗出,同时产生了MDA和可溶性糖,从而阻碍了粉葛幼苗的正常生长发育。
