ferrostatin-1保护对乙酰氨基酚诱导的小鼠急性肝损伤
2021-11-09蒋慰赢秦明强屈明超徐德祥王建青
蒋慰赢,秦明强,张 程,屈明超,徐德祥,王建青
对乙酰氨基酚(acetaminophen,APAP)是临床上常用的解热镇痛药物,应用非常广泛,在治疗剂量下APAP不会引起急性肝损伤(acute liver injury,ALI),然而APAP一旦过量就会导致急性肝损伤甚至是急性肝功能衰竭。据统计,在美国每年APAP中毒的急诊患者约56 000例,其中约450例死亡。
铁死亡(ferroptosis)是近年来发现的一种细胞死亡方式,其具有与其他细胞死亡不同的形态和生化特征。研究表明,在体外条件下,铁死亡抑制剂ferrostatin-1(fer-1)对APAP诱导的小鼠肝细胞的死亡有保护作用,但其具体机制并不明确。该研究探讨fer-1保护APAP诱导的小鼠ALI的机制,为临床预防和治疗APAP过量导致的ALI提供新的方向和思路。
1 材料与方法
1.1 实验动物
选用88只SPF级雄性ICR小鼠, 8周龄,体质量为36~42 g,购买于北京维通利华实验动物技术有限公司。小鼠饲养在适宜的环境中,具体环境如下:温度保持在(25±1)℃,湿度保持在(55±5)%,保持12 h/12 h昼夜交替,可自由饮水摄食。本研究所使用的动物实验均已通过安徽医科大学动物伦理委员会审查并批准(许可证编号:20131179)。1.2 试剂
fer-1购自美国MCE公司;APAP、NAC购自美国Sigma公司;聚氧乙烯蓖麻油EL(CremophorEL)购自上海阿拉丁生化有限公司;天冬氨酸氨基转移酶(aspartate aminotransferase,AST)、丙氨酶氨基转移酶(alanine aminotransferase,ALT)检测试剂盒购自浙江伊利康生物技术有限公司;丙二醛(malondialdehyde,MDA)试剂盒购自南京建成生物工程研究所;RT-PCR相关试剂购自美国Thermo Fisher Scientific公司以及美国Promega公司;研究中引物均由实验室设计并交给上海Invitrogen有限公司合成。1
.3 方法
1
.3
.1
生存实验 将40只雄性ICR小鼠随机分为4组(n
=10),APAP模型组:对小鼠进行单次APAP腹腔注射,剂量为500 mg/kg;fer-1预处理组:在APAP注射前1 h提前腹腔注射fer-1(5 mg/kg);fer-1后处理组:在APAP注射后1 h腹腔注射fer-1(5 mg/kg);NAC后处理组:在APAP注射后1 h腹腔注射N-乙酰-L-半胱氨酸(N-acetyl-L-cysteine,NAC)(300 mg/kg)。在处理完后,观察并记录7 d内小鼠的死亡情况。小鼠的存活率以生存小鼠数目/原有小鼠数目×100%计算所得,并以生存率作图。1
.3
.2
时效实验 小鼠随机分为以下几组(n
=6): 0 h组、fer-1组、APAP模型组(1、4、24 h)、fer-1预处理组(1、4、24 h)。fer-1预处理组在小鼠腹腔注射400 mg/kg APAP的前1 h腹腔注射5 mg/kg的fer-1,随后在注射APAP的0、1、4、24 h对小鼠进行取材。1
.3
.3
血清生化指标检测 实验动物血清中肝功能指标通过贝克曼全自动生化检测仪检测,检测指标为ALT和AST。1
.3
.4
肝脏MDA含量测定 精密称取100 mg小鼠肝脏组织,放入1 ml预先4 ℃冷藏的0.9%氯化钠溶液中,随后批量放入自动匀浆仪中进行匀浆,制备浓度为20%的匀浆液。制备好的组织匀浆液在 3 500 r/min、4 ℃下离心15 min,取上清液备用。提前配置好所需试剂,根据试剂盒中提供的说明书进行相关操作,使用酶标仪用532 nm波长检测上清液的吸光度,并采用BCA法检测上清液中的总蛋白浓度后,根据公式[(测定管吸光度-空白管吸光度)/(标准管吸光度-空白管吸光度)×标准管浓度/待测蛋白浓度]计算结果后分析。1
.3
.5
组织病理学检测 取小鼠肝大叶,4%多聚甲醛固定后,进行包埋、切片、HE染色、封固、透明、脱水、封片、光镜下观察。选取各组切片中连续的3个视野下的图像照片(×100),采用ImageJ软件对图像进行分析并定量。1
.3
.6
肝脏组织基因检测1
.3
.6
.1
肝脏RNA的提取和逆转录 采用TRIzol法提取小鼠肝脏总RNA后,使用酶标仪进行RNA样品定量分析,测定样品在260、280 nm波长处的吸光度值(OD)并计算OD260/OD280比值,加入无酶水将所有RNA样品的终浓度定量在500 ng/μl。依据逆转录试剂盒中所提供的说明书,使用逆转录仪将RNA逆转录成cDNA。1
.3
.6
.2
RT-
PCR扩增反应 设计好的引物用无酶水稀释后,与逆转录的cDNA、PCR Mix、无酶水配置成20 μl的扩增反应体系。把扩增体系加入到96孔板后,将扩增板放入离心机中离心,放入Light Cycler480 PCR仪,选择预定程序进行扩增。选取18S作为内参基因,计算长链脂酰辅酶A合成酶4(long-chain acyl-coa synthetase,ACSL
4)和前列腺素内过氧化物酶2(prostaglandin-endoperoxide synthase,ptgs
2)、转铁蛋白受体 1(transferrin receptor 1,TFR
1)、铁调素调节蛋白(hemojuvelin,HJV
)、转铁蛋白受体 2(transferrin receptor 2,TFR
2)、铁调节蛋白1(iron regulatory protein,IRP
1)和18S核糖体RNA(18S ribosomal RNA,18S
)基因的相对表达水平。引物序列如表1所示。
表1 基因的引物序列

2 结果
2.1 fer-1处理对APAP诱导的ALI小鼠的生存率的影响
生存实验结果如图1所示,APAP处理后仅10%的小鼠在第7天处于存活状态。NAC处理后的小鼠存活率提高到70%,而fer-1预处理和后处理与NAC后处理相比,小鼠的存活率进一步提高到90%和80%。采用Kaplan-Meier法分析数据,fer-1预处理和后处理与NAC后处理组相比,生存率都得到了提升(P
<0.05,F
=19.32),表明fer-1与NAC相比,可能治疗效果更佳。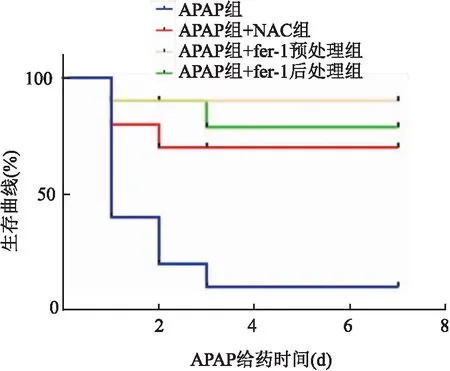
图1 fer-1处理对APAP诱导的急性肝损伤小鼠生存率的影响
2.2 fer-1预处理对APAP诱导的ALI小鼠肝重系数的影响
结果如图2所示,与APAP(0 h)组相比,单纯注射fer-1对小鼠的肝重系数差异无统计学意义;与APAP(0 h)组相比,单纯APAP处理的各组中给予APAP 4、24 h后,小鼠的肝重系数均有所升高(P
<0.05,F
=3.222);与单纯APAP处理各组相比,fer-1预处理在4 h时小鼠肝脏系数降低(P
<0.05,t
=2.466),24 h时小鼠肝脏系数也降低(P
<0.05,t
=3.272)。
图2 各组小鼠肝重系数与APAP(0 h)组比较:*P<0.05;与APAP(4 h)组比较:#P<0.05;与APAP(24 h)组比较:&P<0.05
2.3 fer-1预处理对APAP诱导的ALI小鼠肝细胞坏死情况的影响
结果如图3所示,与APAP(0 h)组相比,单纯注射fer-1对小鼠肝脏组织没有明显的毒副作用;与APAP(0 h)组相比,单纯APAP处理的1、4、24 h组随着APAP注射时间的增加,小鼠肝脏组织中的炎症浸润区域和组织坏死面积也增加(P
<0.01,F
=254.9);与单纯APAP组相比,fer-1预处理对APAP造成的小鼠肝脏组织的炎性浸润和组织坏死有一定的改善作用,APAP处理24 h时炎症浸润区域和组织坏死面积下降,治疗效果明显(P
<0.01,t
=11.12)。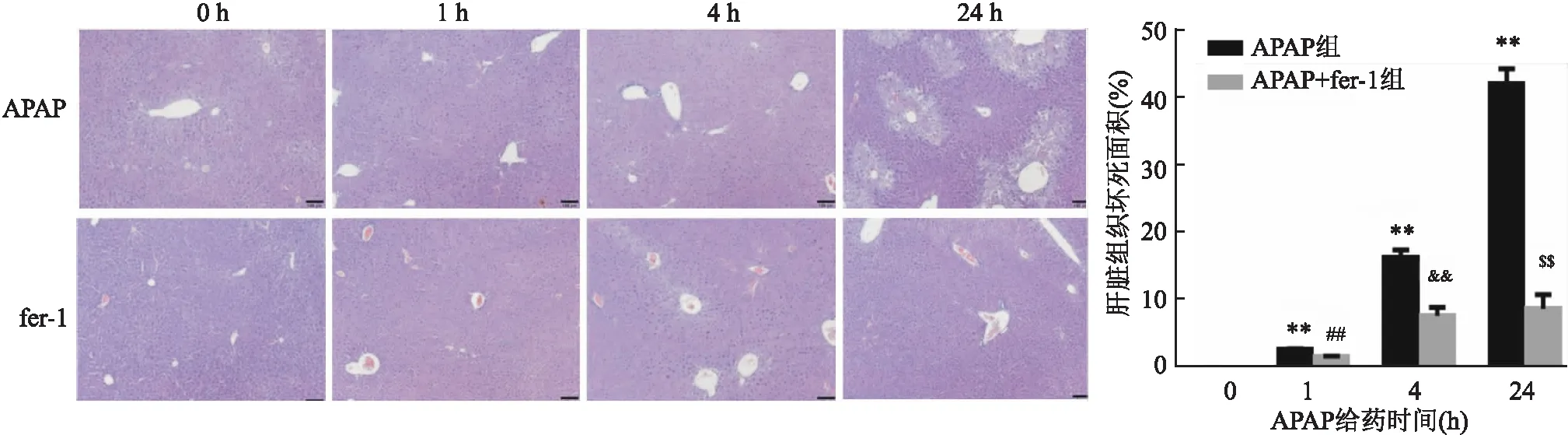
图3 各组小鼠肝脏组织H&E染色以及组织坏死面积 ×100与APAP(0 h)组比较:**P<0.01;与APAP(1 h)组比较:##P<0.01;与APAP(4 h)组比较:&&P<0.01;与APAP(24 h)组比较:$$P<0.01
2.4 fer-1预处理对APAP诱导的ALI小鼠肝功能的影响
检测结果如表2所示,fer-1对小鼠的肝功能并没有影响;与APAP(0 h)组相比,给予了APAP的各组小鼠各项肝功能指标均发生了较为明显的改变,各时间点小鼠血清中的ALT、AST随之增加,在24 h达到最高远超正常水平且差异有统计学意义(P
<0.01,F
= 144),与单纯APAP处理组相比,使用fer-1预处理组小鼠的血清ALT和AST在各个时间点均有所降低,在24 h时下降水水平最明显,接近正常水平,治疗效果明显(P
<0.01,t
=13.11)。
表2 各组小鼠血清中ALT、AST水平
2.5 fer-1预处理对APAP诱导的ALI小鼠肝脏
中MDA水平的影响
结果如图4所示,与APAP(0 h)组相比,单独给予fer-1并不影响小鼠肝脏组织中MDA的水平;与APAP(0 h)组相比,单纯给予APAP后1、4 h时,小鼠肝脏MDA水平有所上升(P
<0.05,F
=5.87),到24 h时恢复至正常水平;与同一时点的单纯APAP组相比,fer-1预处理1、4 h时,小鼠肝脏MDA水平降低,1 h时最明显(P
<0.05,t
=2.683),到24 h时基本恢复至正常水平。
图4 各组小鼠肝脏组织MDA水平与APAP(0 h)组比较:*P<0.05;与APAP(1 h)组比较:#P<0.05;与APAP(4 h)组比较:&P<0.05
2.6 fer-1预处理可降低APAP诱导的ALI小鼠铁死亡相关基因的表达
采用RT-PCR实验检测fer-1预处理后各组小鼠铁死亡相关基因ACSL
4和ptgs
2的表达变化。如图5所示,与APAP(0 h)组相比,单纯APAP处理组给予APAP 4、24 h后,铁死亡标志基因ACSL
4和ptgs
2在小鼠肝脏组织中的表达水平升高(P
<0.05,F
=8.133);与单纯APAP处理组相比,fer-1预处理在4、24 h组小鼠肝脏组织中的ACSL
4和ptgs
2的表达降低,4 h时有统计学意义(P
<0.05,t
=4.098),提示fer-1预处理可以降低APAP诱导的小鼠肝脏组织中铁死亡相关基因ACSL4和ptgs2的高表达。
图5 各组小鼠肝脏组织铁死亡相关基因的表达与APAP(0 h)组比较:*P<0.05;与APAP(4 h)组比较:#P<0.05;与APAP(24 h)组比较:&P<0.05
2.7 fer-1预处理可改善APAP诱导的ALI小鼠铁代谢紊乱
采用RT-PCR实验检测fer-1预处理4、24 h后各组小鼠肝脏中铁代谢相关基因转铁蛋白受体 1(TFR
1)、铁调素调节蛋白(HJV
)、转铁蛋白受体 2(TFR
2)和铁调节蛋白1(IRP
1)的表达变化。如图6所示,与APAP(0 h)组相比,单纯给予fer-1对小鼠肝脏组织中TFR
1、HJV
、TFR
2和IRP
1的表达差异无统计学意义;与APAP(0 h)组相比,单纯APAP处理组给予APAP 4、24 h后,小鼠肝脏组织中的TFR
1、HJV
、TFR
2和IRP
1的表达异常,差异有统计学意义(P
<0.05),与同一时点的单纯APAP组相比,fer-1预处理在4、24 h组改善了小鼠肝脏组织中TFR
1、HJV
、TFR
2和IRP
1的表达异常,差异有统计学意义(P
<0.05),提示fer-1预处理可以改善APAP诱导的ALI小鼠肝脏组织中铁代谢紊乱。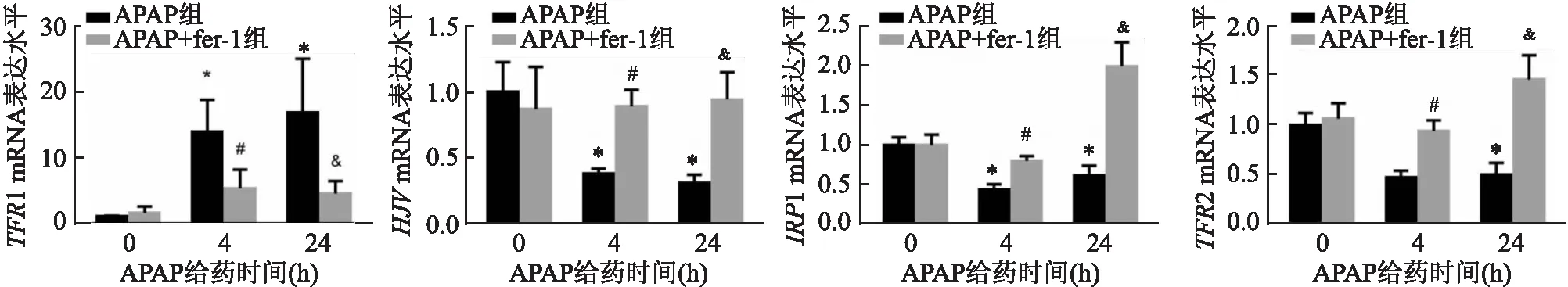
图6 各组小鼠肝脏组织铁代谢相关基因的表达与APAP(0 h)组比较:*P<0.05;与APAP(4 h)组比较:#P<0.05;与APAP(24 h)组比较:&P<0.05
3 讨论
APAP过量诱导的肝毒性的具体机制目前尚不完全清楚,其主要涉及氧化应激和炎症反应,从而引起各种形式的肝细胞死亡。因此,确定细胞死亡的可能机制对于临床上治疗APAP过量引起的ALI乃至肝衰竭有着重要意义。
本实验首先采用阳性对照药NAC与fer-1分别处理APAP诱导的ALI小鼠,观察fer-1预处理和后处理对小鼠生存率的影响,并且与NAC作比较,结果显示与NAC预处理相比,fer-1无论是预处理还是后处理,均能提高小鼠的生存率。病理观察、肝脏系数和ALT、AST结果均表明,fer-1预处理可以减轻APAP诱导的ALI。
铁死亡抑制剂在铁死亡中的作用主要是改善铁代谢和降低细胞内的脂质过氧化水平。先前的研究表明ACSL
4和ptgs
2是标志铁死亡发生的重要标志物。该实验结果显示APAP各组中的ACSL
4和ptgs
2表达上升,而使用fer-1预处理后,升高的ACSL
4和ptgs
2水平降低。这些结果提示铁死亡在APAP诱导的急性肝损伤中可能确实发挥着部分作用,并且铁死亡抑制剂fer-1预处理具有一定的保护作用。肝脏铁过载引起细胞内铁水平的增加,这增强了APAP过量诱导的急性肝损伤作用,也加剧了氧化应激反应。铁调素是肝脏内分泌的调节铁稳态的蛋白,报道表明,HJV和TFR2是铁调素表达的重要调节因子。而TFR2在肝中表达时可以与HJV相互作用,发挥诱导铁调素转录的作用。该研究结果显示,在小鼠接受APAP处理后,HJV
和TFR
2的 mRNA水平均有不同程度的降低,这可能与 APAP诱导的氧化应激有关。研究表明,细胞内铁稳态的关键介质是铁调节蛋白/铁反应元件(IRP / IRE)系统,该系统包括 IRP1/IRP2和储存铁蛋白等。该研究表明,APAP过量处理后小鼠肝脏IRP1的转录水平降低。当细胞内铁过多时,IRP1与 IRE 的结合活性就会降低,从而引起铁蛋白 mRNA 的翻译,促使过多的细胞内铁进行储存。这些结果提示,过量服用 APAP的确对肝脏铁稳态有一定影响。综上所述,该研究表明新型细胞死亡方式铁死亡与APAP诱导的小鼠ALI的发生发展有关。此外,铁死亡抑制剂fer-1可以防治 APAP过量引起的ALI。fer-1 对 APAP诱导的ALI的保护作用一方面可能由于其特定的自由基清除能力,同时还可能与其对肝脏铁代谢功能障碍的改善有关。因此,铁死亡抑制剂可能是APAP过量引起小鼠ALI的有效解毒剂,并且可能在未来应用于APAP过量引起的ALI的临床治疗。
