成像流式细胞术在检测巨噬细胞吞噬肿瘤细胞中的应用
2021-11-09方亦龙韩大飞檀学文蒋海峰涂佳杰
方亦龙,韩大飞,檀学文,许 振,蒋海峰,涂佳杰,魏 伟
经典流式细胞检测技术可以从细胞分子水平上通过抗原-抗体特异性结合原理对单个细胞或亚细胞层面进行精准、快速的高通量定量分析。该技术可以在短时间内分析成千上万个细胞,获得每个细胞的散射光信号和荧光信号,从而得到细胞群体的各种统计数据。目前,经典流式细胞术利用Cytomics FC500型流式细胞仪等设备可用于检测巨噬细胞吞噬肿瘤细胞的能力,但缺少相关的细胞形态、细胞结构和亚细胞水平信号分布的信息。而成像流式细胞术是一种新型检测技术,不仅具有经典流式细胞术的特点,还可实现单个细胞高分辨率的数字成像及细胞的可视化,获得细胞形态学、胞内分子分布、细胞间信号转导和细胞状态的变化等数据信息,包括细胞间相互作用、吞噬、凋亡、自噬、核易位和形态变化等。该实验运用成像流式检测技术,以miR-22对巨噬细胞吞噬胶质瘤细胞的影响作为检测指标,与经典流式细胞术进行比较,为检测肿瘤细胞的吞噬能力提供新的方法。
1 材料与方法
1.1 材料
1
.1
.1
细胞株 小鼠单核巨噬细胞RAW264.7和小鼠胶质瘤细胞GL261购自中国科学院细胞库。1
.1
.2
试剂与仪器 DMEM高糖培养基、DMEM-F12培养基、磷酸盐缓冲液(phosphate buffered saline,PBS)、胎牛血清(fetal bovine serum,FBS)购自美国BI公司;胰蛋白酶、青-链霉素购自上海碧云天生物技术研究所;lipofectamine 2000购自美国Thermo Fisher公司;miR-22 mimics、阴性对照mimics(NC mimics)由上海吉玛制药技术有限公司合成;荧光染料CFSE购自上海贝博生物科技有限公司;CD11b-VioBlue购自德国Miltenyi Biotec公司;Cytomics FC500流式细胞仪购自美国贝克曼公司;ImageStreamX Mark Ⅱ成像流式细胞仪购自德国默克密理博公司;SIGMA 3-30 K低温高速离心机购自上海纳腾仪器有限公司。1.2 方法
1
.2
.1
细胞培养 将小鼠单核巨噬细胞RAW264.7、小鼠胶质瘤细胞GL261置于37 ℃、5% CO恒温培养箱中培养,并用含有10%FBS和1%青-链霉素的培养基进行换液、传代。当培养瓶中细胞密度长至80%左右时开始进行相关实验。1
.2
.2
细胞转染 以1×10/ml的密度将RAW264.7细胞接种于6孔板中,待细胞贴壁后设为对照组(NC mimics组)和miR-22 mimics组。当融合率达80%时,按照lipofectamine2000说明书进行转染。转染48 h用于后续实验。1
.2
.3
流式细胞术检测吞噬 GL261细胞在培养瓶中消化,用染色工作液重悬,至细胞浓度大约1×10个/ml,在37 ℃培养箱孵育20 min后离心收集细胞。RAW264.7细胞与CFSE标记的GL261细胞在37 °C、5%CO湿润环境中按3 ∶1的比例混合培养6 h,后将细胞重悬于100 μl PBS中,并在4 °C下用抗小鼠CD11b标记40 min。洗涤细胞,重悬于100 μl PBS中,用Cytomics FC500流式细胞仪进行检测。每个检测指标设3个复管,重复3次。1
.2
.4
成像流式细胞术检测吞噬 细胞处理同上,用ImageStreamX Mark Ⅱ成像流式细胞仪进行检测。吞噬比例分析:首先对单阳性样本进行软件自动荧光补偿,选择分析吞噬所需的智能模块(内化),设定标记RAW264.7细胞(Ch07)和GL261细胞(Ch02)的检测通道,通过调整对焦好的单个细胞,将RAW264.7细胞作为核转位分析对象,GL261细胞(Ch02)设定为阳性的细胞群,软件自动划定吞噬GL261的细胞并计算统计结果。每个检测指标设3个复管重复3次。1.3 统计学处理
相关性分析采用线性回归和2个配对样本的非参数检验。一致性评价采用Bland-Altman法,绘制Bland-Altman图的横坐标(Average)为(Mark Ⅱ+FC500)/2, 纵坐标(Bias)为(Mark Ⅱ-FC500)/[(Mark Ⅱ+FC500)/2]。组间比较采用t
检验,以P
<0.05为差异有统计学意义。2 结果
2.1 两种流式细胞术检测巨噬细胞吞噬能力
2
.1
.1
经典流式细胞术检测巨噬细胞吞噬能力的情况 为了观察经典流式细胞术检测效果,利用Cytomics FC500流式细胞仪检测RAW264.7细胞吞噬GL261细胞的情况,结果如图1所示,在散点图中,PB450单阳为CD11b标记的单个巨噬细胞,FTTC单阳为CFSE标记的胶质瘤细胞,双阳为吞噬完成的巨噬细胞和胶质瘤细胞。与对照组比较,miR-22 mimics组RAW264.7细胞吞噬肿瘤细胞能力增加, 差异有统计学意义(t
= 5.291,P
<0.05)。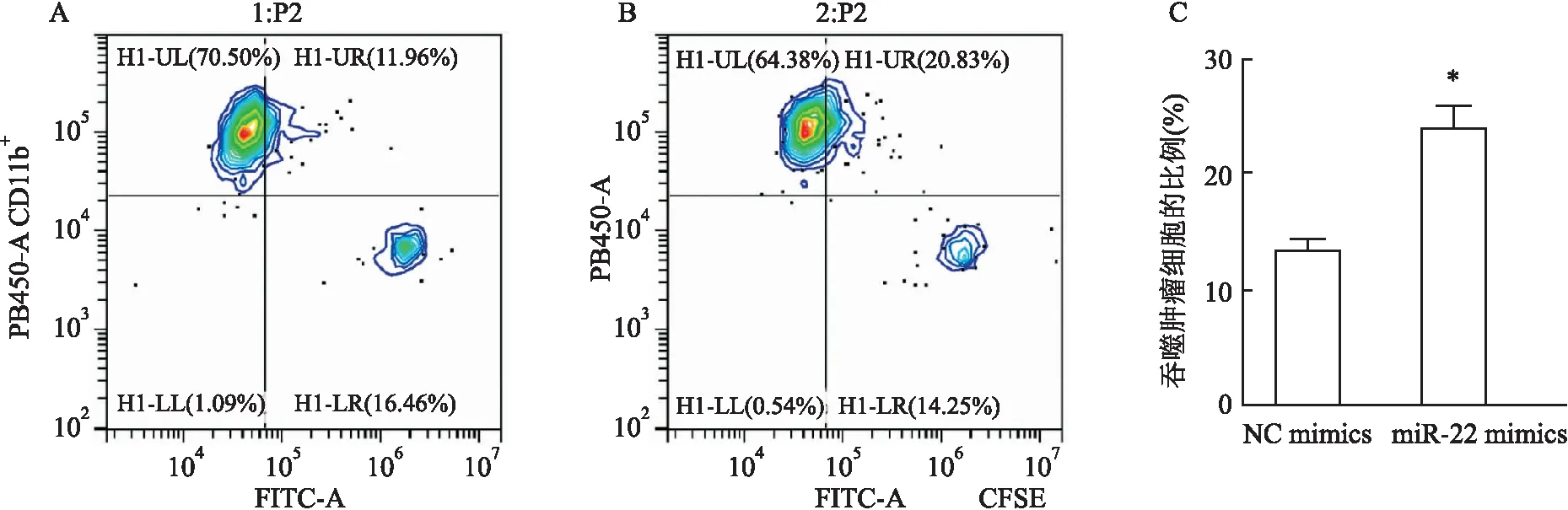
图1 经典流式细胞术检测RAW264.7细胞吞噬GL261细胞的情况A:NC mimics组吞噬GL261细胞的比例;B:miR-22mimics组吞噬GL261细胞的比例;C:RAW264.7细胞转染NC mimics和miR-22 mimics之后吞噬GL261细胞比例的统计图;与NC mimics组比较:*P<0.05
2
.1
.2
成像流式细胞术检测巨噬细胞吞噬能力的情况 为了观察成像流式细胞术检测效果,利用ImageStreamX Mark Ⅱ成像流式细胞仪检测RAW264.7细胞吞噬GL261细胞的情况,结果如图2。调整聚焦好的单个细胞见图2A,将RAW264.7细胞作为核转位分析对象,GL261细胞(Ch02)设定为阳性的细胞群见图2B,软件自动划定吞噬GL261的细胞并计算统计结果,见图2C-2E。与对照组比较,miR-22 mimics组RAW264.7细胞吞噬肿瘤细胞能力增加(t
=9.720,P
<0.05),差异有统计学意义,与经典流式细胞术的结果一致。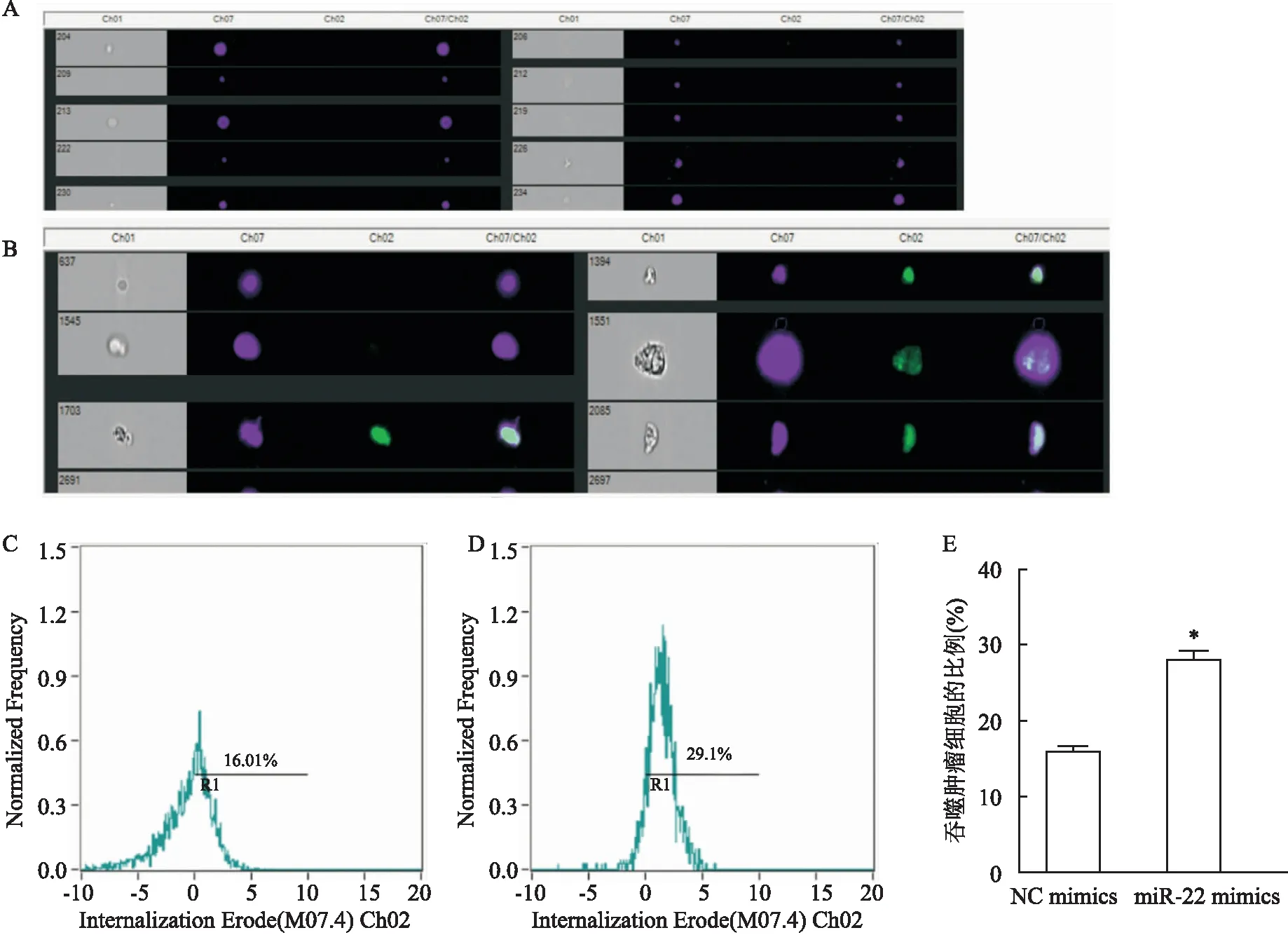
图2 成像流式细胞术检测RAW264.7细胞吞噬GL261细胞的情况(n=3)A:聚焦好的单个细胞;B:RAW264.7细胞设定为核转位分析对象(Ch07),GL261细胞(Ch02)设定为阳性的细胞群;C:NC mimics组吞噬GL261细胞的比例;D:miR-22mimics组吞噬GL261细胞的比例;E:RAW264.7细胞转染NC mimics和miR-22 mimics之后吞噬GL261细胞比例的统计图;与NC mimics组比较:*P<0.05
2
.1
.3
相关性和一致性 为了观察经典流式细胞术和成像流式细胞术检测巨噬细胞吞噬能力的相关性和一致性,利用Cytomics FC500流式细胞仪和ImageStreamX Mark Ⅱ成像流式细胞仪检测RAW264.7细胞转染NC mimics和miR-22 mimics之后吞噬GL261细胞的结果。结果的判定系数R均大于0.8,斜率在1.154~1.457,截距在2.434~-1.135之间,Z值分别为-3.824和-3.724,P
<0.05,相关性良好,见表1。Bland-Altman分析显示, 两种方法检测RAW264.7细胞转染NC mimics和miR-22 mimics之后吞噬GL261细胞的百分比的偏倚分别为4.289%和8.073%,偏倚的标准差分别为0.493 6%和0.711 5%,95%一致性界限分别为(3.321%,5.256%)和(6.679%,9.468%),Bland-Altman图如图3所示,一致性界限范围较窄。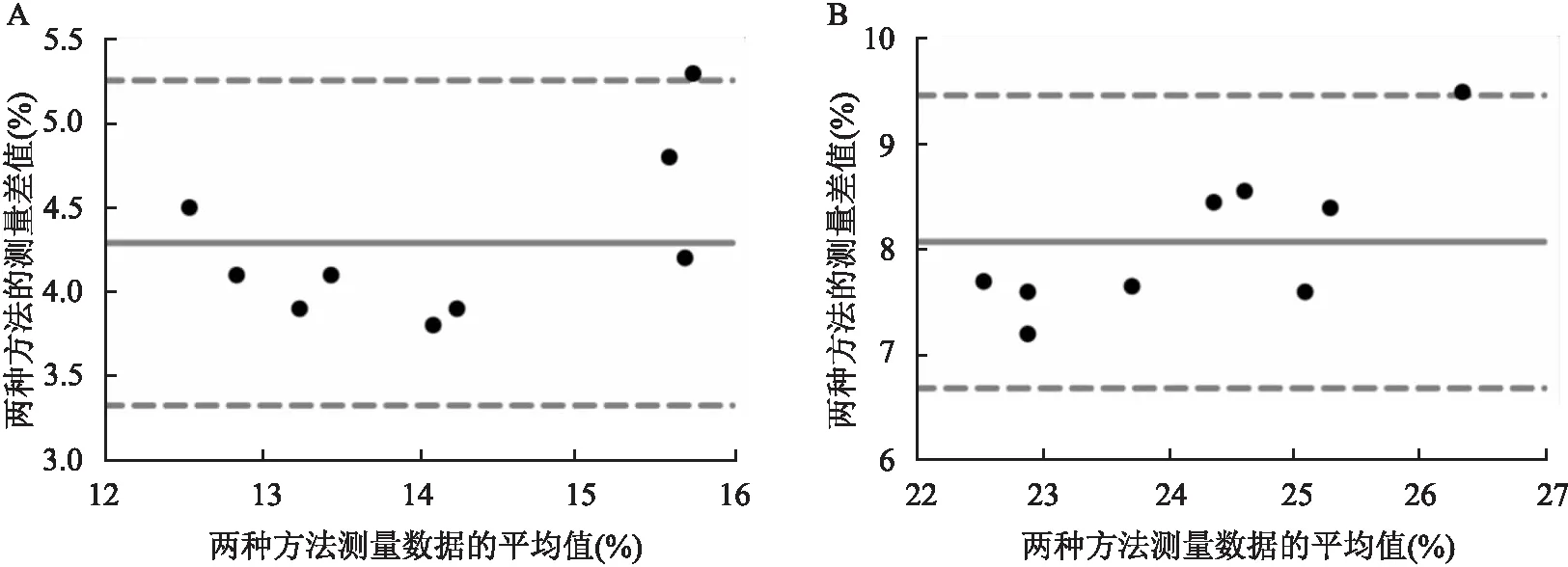
图3 经典流式细胞术和成像流式细胞术检测RAW264.7细胞转染NC mimics和miR-22 mimics之后吞噬GL261细胞比例的偏倚值图A:经典流式细胞术和成像流式细胞术检测RAW264.7细胞(NC mimics组)吞噬GL261细胞比例的偏倚值;B:经典流式细胞术和成像流式细胞术检测RAW264.7细胞(miR-22mimics组)吞噬GL261细胞比例的偏倚值

表1 经典流式细胞术和成像流式细胞术检测技术的相关性分析(n=3)
2.2 成像流式细胞术观察RAW264.7细胞对GL261细胞进行吞噬的过程
与经典流式细胞术不同的是,成像流式细胞术可以结合图像清晰地观察到巨噬细胞对肿瘤细胞的吞噬过程,适用于需要对吞噬过程准确研究的实验。利用ImageStreamX Mark Ⅱ成像流式细胞仪观察巨噬细胞吞噬肿瘤细胞的过程,如图4所示:绿色荧光标记的是GL261胶质瘤细胞,紫色荧光标记的是RAW264.7巨噬细胞。未吞噬胶质瘤细胞的单个巨噬细胞代表图见图4A,吞噬完成的巨噬细胞和胶质瘤细胞代表图见图4B。图4C可见巨噬细胞正在进行吞噬过程的细胞图像,可见巨噬细胞与胶质瘤细胞之间吞噬杯的形成。
图4 成像流式细胞术观察RAW264.7细胞对GL261细胞进行吞噬的过程A:未吞噬胶质瘤细胞的单个巨噬细胞代表图;B:吞噬完成的巨噬细胞和胶质瘤细胞代表图;C:巨噬细胞正在进行吞噬过程的细胞图像
3 讨论
通过吞噬作用这一过程,巨噬细胞能够捕获和消除转化的恶性细胞,并将肿瘤来源的抗原呈递给T细胞并激活下游的适应性免疫应答。近年来肿瘤的免疫治疗取得了巨大的进步,通过体外基因编辑技术重新唤醒巨噬细胞对肿瘤细胞毒性作用从而对肿瘤起到治疗效果。本实验利用两种不同流式细胞技术检测miR-22对巨噬细胞吞噬胶质瘤细胞的影响,同时获取细胞图像,为进一步评价miR-22对提升吞噬细胞吞噬肿瘤细胞的能力以及更好地选择实验方法提供依据。
从实验结果可以看出,经典流式细胞术和成像流式细胞术检测巨噬细胞吞噬能力的相关性和一致性较好,但两者结果差异有统计学意义 (P
<0.05)。除了人为的操作原因外,也可能是由于使用不同的仪器和不同的配套试剂所致。不过在实验过程中,由同一人在同样操作下上机检测,注意样本的充分混匀、适合的样本抗体比例、正确的设门分析和适当的电压补偿调节等细节因素,两种方法测得百分比结果的差异可以控制在较小范围内。经典流式细胞术因其具有上样速度快(上机时间平均只需1 min)、操作简单并适用多种标本的检测等优点,应用广泛。然而,对于这种经典流式细胞术,细胞只是散点图上的一个点,而不是真实的细胞图像,并且缺少相关的细胞形态、细胞结构和亚细胞水平信号分布的信息,因此局限于不要求细胞结构的分析;并且细胞圈门以及荧光强度的调节需要专业人员调试后方可使用,其结果受到人为操作因素影响较大。成像流式细胞术因其操作简便,获取信息多,是近年来快速发展的新型流式细胞技术,它建立在传统的流式细胞术基础之上,结合了荧光显微成像技术,具有多个检测通道,可以对通过流动室中的每个细胞进行成像,实现了对细胞图像进行多参数量化分析,获得全新的细胞形态统计学数据。虽然上样速度慢于经典流式细胞术,每管平均时间需3 min,并且选用的洗液为无钙、镁离子的PBS,需要更高的成本,但成像流式细胞分析仪的优点很多:使用简单,无需专用耗材,直接在机器上用1.5 ml离心管,不需要使用专用的流式管;检测和分析方案建立方法操作简单易学;可自动调节荧光强度,电压补偿可在检测完成后调整;细胞用量很少,上样体积只需20~200 μl即可,可适用于样本细胞较少或者珍贵样本的流式检测;样本利用率和回收率很高,上样过后的细胞仍可以回收用于其他实验如提蛋白或者提RNA等;特别重要的是,通过成像技术在分析数据时,可区分假阳性细胞,提高样本检测的正确率。因此对于吞噬细胞对肿瘤细胞或者病原体吞噬的研究,如只需要对吞噬统计学结果进行分析,选择上样简单、速度快的经典流式细胞术即可,如需要对吞噬过程准确研究或者样本量稀少的实验可选择成像流式术。成像流式既能提供细胞群的统计数据,又可以结合图像清晰观察到巨噬细胞对肿瘤细胞的吞噬过程,有望在吞噬能力的分析和观察中得到更为广泛的关注。综上,成像流式细胞术可在同等操作下获得更多实验结果,但实验仪器的选择还要取决于具体的实验条件、实验目的、检测指标等要求。
