浓香型白酒酿造环境中酵母的筛选及其组合发酵特性
2021-11-08管桂坤万自然刘明坤
刘 宇,管桂坤,万自然,袁 宁,刘明坤,左 翔
(山东兰陵美酒股份有限公司,山东临沂 277731)
浓香型白酒在窖内的发酵依赖于环境、大曲、窖泥中各种微生物的共同参与,经过微生物的代谢和复杂的生化反应形成了以己酸乙酯为主体复合香的香味物质,赋予浓香型白酒“窖香浓郁、绵甜爽冽、香味协调、尾净味长”的特点。浓香型原酒中的香味成分主要来源于酯类物质,主要包括己酸乙酯、乙酸乙酯、乳酸乙酯和丁酸乙酯等,四大酯的含量及其量比关系决定了浓香型白酒的品质和风格[1]。近几年,大多数酒企出现浓香型原酒中乙酸乙酯不同程度偏高的问题,造成己乙比失调或者严重失调,闻香香气欠正、带有青干气、味短且平淡,严重影响了后期勾调,成为白酒行业亟待解决的重要问题。目前,浓香型白酒中乙酸乙酯的相关研究主要集中在从理论和实践生产上探究引起浓香型原酒乙酸乙酯含量偏高的主要原因以及解决办法[2-5]。
白酒的酿造属于“多微共酵”的过程,涉及到复杂的微生物相互作用以及生理生化反应过程,常规的单菌培养并不能呈现出白酒实际生产中真实的微生物代谢情况。因此,组合发酵方式成为研究白酒酿造微生物功能的有力工具[6-7]。本研究从浓香型白酒酿造环境中分离筛选了3 株酵母,经分子生物学鉴定后进行了组合发酵特征研究,从微生物的角度解析了浓香型白酒中乙酸乙酯偏高的内在原因,这为解决白酒行业中己乙比失调的问题提供了新思路,有利于浓香型白酒的高质量发展。
1 材料与方法
1.1 材料、试剂及仪器
微生物筛选样品取自山东兰陵美酒股份有限公司浓香型白酒生产车间大曲、酿酒工具、空气,酿酒工具采用样本无菌脱脂棉预湿法进行采样,空气样本采用无菌脱脂棉鼓风附着法和自然沉降法采样。采样结束后将脱脂棉置于无菌自封袋中4 ℃冷藏储存。
酵母筛选培养基选用WL 合成培养基,青岛海博生物;青霉素,山东鲁抗;酵母保藏培养基采用YPD 培养基;PCR 产物回收、纯化、质粒的提取等DNA 操作试剂盒购自大连生物工程(大连)有限公司;酵母26S rDNA 序列鉴定委托上海生工生物工程有限公司进行;酵母发酵糖液为10°Bx高粱汁培养基;淀粉酶和糖化酶购自无锡雪梅。
仪器设备:美国伯乐PCR 仪,北京百晶电泳仪和凝胶成像分析仪,YXQ-LS-75SN 立式压力蒸汽灭菌锅,JHT-系列净化工作台,MJX-280S 智能霉菌培养箱,FLY-211C 恒温振荡培养箱,安捷伦7890A气相色谱仪,上海谱元A-1502分光光度计。
1.2 试验方法
1.2.1 酵母的筛选
将采集的筛选样品加入生理盐水振荡3 min,取上清液用无菌水将其稀释至10-1~10-5等系列梯度,分别吸取200 μL 各样本梯度稀释菌液涂布于WL 合成培养基,30 ℃恒温培养2~3 d 进行初筛。然后选取不同菌落形态的酵母,采用平板划线法进行复筛。获得酵母纯培养后,接入YPD 培养基保藏备用。
1.2.2 酵母的分子生物学鉴定
以经NaOH 破壁提取的酵母DNA 为模板[8],以26S rDNA-D1/D2区域的通用引物为扩增引物进行PCR 扩增,得到酵母26S rDNA-D1/D2 区域的基因,经纯化后送至上海生工生物工程有限公司测序。将酵母的26S rDNA-D1/D2 基因序列测序结果通过在线数据库BLAST 进行序列比对,比对结果用MEGA5.0 软件进行同源性分析,并采用邻位相连法构建系统发育树。
1.2.3 酵母生长曲线的绘制
将酵母在无菌条件下接入YPD 液体培养基,30 ℃恒温150 r/min 培养48 h,然后每隔一段时间取样,以未接种酵母的液体培养基为空白对照,在600 nm 处测定其吸光度,测定值控制在0.1~0.9 之间。如果菌悬液太浓,可适当稀释。最后,以时间为横坐标,吸光值为纵坐标,绘制酵母的生长曲线。
1.2.4 发酵醪微量组分分析
量取25 mL 发酵醪于250 mL 锥形瓶中,加入无水乙醇100 mL 浸提15 min,旋涡振荡5 min。然后将浸提液用双层纱布过滤至500 mL 烧杯中,并用100 mL 去离子水分数次充分洗涤锥形瓶、烧杯、纱布,滤液与洗液全部倒入1000 mL 蒸馏瓶中,用100 mL 容量瓶接收馏出液(外用冰水浴),缓慢加热蒸馏,当馏出液接近刻线时,取出容量瓶,调液温20 ℃,用去离子水定容,混匀后用气相色谱法[9]检测微量组分。
2 结果与分析
2.1 酵母菌株的筛选及菌落形态
经过分离纯化和菌落形态的初步鉴定共获得3株酵母,分别命名为J1、J2和J3,其菌落形态特征如表1 所示。由3 株酵母菌株的形态特征可以初步判定:筛选得到的酵母形态特征差别较大,种属的分类地位各不相同。

表1 浓香型白酒车间3株酵母菌株的菌落形态特征
2.2 酵母菌株的分子生物学鉴定
为了进一步确定J1、J2、J3 的种属地位,对其进行了分子生物学鉴定。经测序表明,研究中J1、J2、J3 获得26S rDNA-D1/D2 部分片段大小分别为621 bp、606 bp、625 bp。通过BLAST同源序列比对表明J1、J2、J3 基因分别与Debaryomyces hansenii(GenBank:KC848298.1)、Pichia fermentans(Gen-Bank:KM589468.1)、Naumovozyma castellii(Gen-Bank:KY108659.1)同源性最高。利用邻接法构建系统进化树(图1),结合3 株酵母的形态学特征对其做进化树聚类分析,最终将J1、J2、J3 分别鉴定为汉斯德巴氏酵母菌(D.hansenii,Dh)、发酵毕赤酵母(P.fermentans,Pf)、卡斯特瑙曼氏酵母(N.castellii,Nc)。

图1 采用邻接法构建3株酵母的系统发育树
2.3 酵母的生长规律分析
采用分光光度法绘制3 株酵母的生长曲线(图2),结果表明:3 株酵母迟缓期差别不大,在培养48 h 后均能达到稳定期;Dh 和Pf 生长速度较快,稳定期菌体浓度较大;Nc 生长速度一般,稳定期菌体浓度较低,进入衰亡期时间较早。

图2 3株酵母的生长曲线
2.4 酵母的纯种发酵规律分析
将培养好的Dh、Pf 和Nc 种子液按照1.0×105cfu/mL 接种于10 °Bx 高粱汁培养基中发酵,30 ℃恒温静置培养4 d 后得到3 株酵母的发酵醪微量组分。根据表2 可知,Pf 产乙酸乙酯能力明显高于Dh 和Nc,Dh 产乙酸乙酯能力最低,Dh、Pf 和Nc产有机酸和醇类物质差别不明显。
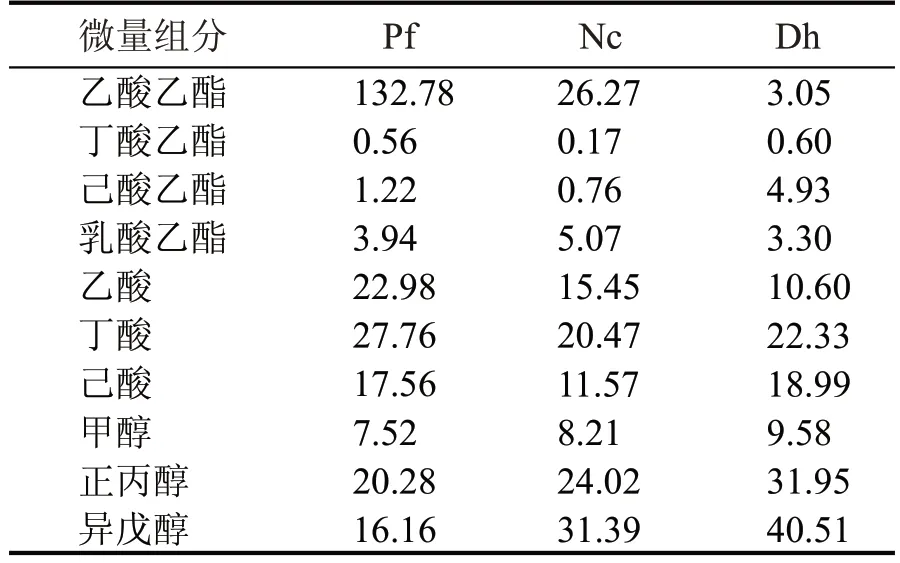
表2 3株酵母发酵醪中主要的微量组分对比
2.5 酵母的组合发酵规律解析
考虑到Pf 产乙酸乙酯与Dh、Nc 的差异性以及Dh、Pf 和Nc 生长的规律性设计了如表3 所示的酵母组合发酵试验。表3 中1.0×105cfu/mL 为1 个比例单位,比如P10N 试验中Pf 的发酵起始浓度控制为1.0×106cfu/mL,其他组合亦然。
将培养好的Pf、Nc 和Dh 种子液按照表3 中的比例关系接种于10 °Bx 高粱汁培养基中发酵,30 ℃恒温静置培养,期间取样分析酵母的群体生长情况和发酵醪微量组分,结合图3 和表4 得到了3株酵母的组合发酵规律。

表3 3株酵母的组合发酵试验设计
在发酵初始阶段(0~1 d),Pf 迅速生长起来,乙酸和乙酸乙酯同步积累;根据PN、PD、PND 组合发酵结果来看Pf 生长受Nc 和Dh 抑制明显,进而影响到初始阶段乙酸和乙酸乙酯的积累(图3d、图3e、图3g),其中PND 组合乙酸乙酯的初始合成量减少80.18%;增加Pf 接种量后乙酸乙酯积累量明显增加,其中P100ND 组合乙酸乙酯的初始合成量是PND 组合的3.40 倍;另外,Nc 和Dh 在此阶段也迅速生长起来,结合3N、3D、ND 组发酵结果来看Nc和Dh的生长此阶段都受到了不同程度的抑制。发酵中期(1~3 d),Pf 继续生长繁殖,乙酸和乙酸乙酯的变化趋势出现差别;根据PN、PD、PND 组合发酵结果来看Nc 和Dh 对Pf 生长的抑制作用逐渐减弱,乙酸乙酯积累持续增加(图3d、图3e、图3g),其中PND 组合3 d 时乙酸乙酯的积累量与3P 组相当(占3P 组79.86%),乙酸的积累受多种因素影响规律性不明显;增加Pf 接种量后乙酸乙酯积累量增加明显,其中P100ND 组合3 d 时乙酸乙酯的积累量是PND 组合的2.12 倍;另外根据3N、3D、ND组发酵结果来看,Dh生长受Nc抑制很小。

图3 3株酵母发酵醪中乙酸和乙酯乙酯的动态变化
发酵后期(3~4 d),由于营养物质匮乏等诸多不利因素Pf 生长缓慢或进入衰亡期,乙酸乙酯积累速度放缓,PN、P10N 和P100N 组合乙酸乙酯积累量增加明显;根据PN、PD、PND 组合发酵结果来看Dh对Pf 后期积累乙酸乙酯影响明显,Nc 对Pf 发酵后期影响较小,结合表4 群体生长情况推断Dh对Pf 发酵后期属于代谢物抑制;增加Pf 接种量后P10ND 和P100ND 乙酸乙酯积累量增加较小,其中P100ND组合发酵后期乙酸乙酯的积累量仅仅增加8.36 mg/L,Dh 对Pf 后期积累乙酸乙酯的抑制作用明显。

表4 3株酵母发酵醪中群体生长情况(×107 cfu/mL)
3 结论
3.1 通过26S rDNA-D1/D2 同源比对构建系统发育树结合形态学特征将浓香型白酒酿造环境中筛选出的3 株酵母鉴定为发酵毕赤酵母(P.fermentans)、卡斯特瑙曼氏酵母(N.castellii)和汉斯德巴氏酵母菌(D.hansenii)。
3.2 发酵毕赤酵母Pf是1株高产乙酸乙酯的酵母,汉斯德巴氏酵母菌Dh对Pf积累乙酸乙酯的抑制作用明显高于卡斯特瑙曼氏酵母Nc 对Pf 的抑制作用,Dh 对Pf 发酵产乙酸乙酯属于代谢物抑制;提高Pf接种量可以适当提高乙酸乙酯的积累水平。
3.3 通过群体生长情况发现Pf 和Dh 生长受Nc 的抑制作用很小,Nc 生长受Pf 和Dh 抑制作用明显;结合酵母组合发酵确定了3 株酵母的种群关系,即Pf为优势种群,Dh次之,Nc为劣势种群。
3.4 浓香型白酒中乙酸乙酯偏高的内在原因是酵母的种群结构失调,造成毕赤酵母等高产乙酸乙酯的酵母种属大量增殖,该属酵母具有较强的种群生长优势。
本研究从酵母组合发酵和种群关系的角度出发分析乙酸乙酯偏高的内在原因,还未涉及到浓香型白酒生产和发酵过程中微生物种群结构分析,有待于进一步的研究。
