芒柄花素-3′-磺酸钠对胶原性类风湿关节炎的治疗作用及其机制
2021-11-07史文杏曲桂武周凤梅
史文杏,吕 晴,曲桂武*,赵 莹,周凤梅
(1滨州医学院抗衰老研究所,烟台 264003;2山东新华制药股份有限公司,淄博 255005;3山东绿叶制药有限公司,烟台 264670)
类风湿关节炎(rheumatoid arthritis,RA)是最常见的自身免疫性疾病之一,以慢性炎症和骨破坏为特征,主要临床表现为关节肿痛、软骨破坏、关节功能障碍,甚至导致残疾,是严重威胁人类身体健康的一种常见多发病。芒柄花素-3′-磺酸钠(sodium formononetin-3′-sulphonate,SFS)是异黄酮类天然化合物芒柄花素的-3′-位磺化并成盐后得到的一个具有良好水溶性的化合物,其结构式如图1所示。

Figure 1 Chemical structure of sodium formononetin-3′-sulphonate(SFS)
SFS具有降脂保肝[1]、抗血栓[2]、保护大鼠心肌缺血再灌注损伤[3]等多种药理活性,但其抗类风湿关节炎的活性尚未见报道。本研究采用鸡Ⅱ型胶原联合完全/不完全弗氏佐剂诱导C57小鼠建立类风湿关节炎(collagen-induced arthritis,CIA)模型,观察了SFS对CIA模型小鼠的治疗作用,并对其作用机制进行初步探讨。
1 材料
1.1 药品与试剂
SFS(滨州医学院抗衰老研究所);鸡Ⅱ型胶原、完全弗氏佐剂、不完全弗氏佐剂(美国Sigma-Aldrich公司);雷公藤多苷(tripterygium glycosides,TG,浙江得恩德制药股份有限公司);冰醋酸、多聚甲醛、乙醇、甲醛、二甲苯(天津市鼎盛鑫化工有限公司);苏木精染色液(无锡市江原实业技贸总公司);伊红染液(珠海贝索生物技术有限公司);中性树胶(上海懿洋仪器有限公司);RIPA裂解液(南京赛尔斯生物技术有限公司);TIPE2抗体、PCNP抗体、GAPDH抗体、p-NF-κB p65(p-p65)抗体(美国Protein Technology公司);IκB-α(美国Cell Signaling Technology公司);NF-κB p65(美国Affinity Biosciences公司);羊抗兔IgG-HRP、羊抗鼠IgGHRP(上海碧云天生物技术有限公司);CBA小鼠/大鼠可溶性蛋白缓冲液试剂盒(美国BD公司);DAB显色试剂盒(北京索莱宝科技有限公司);甲苯胺蓝染色试剂盒(上海生工生物工程股份有限公司)。
1.2 仪 器
JA5003N电子分析天平、BW-ZZY足趾肿胀测量仪(上海软隆科技发展有限公司);BX53倒置显微镜(日本Olympus公司);101-3A型电热鼓风干燥箱(天津市泰斯特仪器有限公司);Leica TP1020全自动组织脱水机(成都天威医疗设备有限公司);KD-BM包埋机(浙江省金华市科迪仪器设备有限公司);JY-ZY5 Western blot印迹转移电泳仪(北京君意东方电泳设备有限公司)。
1.3 动 物
雄性C57小鼠,18~22 g,购自济南朋悦实验动物繁育有限公司,生产许可证号SCXK(鲁)20140007。所有动物实验均符合动物伦理委员会要求。实验之前,实验动物适应实验室环境1周。室温20~26℃,日温差小于等于4℃,相对湿度30%~70%,明暗交替时间为12 h/12 h,检疫期及实验期动物自由摄食饮水。
2 方法
2.1 溶液配制
参考文献[4],将鸡Ⅱ型胶原溶于0.1 mol/L冰醋酸溶液中,至终浓度为2 mg/mL,4℃过夜。将该溶液与等体积的完全/不完全弗氏佐剂充分混匀,至液体呈乳白色,整个过程在冰上进行,防止胶原变性。
阳性对照药物雷公藤多苷(TG)混悬液的配制:取TG 30 mg,加入0.5%羧甲基纤维素钠(CMC-Na)溶液30 mL,得到质量浓度为1 mg/mL的雷公藤多苷混悬液;以西林瓶分装,每瓶2.5 mL,灭菌备用。
SFS供试液的配制:分别取SFS 150,300,600 mg,各加入0.5%CMC-Na溶液30 mL,得到质量浓度分别为5,10,20 mg/mL的SFS供试液;以西林瓶分装,每瓶2.5 mL,灭菌备用。
2.2 建立胶原诱导型类风湿关节炎(CIA)模型
造模方法根据参考文献[5-6]进行改良。采用C57小鼠为实验动物,在小鼠尾根部1 cm处沿脊柱方向取小鼠4~6点皮内注射鸡Ⅱ型胶原-完全弗氏佐剂混合乳剂100µL进行初次免疫,初次免疫后第18天,对小鼠再次免疫,用同样的方法将不完全弗氏佐剂与鸡Ⅱ型胶原乙酸溶液等量混合并乳化,于每只小鼠左右后足底皮内各注射混合乳剂100µL。空白对照组小鼠按照上述方法注射等量无菌生理盐水。
2.3 动物分组与给药
分组方法参考文献[7],将48只C57小鼠随机分为6组(n=8),分别为空白对照组(Control),模型对照组(Model),阳性对照药物雷公藤多苷组(TG,10 mg/kg),SFS低剂量组(SFS-L,50 mg/kg)、中剂量组(SFS-M,100 mg/kg)及高剂量组(SFS-H,200 mg/kg)。各组小鼠按照上述剂量从实验开始的第21天到第49天连续腹腔注射给药治疗,每周3次,连续4周[8],空白对照组和模型对照组小鼠予以腹腔注射等量生理盐水,阳性对照组灌胃给予雷公藤多苷混悬液,每只小鼠每次给药容积为10µL/g。
2.4 小鼠一般情况观察及体重、足肿胀、关节炎指数的测定
实验期间,每日观察小鼠的精神状况、摄食、活动、毛色等情况。使用足趾肿胀测量仪检测小鼠左右后肢足肿胀情况,观察小鼠足肿胀程度并进行关节炎指数(AI)评分,作为判断CIA小鼠模型成功与否的标准(0:正常;1:趾关节轻度肿胀;2:肿胀延伸至踝关节和1、2个脚趾;3:肿胀延伸至跖关节和2个以上脚趾;4:包括踝关节在内的全部足爪关节肿胀),记录第21,28,35,42,49天各组小鼠左右后足关节炎指数评分之和。
2.5 血清因子检测
初次免疫后第49天,称量小鼠体重,麻醉取血后处死小鼠,将小鼠全血用离心机离心,转速3 000 r/min,4℃下 离 心15 min,吸 取 上 层 血清,-80℃保存,CBA试剂盒测定血清中TNF-α、IL-6和IL-10的表达水平。
2.6 脾指数和胸腺指数测定
小鼠麻醉取血后处死,打开胸腔和腹腔,将胸腺和脾与组织分离开,并用生理盐水清洗干净,用滤纸吸干称重,称量各组小鼠胸腺和脾质量,计算胸腺指数和脾指数。胸腺指数(脾指数)=胸腺(脾)质量(g)/体重(g)×100%。
2.7 组织病理学检测
取小鼠踝关节,解剖干净后在10%福尔马林溶液中固定,进行脱钙、石蜡包埋、切片,分别用苏木精-伊红(HE)、甲苯胺蓝染色,显微镜下进行组织病理学观察。
2.8 免疫组织化学检测
将石蜡包埋的踝关节组织切片在62℃烤箱中烤片1 h,脱蜡,脱水,3% H2O2消耗内源性过氧化物酶,Tris-EDTA/柠檬酸盐缓冲液进行抗原修复,切片中加入抗NF-κB p65抗体,放置4℃过夜,第2天将其放室内复温30 min,滴加辣根过氧化酶标记的二抗,室温孵育30 min,DAB显色3 min,自来水终止显色,苏木精复染30 s,进一步脱水,中性树胶封片,显微镜下进行观察。
2.9 脾脏组织中NF-κB通路相关蛋白表达检测
将脾组织用裂解液匀浆,离心取上清液,测定蛋白质浓度,将提取的蛋白质与5×蛋白上样缓冲液混匀并进一步煮沸10 min,SDS-PAGE电泳分离,并转移到聚偏氟乙烯(PVDF)膜上,牛奶封闭2 h,孵育一抗TIPE2(1∶1 000)、PCNP(1∶1 000),IκB-α(1∶1 000)、GAPDH(1∶2 000)、NF-κB p65(1∶2 000)、p-p65(1∶2 000),放置4℃过夜,用TBST清洗膜3次,每次10 min,然后室温孵育二抗(1∶5 000)2 h,TBST洗涤3次,每次15 min,最后,用ECL化学发光试剂显影,使用凝胶成像系统曝光成像来检测蛋白质水平,以GAPDH为内参,Image J测量各个条带的灰度。
2.10 统计学处理
数据经Graph Pad Prism 7.0处理,用±s,表示,组间比较采用单因素方差分析,方差齐则采用LSD进行比较,方差不齐则采用秩和检验,P<0.05,差异有统计学意义。
3 结果
3.1 小鼠一般情况
二次免疫前,各组小鼠无明显差异,二次免疫后,与空白对照组相比,CIA各组小鼠毛发光泽程度降低,踝关节出现红肿现象,活动及饮食减少,体重下降。模型对照组小鼠踝关节肿胀最明显,活动受限,精神萎靡,体重增长最慢,在第28天和第30天模型组2只小鼠由于炎症程度较重而死亡,进行SFS干预后,各组小鼠的状态有所改善,其中SFS-H组小鼠状态改善效果较为明显,与阳性药物雷公藤多苷组小鼠状态无明显差异。
3.2 小鼠足肿胀度变化
足趾肿胀在一定程度上可以反映炎症严重程度,图2-A和2-B显示与空白对照组比较,模型对照组小鼠左右足肿胀程度自28 d起显著高于空白对照组(P<0.01)。药物处理组小鼠足肿胀程度低于模型对照组,SFS-H组、雷公藤多苷组足肿胀下降最明显。图2-C显示模型对照组小鼠关节炎评分最高,而各治疗组的关节炎评分显著降低。
3.3 对CIA小鼠脾指数和胸腺指数的影响
如表1所示,模型对照组小鼠脾指数和胸腺指数显著高于空白对照组(P<0.01),与模型对照组相比,雷公藤多苷组及SFS-M、SFS-H组小鼠的脾指数显著降低(P<0.01),SFS-L组脾指数有所降低(P<0.05);雷公藤多苷组及SFS-M组小鼠胸腺指数也有所降低(P<0.05)。
Table 1 Effect of SFS on the spleen and thymic index of CIA mice(±s,)

Table 1 Effect of SFS on the spleen and thymic index of CIA mice(±s,)
##P<0.01 vs control group;*P<0.05,**P<0.01 vs model group
Group Control Model TG SFS-L SFS-M SFS-H Dosage/(mg/kg)10 50 100 200 n 868888 Spleen index/%0.29±0.04 0.64±0.17##0.29±0.03**0.44±0.10*0.38±0.09**0.31±0.05**Thymic index/%0.10±0.02 0.14±0.02##0.11±0.02*0.13±0.02 0.11±0.02*0.13±0.02
3.4 对CIA小鼠血清TNF-α、IL-6、IL-10表达的影响
如图3所示,与空白对照组相比,模型对照组中TNF-α和IL-6的表达水平显著升高(P<0.01),IL-10的表达量显著降低(P<0.01);与模型对照组相比,雷公藤多苷组及SFS-H组显著降低了TNF-α和IL-6的表达水平(P<0.01),SFS-L组对TNF-α和IL-6的降低效果不明显;SFS-M组显著降低IL-6的表达水平(P<0.01),对TNF-α的降低效果不明显;SFS-M组中IL-10的表达显著升高(P<0.01),雷公藤多苷及SFS-H组中IL-10的表达也有所升高(P<0.05),而SFS-L组对IL-10的升高效果不明显。

Figure 3 Effects of SFS on the expression levels of TNF-α(A),IL-6(B)and IL-10(C)in serum of CIA mice(±s,).Model group(n=6);other groups(n=8)
3.5 对CIA小鼠踝关节病理进程及软骨损伤程度的影响
HE染色结果如图4-A所示,空白对照组组织结构完整,而模型对照组组织结构异常,关节外出现组织损伤和关节间隙紊乱,滑膜增生,软骨损伤,炎症细胞浸润及血管生成。与模型对照组相比,雷公藤多苷组及SFS各剂量组踝关节组织学结构基本正常,滑膜轻度增生,炎症细胞浸润少,SFS-H组组织炎症降低效果最明显,与雷公藤多苷组差异不明显。甲苯胺蓝染色实验定性检测踝关节组织中软骨蛋白聚糖含量,结果如图4-B所示,与空白对照组相比,模型对照组小鼠关节中蛋白聚糖减少,软骨有明显退变,表现为软骨细胞丢失和关节软骨破坏,意味着软骨发生了严重损伤。而雷公藤多苷组及SFS各剂量组甲苯胺蓝染色相对完整,软骨的破坏程度较轻,其中SFS-H组效果最明显。
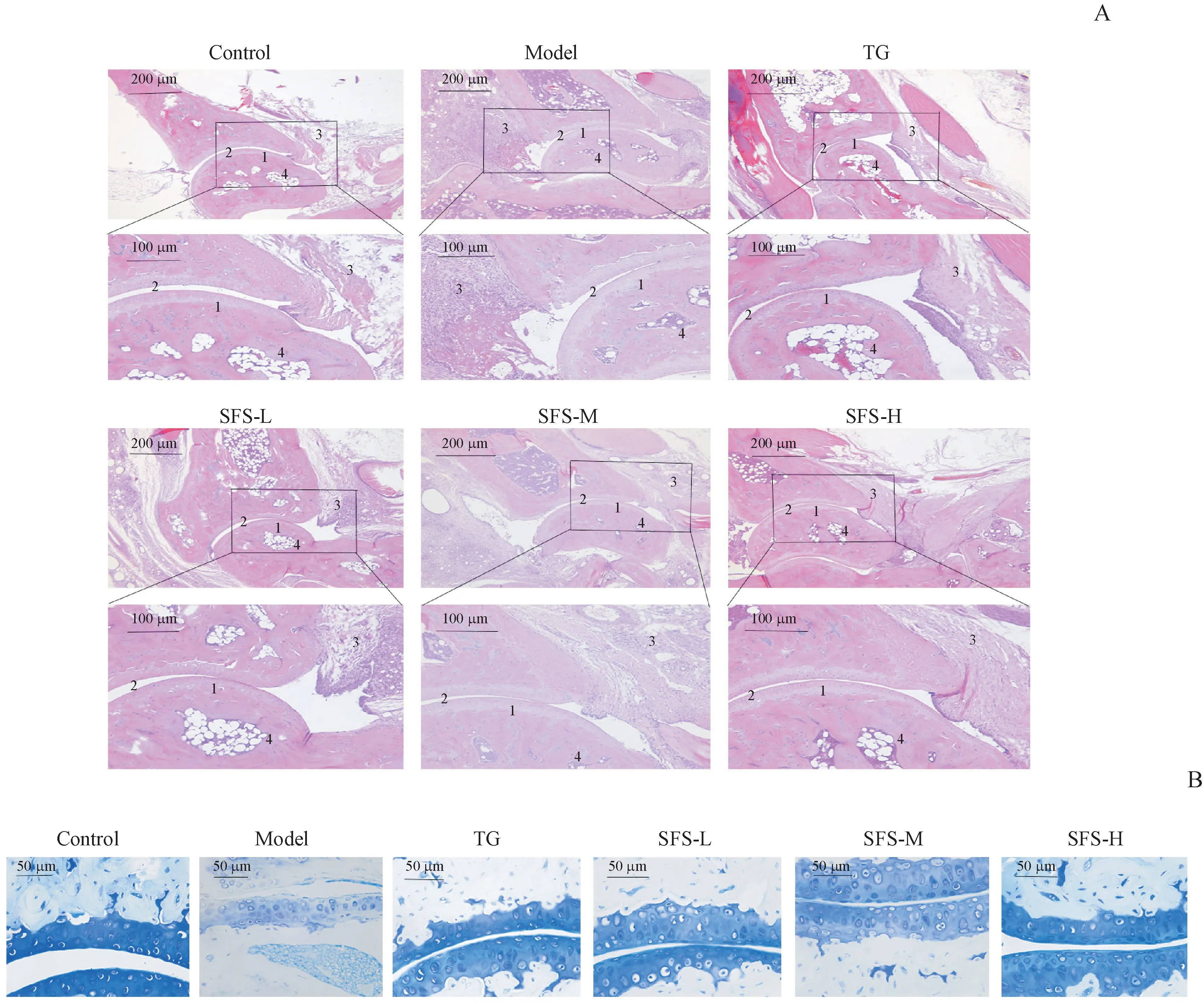
Figure 4 Effect of SFS on ankle joint pathological process and cartilage damage degree of rheumatoid arthritis mice
3.6 对NF-κB信号通路的影响
研究SFS对CIA小鼠的治疗作用机制时,采用Western blot和免疫组织化学(IHC)分析,对NF-κB信号通路是否参与这一进程进行了探讨。
Western blot结果如图5-A所示。与空白对照组相比,模型对照组NF-κB p65及p-p65的表达增加,且模型对照组中PCNP的表达也升高。而SFS可明显降低CIA小鼠NF-κB信号活性,降低NF-κB p65及p-p65蛋白表达水平,同时TIPE2及IκB-α的蛋白表达水平增加。IHC分析结果如图5-B所示,NF-κB p65褐色染色指示阳性表达,模型对照组中NF-κB p65阳性率显著升高,而雷公藤多苷组和SFS组的褐色区域小于模型对照组,说明NF-κB p65阳性率降低,这一趋势与图5-A结果一致,这提示SFS可能是通过阻断NF-κB信号通路来抑制胶原诱导的小鼠类风湿关节炎病变进程。

Figure 5 Effect of SFS on NF-κB signal pathway
4 讨论
芒柄花素是从豆科植物红车轴草等植物中得到的一个异黄酮类化合物,具有内源性雌激素样活性,但由于水溶性差,限制了其临床应用。SFS是经对芒柄花素的3′-位磺化修饰并成盐后获得,具有良好的水溶性,可满足多种给药途径。
抗RA药物筛选过程中采用的动物模型在药物临床前研究中发挥重要作用,特别是对于药物靶点的鉴定和验证[9],CIA模型是一种应用广泛的RA动物模型,它与RA相似,均会出现炎症因子介导的组织损伤、滑膜炎症和关节疼痛变性[10]。本研究采用鸡Ⅱ型胶原联合完全/不完全弗氏佐剂诱导C57小鼠成功建立了类风湿关节炎模型,为SFS的抗RA作用及机制奠定基础。
本研究结果显示,SFS能够降低RA小鼠血清中TNF-α和IL-6炎症因子表达水平,增加抑炎因子IL-10的表达水平,降低了足肿胀、关节炎评分、胸腺指数和脾指数,显示出SFS具有免疫调节和抗炎作用。HE及甲苯胺蓝染色显示SFS能够减轻踝关节组织损伤及软骨损坏程度,这些结果均提示SFS具有潜在的抗RA药物的开发价值,而Western blot和IHC分析结果显示,SFS的抗RA机制可能是通过调控NF-κB信号通路相关蛋白表达,抑制促炎细胞因子的释放,发挥抗炎效果。
SFS在高剂量下显示出与阳性药雷公藤多苷类似的治疗效果。有研究指出,SFS无基因毒性[11],对实验犬静脉给药,进行亚慢性毒性研究时也未观察到明显的不良反应[12],显示出SFS药物具有较高的安全性。因此,SFS有望作为一种潜在的候选化合物,用于抗RA药物的研究。
