睡眠剥夺介导神经元自噬抑制对小鼠抑郁样行为和认知功能的影响
2021-11-06陈春华陈继华黄琼何清谷娟
陈春华,陈继华,黄琼,何清,谷娟
(郴州市第一人民医院 神经内科,湖南 郴州 423000)
抑郁症是以显著持久的心情低落为特征的精神障碍性疾病,数百万抑郁症患者伴有睡眠障碍问题,且睡眠障碍已被纳入抑郁症的诊断标准[1]。虽然有部分研究报道短期快速异相睡眠剥夺(paradoxical sleep deprivation)会对抑郁症重症患者具有一定的治疗作用[2],但是长期持续的睡眠剥夺可能会改变纹状体和海马体中情绪相关的单胺能神经递质、5-羟色胺代谢物的含量,造成氧化应激反应、炎症反应发生,因此会诱导机体出现抑郁样行为[3-4]。此外,睡眠剥夺已被证实与神经营养因子分泌不足、神经细胞凋亡相关,最终诱导机体出现不同程度的认知功能障碍[5]。细胞自噬是由自噬小泡包裹胞内受损细胞器及错误折叠蛋白,转运至溶酶体降解的过程[6]。自噬是机体维持内环境稳定的重要途径,异常的神经元自噬已被报道与神经元凋亡密切相关[7]。现阶段针对睡眠剥夺诱导机体出现抑郁样行为与认知功能障碍的机制探讨鲜有报道。因此,本研究拟采用睡眠剥夺模型,探究异相睡眠对抑郁小鼠脑中海马神经元自噬的影响。
1 材料与方法
1.1 实验动物
36只健康雄性C57/6J小鼠,7周龄,SPF级,由新疆医科大学实验动物中心提供。整个实验中,实验室温度(23±1) ℃,昼夜节律12 h/12 h,湿度(60±5)%,所有动物自由饮食摄水。适应性喂养1周后随机分为对照组、睡眠剥夺组和雷帕霉素组,每组12只。其中雷帕霉素组在小鼠睡眠剥夺造模前1天开始腹腔注射给药,剂量20 mg·kg-1,每天1次,持续给药至睡眠剥夺模型构建结束;其他两组腹腔注射生理盐水。
1.2 实验试剂
雷帕霉素 (rapamycin, Rap)购于美国MCE公司;促肾上腺素皮质激素(adrenocorticotropic hormone, ACTH)、促肾上腺皮质激素释放激素(corticotropin-releasing hormone, CRH)、皮质酮(corticosterone, CORT)等试剂盒购于武汉华美生物科技公司;HE染色试剂盒和RIPA裂解液购于上海碧云天生物科技公司;哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin, mTOR)抗体、自噬微管相关蛋白轻链3(autophagy related protein light chain, LC3)抗体、自噬效应蛋白(Beclin-1)抗体、β-肌动蛋白(β-actin)抗体、异硫氰酸荧光素(fluorescein isothiocyanate isomer, FITC)标记山羊抗小鼠IgG(H+L)二抗、辣根过氧化物酶(horseradish peroxidase, HRP)标记山羊抗小鼠IgG(H+L)二抗购自于美国CST公司。
1.3 睡眠剥夺造模
参考文献[8]进行为期7 d的睡眠剥夺造模。对照组小鼠置于直径8 cm、高6 cm的柱体平台上,平台底部无积水。睡眠剥夺组和雷帕霉素组小鼠置于直径3 cm、高6 cm的柱体平台上,将平台置于水箱中,注水至平台下1 cm,两组小鼠能够在各平台间自由移动、进食、饮水。睡眠剥夺组和雷帕霉素组水中平台仅能满足小鼠正常摄水饮食活动,当小鼠进入睡眠且由正相睡眠期过度至异相睡眠期时,由于全身肌肉松弛,小鼠此时会掉入水中并苏醒。借此方法剥夺小鼠异相睡眠。
1.4 行为学检测
1.4.1 Morris水迷宫实验 水迷宫装置是一个直径1.6 m的圆形水池,装置有4个象限,分别为目标象限、左侧象限、右侧象限和对侧象限,其中目标象限中央放置一个逃生平台,记为逃生象限。训练中将各组小鼠自不同象限投入水中,记录各小鼠90 s内达到逃生平台时间,记为逃避潜伏期。若90 s内未能找到平台则引导至平台,记录逃避潜伏期为90 s。所有小鼠共训练4次。次日进行水迷宫检测,撤去逃生平台,将小鼠自对侧象限放入水中,记录各组小鼠逃避潜伏期,穿越逃生象限次数及在目标象限停留时间。
1.4.2 糖水偏好实验 所有小鼠单笼饲养,禁食禁水12 h后,给予1瓶纯净水和1瓶1%蔗糖水,测试每只小鼠12 h内饮用蔗糖水占所有饮水比例,记为糖水偏好率。糖水偏好率(%)=蔗糖水消耗质量(g)/[纯净水消耗质量(g)+蔗糖水消耗质量(g)]×100%。
1.4.3 悬尾实验 安静、避光环境下,将小鼠尾尖2 cm 粘贴于平台上,所有小鼠之间使用障碍物隔离。小鼠适应环境2 min后,应用摄像软件记录小鼠4 min内悬挂不动时间,记为悬尾不动时间。
1.4.4 强迫游泳实验 安静、避光环境下,将小鼠独自置于注满水的圆形容器中,小鼠适应环境2 min后,应用摄像软件记录小鼠4 min内在水中的不动时间,记为强迫游泳不动时间。
1.4.5 开野实验 安静、避光环境下,将小鼠置于40 cm×40 cm的开野箱中,测试软件将开野箱均分为16个正方块。所有小鼠适应2 min后,应用软件记录小鼠4 min内穿越每个正方块的次数,记为穿格次数得分。
1.5 电子透射显微镜观察
迅速处死小鼠,分离出海马组织,在CA1区截取约1 mm3组织,固定于2.5%戊二醛中,4 ℃固定24 h,PBS冲洗组织,应用1%锇酸磷酸盐缓冲液再次固定2 h。PBS缓冲液冲洗,梯度乙醇脱水10~15 min,再以100%丙酮溶液浸润组织2次(15 min·次-1),最后使用包埋剂浸透过夜。次日挑出组织放入包埋板中聚合,60 ℃加热过夜使组织硬化,使用金刚石刃将组织切成60~80 nm超薄切片,最后应用饱和醋酸铀、枸橼酸铅染色。应用日立H-7650透射电镜观察各组小鼠海马组织细胞自噬情况。
1.6 HE染色
迅速处死小鼠,取出脑组织,固定于4%多聚甲醛溶液中。48 h后取出组织,应用梯度酒精常规脱水并包埋,将切片切成5 μm厚,脱蜡至水。切片首先置于苏木精染色液中染色3 min,再放入0.5%盐酸酒精中分化10 s,随后置入氨水返蓝液中3~5 min,最后放入1%伊红溶液中30 s~1 min。结束后使用去离子水冲洗染色液,再以梯度酒精迅速脱水,二甲苯透明1 min,中性树胶封片,使用光学显微镜拍摄图片。
1.7 免疫荧光检测
迅速处死小鼠,取出脑组织,固定于4%多聚甲醛溶液中。48 h后取出组织,应用梯度酒精脱水。将脑组织快速冷冻,在-20 ℃条件下,沿其冠状面切成5 μm厚切片,固定于载玻片上。室温下,将脑组织玻片置于10%BSA溶液中封闭2 h,PBST冲洗切片,每个切片组织上添加200 μl mTOR单克隆抗体稀释液,4 ℃ 条件下湿盒中避光孵育12 h。次日,将切片与FITC标记山羊抗小鼠IgG(H+L)二抗一起孵育,最后将切片用DAPI染色15 min,加入抗荧光猝灭剂封片,使用荧光显微镜观察并拍摄。
1.8 试剂盒检测
所有小鼠眼眶取血500 μl,以3 000 r·min-1离心后取血清备用。根据试剂盒说明书的步骤加入血清样品、试剂盒试剂,按说明书孵育抗体,弃去试剂。在说明书要求波长处使用酶标仪检测OD值,绘制标准曲线,计算小鼠血液各项指标含量。
1.9 Western blotting检测
迅速处死小鼠,取海马组织,按体积质量比4∶1加入含RIPA裂解液,4 ℃条件下匀浆10 min,待形成组织细胞悬液后静置30 min,让组织细胞充分裂解,以12 000 r·min-1离心20 min,加入Loading Buff密封后沸水浴20 min使蛋白变性。配置4%浓缩胶与10%分离胶,等量上样后进行SDS-PAGE凝胶电泳,电泳结束后经湿法转膜将蛋白转移至PVDF膜上,PVDF膜置于脱脂牛奶中封闭2 h,4 ℃条件下孵育一抗稀释液过夜。次日洗净一抗稀释液,室温下孵育二抗稀释液2 h,洗净二抗稀释液后在条带上均匀地涂上发光液,自动成像仪成像并分析。
1.10 统计学处理
采用SPSS 22.0 统计软件进行数据分析。计量资料以均数±标准差表示,组间比较采用单因素方差分析(One-Way ANOVA),组间多重比较采用Tukey检验。P<0.05为差异有统计学意义。
2 结 果
2.1 睡眠剥夺造成小鼠出现显著的抑郁样行为
长期睡眠剥夺显著降低了小鼠糖水摄取率与开野实验中穿格次数得分(P<0.05),但却显著延长强迫游泳与悬尾实验中的不动时间(P<0.05)。与此同时,自噬诱导剂雷帕霉素却显著改善了小鼠糖水摄取率(P<0.05),提高了小鼠开野实验中穿格次数(P<0.05),且有效减少了强迫游泳与悬尾实验中的不动时间(P<0.05)。见表1。
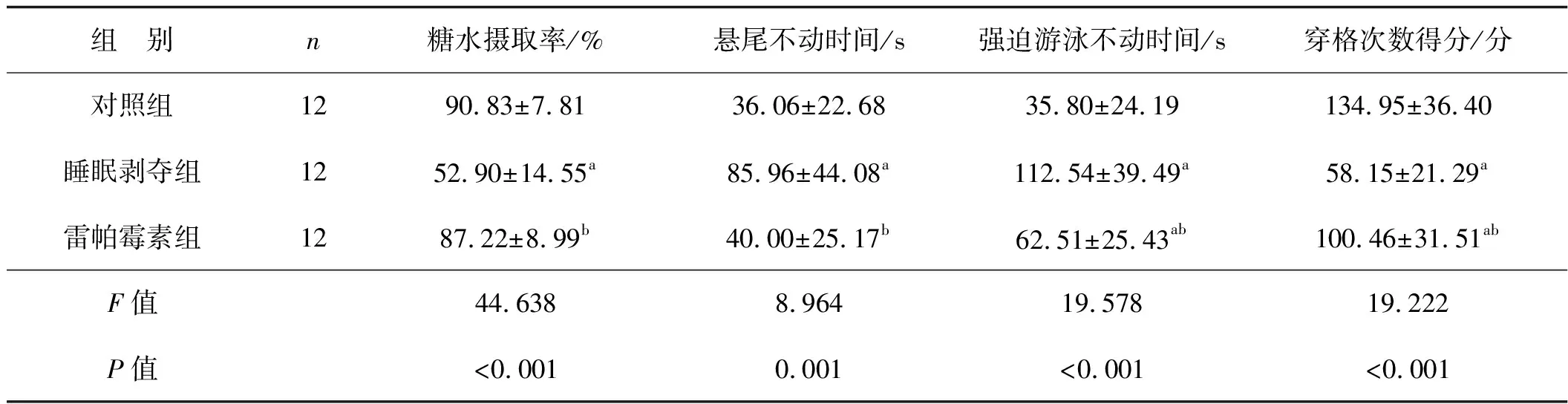
表1 3组小鼠的行为学实验结果比较
2.2 睡眠剥夺造成小鼠出现显著的认知功能障碍
长期睡眠剥夺造成小鼠逃避潜伏期显著延长(P<0.05),在目标象限中停留时间显著减少(P<0.05),且穿越平台象限次数显著减少(P<0.05)。然而,自噬诱导剂雷帕霉素干预则有效减少小鼠逃避潜伏期(P<0.05),增加小鼠在目标象限中停留时间与穿越平台象限次数(P<0.05)。见表2、3。
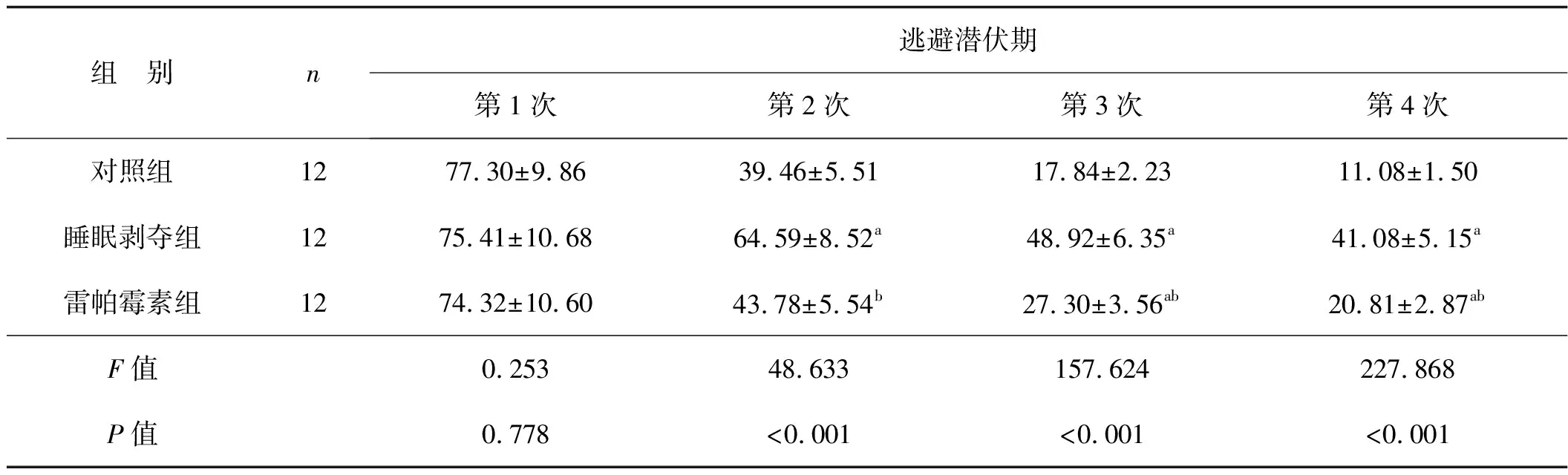
表2 3组小鼠不同训练次数后的逃避潜伏期比较
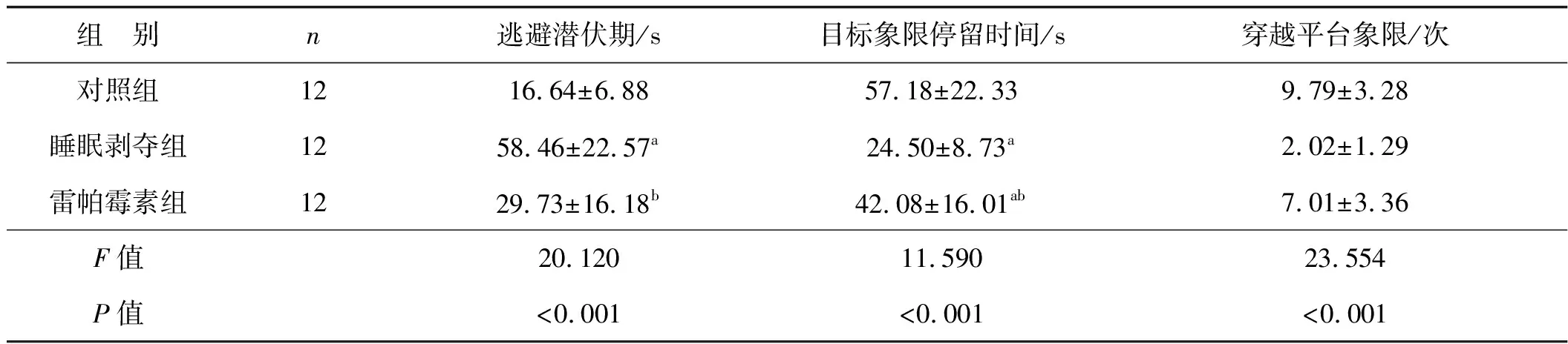
表3 3组小鼠测试期间的各项认知功能指标比较
2.3 睡眠剥夺造成小鼠下丘脑-垂体-肾上腺轴(HPA)相关激素分泌增加
长期睡眠剥夺造成血清中HPA轴功能亢进标志物CRH、ACTH、CORT激素水平显著上调(P<0.05),自噬诱导剂雷帕霉素给药可有效降低小鼠血清中CRH、ACTH、CORT水平(P<0.05),见表4。
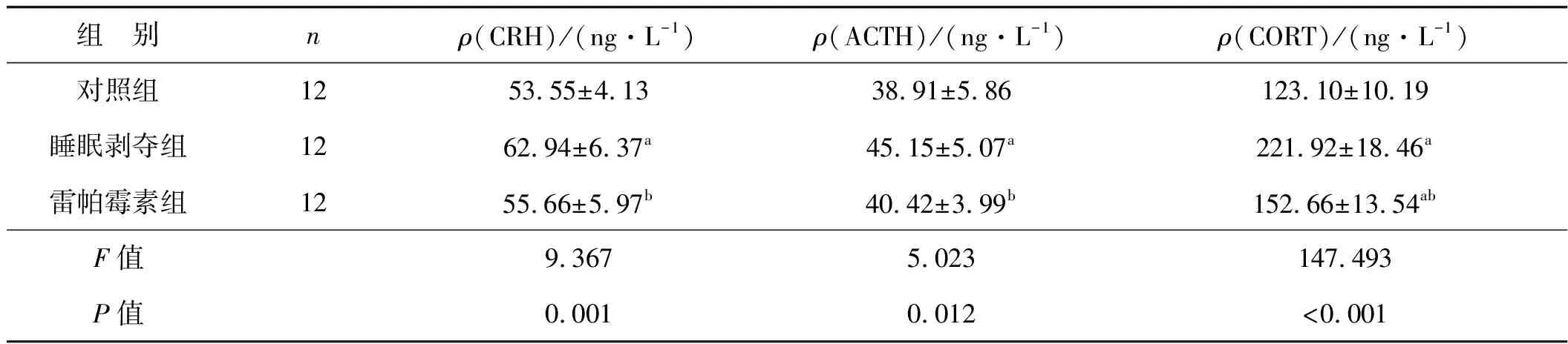
表4 3组小鼠HPA轴的相关激素水平比较
2.4 睡眠剥夺造成小鼠海马组自噬水平抑制
电子显微镜检测自噬囊泡是鉴定自噬的金标准。通过电子显微镜评估海马组织CA1区神经元中自噬囊泡的形成,结果显示:对照组神经元相对正常,具有相对健康的细胞核和完整的线粒体膜,自噬囊泡较多;睡眠剥夺组小鼠海马组织中线粒体体积肿胀,线粒体膜界限模糊,视野中自噬囊泡减少;雷帕霉素组神经元中线粒体恢复正常,且视野中自噬囊泡增加。见图1。

图1 3组小鼠电镜观察下海马组织中线粒体形态与自噬囊泡数量
2.5 睡眠剥夺造成小鼠海马区神经元损伤
睡眠剥夺造成小鼠海马组织CA1区神经元凋亡,自噬抑制剂雷帕霉素干预可显著恢复小鼠海马组织中神经元状态,见图2。

图2 3组小鼠HE染色后海马组织中神经元状态
2.6 睡眠剥夺造成小鼠海马区自噬相关蛋白表达抑制
睡眠剥夺造成小鼠海马组织中自噬相关蛋白LC3及Beclin-1的表达显著降低(P<0.05),自噬诱导剂雷帕霉素干预可显著增加了海马组织中LC3及Beclin-1的表达(P<0.05),见表5、图3。
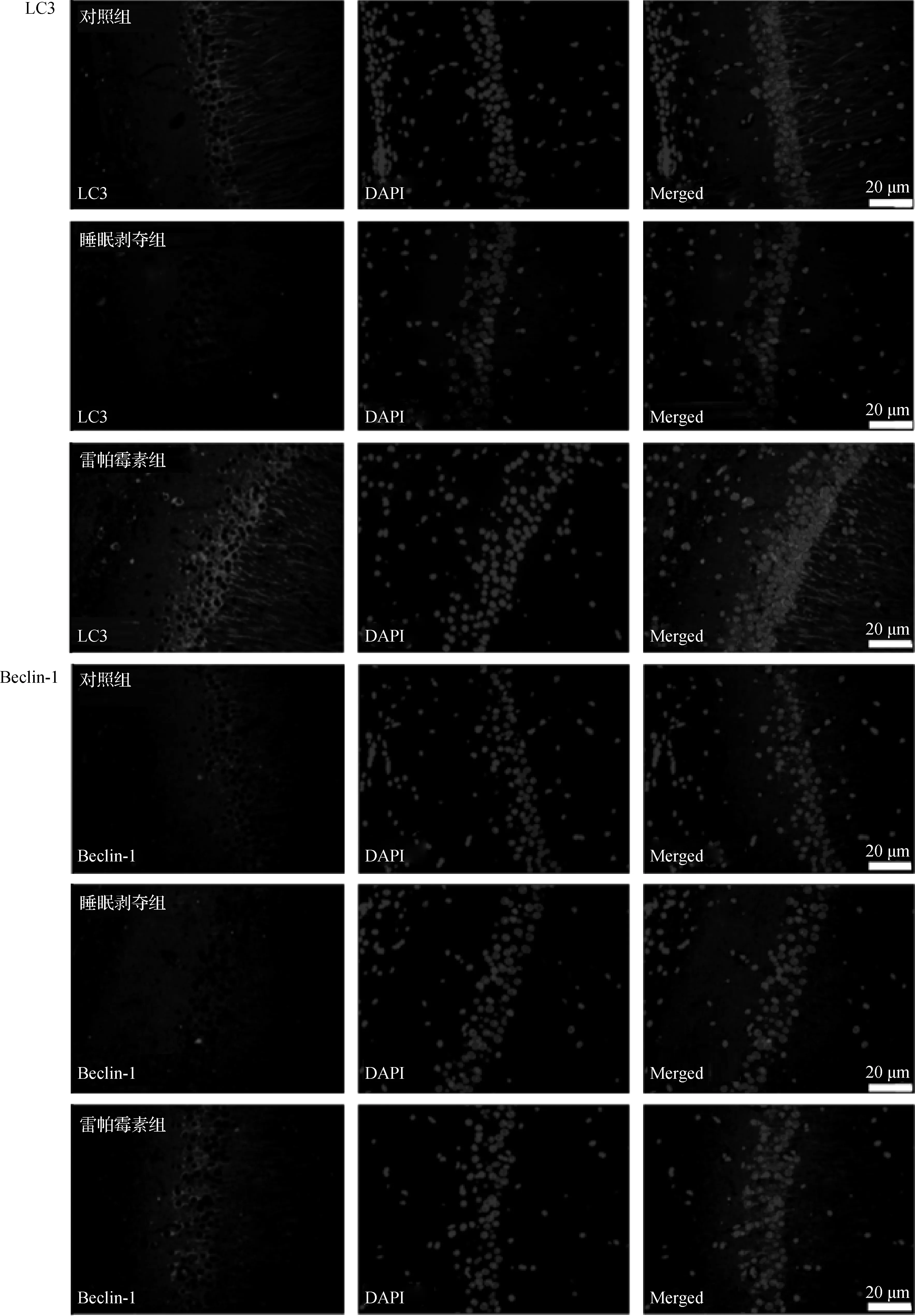
图3 3组小鼠海马组织中LC3、Beclin-1的表达
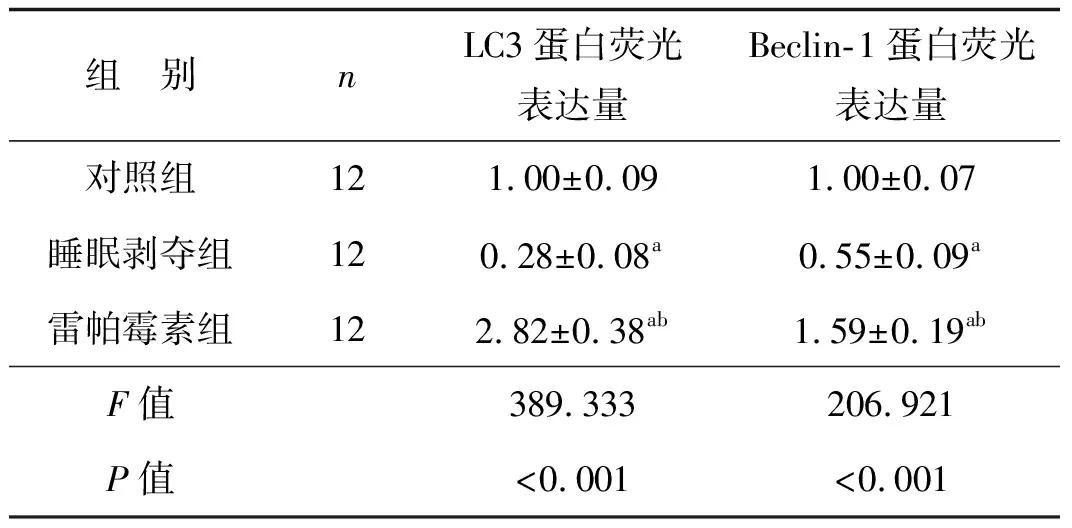
表5 3组小鼠自噬相关蛋白LC3、Beclin-1表达情况比较
2.7 睡眠剥夺造成小鼠海马中mTOR表达增加,而自噬相关蛋白减少
睡眠剥夺造成小鼠海马组织中mTOR表达增加(P<0.05),LC3-II/LC3-I和Beclin-1表达却显著降低(P<0.05)。雷帕霉素给药后小鼠海马组织中mTOR表达出现显著抑制(P<0.05),而LC3-II/LC3-I和Beclin-1表达显著增加(P<0.05)。见图4、表6。
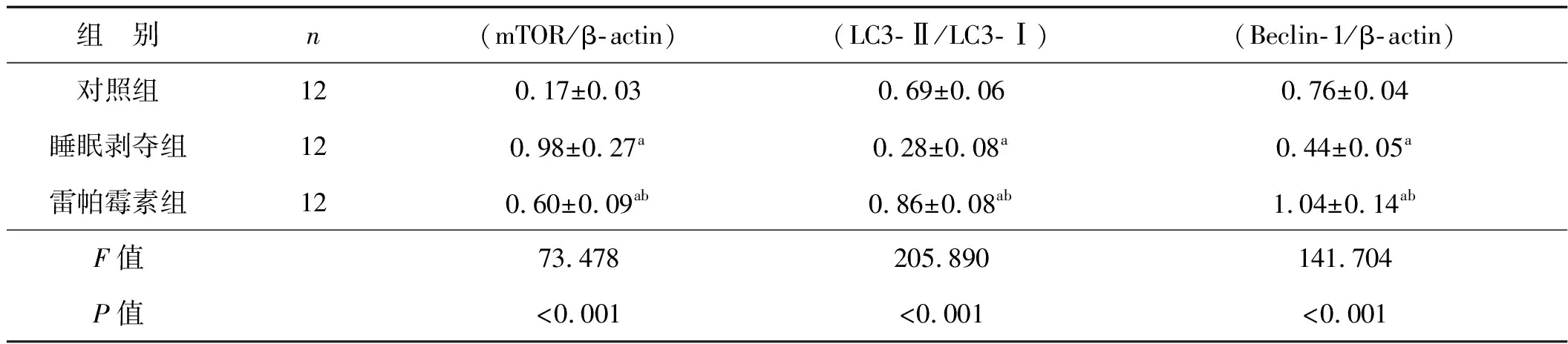
表6 3组小鼠mTOR、LC3、Beclin-1蛋白表达水平比较
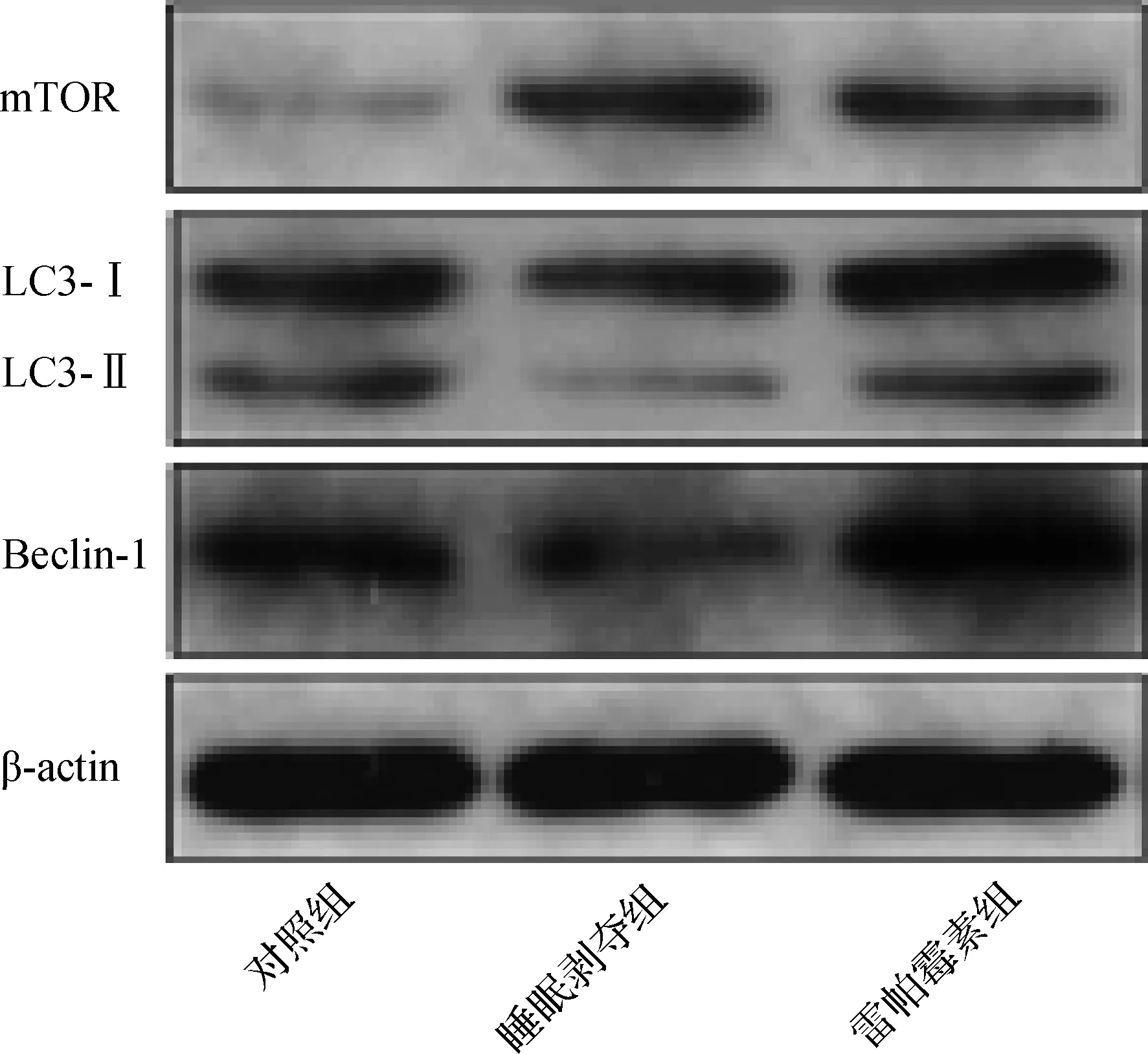
图4 Western blotting检测3组小鼠海马组织中蛋白表达情况
3 讨 论
临床常见精神障碍性疾病如抑郁症、躁郁症等已被证明与昼夜生活节律破坏密切相关[9]。正常、规律且充足的睡眠是帮助机体恢复身体机能的一项重要环节。迄今为止,睡眠/觉醒周期被破坏是最广泛报道的与抑郁症发病相关的昼夜生活节律紊乱情况[10]。整个睡眠/觉醒周期主要分为正相睡眠期与异相睡眠期。正相睡眠期是指机体由清醒逐渐进入睡眠状态,此时全身肌肉松弛但仍有一定的紧张度。当机体进入异相睡眠期,机体各种感觉会进一步退步,肌肉更加松弛,肌腱反射消失。利用这一生理特性,本研究将小鼠置于仅能满足紧张性肌肉行动的平台上,当小鼠进入异相睡眠状态,由于肌肉松弛会跌入水中从而恢复清醒状态。借此方法介导小鼠异相睡眠期的剥夺,从而模拟临床睡眠质量差造成患者出现抑郁样症状。这一造模过程持续7 d。
现阶段,睡眠剥夺对抑郁症患者是正向改善还是负向加剧仍存在一定的争议[11]。本研究显示7 d的睡眠剥夺可诱导小鼠抑郁样行为。遭受睡眠剥夺小鼠表现出无喜感偏好,即糖水偏好实验中糖水摄取率显著降低的现象。与此一致,遭受睡眠剥夺小鼠表现出沮丧的行为,即强迫游泳实验与悬尾实验中不动时间显著延长,开野实验中穿格评分显著降低。与此同时,遭受睡眠剥夺小鼠表现出认知功能障碍的行为,即Morris水迷宫中小鼠逃避潜伏期显著延长,而穿越平台象限次数显著减少,且目标象限停留时间减少。此外,小鼠分泌系统也出现了显著的失衡,表现为CRH、ACTH、CORT等激素分泌增加,即HPA轴功能过度活化。HPA轴亢进会影响单胺递质的传递,造成抑郁症的发展。HPA轴亢进会进一步诱导谷氨酸(Glu)释放和兴奋性传递异常增强,导致Glu/γ-氨基丁酸(GABA)比例增大,GABA相关信号被抑制,引起神经毒性,促进抑郁症的进展[12]。本研究睡眠剥夺成功造成了小鼠出现抑郁样行为,并导致小鼠认知功能出现障碍。值得关注的是,本研究持续腹腔注射自噬诱导剂雷帕霉素的小鼠,其抑郁样行为各项指标出现显著改善,认知功能相关指标显著提升。此外,HPA轴亢进相关激素分泌回归基线。因此,自噬在睡眠剥夺诱导的抑郁样症状和认知功能障碍中扮演着重要角色,雷帕霉素作为一种自噬诱导剂,能够有效改善睡眠剥夺诱导的抑郁样症状和认知功能障碍。
自噬是机体依赖于溶酶体进行的蛋白质自我降解过程,是细胞维持内环境稳定的重要途径。正常水平的自噬有利于神经元存活,且对于稳定和保障细胞内各种生命活动正常有序进行至关重要[13]。自噬功能失调导致错误折叠蛋白和受损细胞器的堆积,介导神经元功能失调,诱导神经元凋亡。然而,自噬功能亢进,就会降解过多的健康细胞器或自身蛋白,超过自身代偿范围从而诱导神经元凋亡。现阶段,自噬对抑郁症的调节作用是正向调节还是负向调节仍存在很多争议[14]。Kara等[15]研究显示,海藻糖具有增强自噬的作用,具体表现为降低前额叶皮质中p62/Beclin-1之值,连续3周的饮用后小鼠抑郁样行为得到显著改善。然而,快速抗抑郁样药物氯胺酮能够快速激活mTOR通路,但mTOR通路的长期激活却能够抑制自噬反应[16]。
本研究结果显示,长期睡眠剥夺诱导小鼠神经元自噬抑制,导致受损的细胞器堆积,造成海马神经元凋亡。
mTOR负反馈调控着机体的自噬水平,其机制为mTOR活化能够抑制自噬起始蛋白UNC-51激酶1(unc-51-like kinase 1, ULK1)的表达,抑制多种自噬相关蛋白于自噬前体结构的定位,减少自噬反应的发生[17]。本研究雷帕霉素成功抑制了睡眠剥夺诱导的海马组织中mTOR活化,诱导自噬反应的发生。LC3是自噬过程中重要蛋白,它直接与P62结合并通过自噬溶酶体途径降解。LC3以两种形式存在,即LC3-Ⅰ和LC3-Ⅱ。LC3-Ⅱ为成熟自噬小体的蛋白质标志物。当细胞自噬反应发生时,LC3-Ⅰ经酯化转化为LC3-Ⅱ,LC3-Ⅱ与自噬体膜上磷脂酰乙醇胺结合并始终定位在胞内自噬体膜上。因此,LC3-Ⅱ含量与自噬泡的量呈正相关[18]。本研究睡眠剥夺诱导小鼠海马组织中LC3-Ⅱ表达显著降低,而雷帕霉素给药则显著上调海马组织中LC3-Ⅱ表达水平,增加海马组织中自噬,提高细胞存活率。Beclin-1对自噬体膜的聚集至关重要,可促进LC3-Ⅰ向LC3-Ⅱ转化并增强自噬[19]。近期研究结果显示,Beclin-1敲低小鼠海马组织中神经元自噬水平下降,在阿尔兹海默病模型大鼠脑中易引起淀粉样前体蛋白(APP)与淀粉样Aβ蛋白聚集,大鼠痴呆样症状加深且炎症反应增强[20]。然而,在外源性注射Beclin-1蛋白后,大鼠脑中淀粉样蛋白沉淀减少。由此提示,Beclin-1水平升高能够促进神经元自噬的增加,提高淀粉样蛋白的清除。本研究自噬诱导剂雷帕霉素升高了Beclin-1蛋白表达水平,提示雷帕霉素给药逆转了睡眠剥夺介导的自噬抑制,改善神经元状态。
综上所述,睡眠剥夺介导海马神经元自噬水平抑制,造成海马神经元损伤,导致小鼠出现抑郁样症状,并最终诱导小鼠认知功能损伤;而自噬诱导剂雷帕霉素能够通过抑制mTOR蛋白表达,上调小鼠海马区神经元自噬水平,减少睡眠剥夺诱导海马神经元损伤,最终改善小鼠认知功能。
