炎症及营养指标与直肠癌新辅助放化疗病理反应及患者预后的相关性研究
2021-11-06王逸君张碧云陈乐君鹿红马珺宋威于大海
王逸君,张碧云,陈乐君,鹿红,马珺,宋威,于大海
(南京中医药大学附属医院 放疗科,江苏 南京 210029)
新辅助放化疗序贯直肠全系膜切除术是目前Ⅱ、Ⅲ期直肠癌患者的首选治疗方案[1-2]。直肠癌新辅助治疗后病理反应状态与肿瘤局部复发及远处转移密切相关,是影响患者预后的重要因素[3]。然而新辅助治疗后肿瘤病理反应状态个体化差异很大,有超过三分之一的患者无法从新辅助治疗中获益,因此寻找合适的指标预测治疗后肿瘤病理反应状态,指导临床个体化治疗以期改善患者预后,是近年来研究的热点[4]。目前对新辅助治疗后肿瘤病理反应状态及患者预后主要是通过肿瘤相关因素进行预测的,其中TNM分期被认为具有显著的预后评价效能,是评估恶性肿瘤预后的基本依据;其他指标如癌胚抗原(carcinoembryonic antigen,CEA)水平,分子指标P53,基因多态性指标EGFR、OGG1和MTHFR等也被证实具有一定的预后预测价值[5-9]。恶性肿瘤的发生发展与宿主因素同样密切相关,特别是系统性炎症反应(systemic inflammatory response,SIR)及机体营养状况。研究显示,SIR指标如中性粒细胞/淋巴细胞之值(neutrophil to lymphocyte ratio,NLR)、血小板/淋巴细胞之值(platelet to lymphocyte ratio,PLR)增高提示患者预后不良,淋巴细胞/单核细胞之值(lymphocyte to monocyte ratio,LMR)增高提示患者预后较好[10-13]。预后营养指数(prognostic nutritional index,PNI)是综合机体免疫及营养状态的指标,对消化道恶性肿瘤患者预后也具有独立预测和评估作用[14]。目前联合炎症及营养相关指标进行综合评价疗效的研究尚少,本研究回顾性分析不同炎症及营养指标与直肠癌新辅助放化疗后肿瘤病理反应状态及患者预后的相关性,探讨其临床应用价值。
1 对象与方法
1.1 研究对象
收集2012年10月至2019年2月就诊于本院接受新辅助放化疗及根治性手术的211例Ⅱ、Ⅲ期直肠癌患者的临床病理资料。其中男140例(66.4%),女71例(33.6%);中位年龄61(25~75)岁;临床分期Ⅱ期患者90例(42.7%),Ⅲ期患者121例(57.3%)。纳入标准:(1) 年龄18~75岁;(2) 术前肠镜活检病理证实为直肠腺癌,临床分期为Ⅱ/Ⅲ期(2010年第7版AJCC/UICC分期);(3) 于本院行新辅助放化疗及根治性手术。放疗范围包括直肠原发病灶及相应淋巴结引流区[15],放疗剂量95%PTV 45 Gy,25次后缩野至直肠系膜区,补量至50.4 Gy/28 f。自放疗开始当日起同步口服卡培他滨片化疗(825 mg·m-2,2次·d-1,5 d·周-1),直至放疗结束。新辅助治疗结束后4~6周行外科手术,等待手术间期依据患者身体状况行1个周期奥沙利铂联合卡培他滨化疗,手术均按照直肠全系膜切除操作规范进行。术后常规辅助化疗,以XELOX 3周方案化疗6个周期或mFOLFOX6双周方案化疗8个周期定义为足量化疗。排除标准:(1) 新 辅助放化疗前1周内外周血常规、肝肾功能、肿瘤指标资料、术后病理资料缺乏者;(2) 合并其他恶性肿瘤者;(3) 合并急慢性感染、风湿免疫系统疾病、造血功能障碍等血液系统疾病者。本研究已获得本院伦理委员会批准。
1.2 资料收集
依据患者放化疗前1周内血常规和肝肾功能检查结果,计算各项指标结果。计算公式为:NLR=中性粒细胞计数/淋巴细胞计数;PLR=血小板计数/淋巴细胞计数;LMR=淋巴细胞计数/单核细胞计数;PNI=白蛋白值+5×淋巴细胞计数。
1.3 随访
根据患者术后病理结果,基于肿瘤消退分级(tumor regression grading,TRG) 标准评价肿瘤病理反应状态[16]:TRG 0级定义为病理完全缓解(pathological complete response,pCR),即肿瘤完全消退,镜下无可见肿瘤细胞;TRG 1级定义为中度反应,即镜下仅残存单个或小灶癌细胞;TRG 2级定义为轻度反应,即肿瘤有明显退缩但残存癌细胞多于单个或小灶癌细胞;TRG 3级定义为广泛癌细胞残存,提示反应不良。新辅助放化疗后病理反应状态为TRG 0~1级示肿瘤治疗反应较好,即病理反应患者;TRG 2~3级提示肿瘤对新辅助放化疗反应较差,即非病理反应患者。分析基线炎症及营养指标与新辅助治疗后病理反应状态的相关性。以新辅助放化疗当日为观察起点,局部复发定义为直肠病灶或区域淋巴结复发;远处转移定义为实质脏器、非区域淋巴结及腹膜转移。无病生存期(disease-free survival,DFS)定义为观察起点至肿瘤复发、进展或患者死亡日;总生存期(overall survival,OS)定义为患者死亡日或最后随访日。分析基线炎症及营养指标与患者预后的相关性。
1.4 统计学处理
采用SPSS 23.0统计软件行数据分析。计数资料行χ2检验或Fisher精确概率法检验分析。采用单因素和多因素Logistic回归方法分析基线炎症、营养指标及临床病理特征与直肠癌新辅助放化疗肿瘤病理反应状态间相关性。采用Kaplan-Meier法绘制生存曲线,Log-rank 检验比较不同组间生存差异,Cox风险回归模型行单因素及多因素预后分析。将单因素分析中具有统计学显著性的自变量纳入多因素模型,并采用Forward:LR法进行多因素分析。P<0.05为差异有统计学意义。
2 结 果
2.1 各项炎症及营养指标与病理反应状态的相关性
211例直肠癌患者新辅助放化疗后肿瘤病理反应分别为TRG 0级46例(21.8%),TRG 1级89例(42.2%),TRG 2级36例(17.1%),TRG 3级40例(19.0%)。病理反应(TRG 0~1级)患者135例(64.0%),非病理反应(TRG 2~3级)患者76例(36.0%)。单因素分析结果见表1。多因素Logistic回归分析结果显示,PNI(OR=1.245, 95%CI1.123~1.380,P<0.001)及基线CEA(OR=0.500, 95%CI0.255~0.979,P=0.043)是病理反应状态的独立影响因素。
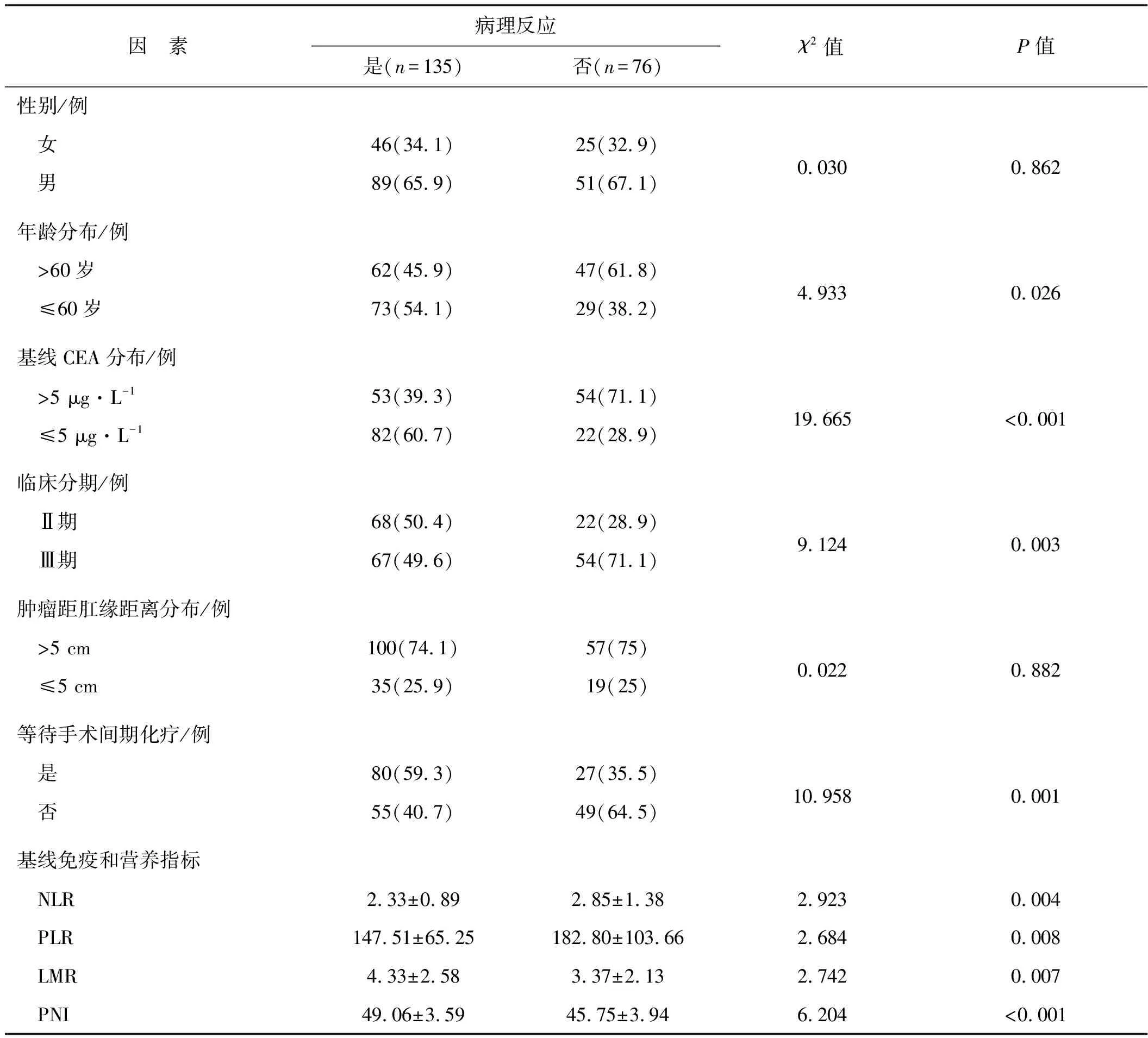
表1 211例直肠癌患者新辅助治疗后病理反应状态的相关性分析
2.2 各项炎症及营养指标与患者预后的相关性
随访截至时间为2019年12月31日,中位随访时间45(10~83)个月。截至随访终点,全组共有12例(5.7%)患者发生肿瘤局部复发,36例(17.1%)患者发生远处转移,27例(12.8%)患者死亡。全组1、3、5年无病生存率分别为99.0%、84.3%、73.3%,总生存率分别为100%、91.6%、79.6%。病理反应患者和非病理反应患者5年无病生存率分别为83.6%、55.2%(P<0.001),总生存率分别为89.9%、60.1%(P<0.001)。单因素预后分析结果见表2。多因素预后分析显示,性别、淋巴(ypN)分期、基线NLR及基线PNI是DFS的独立影响因素;性别、ypN分期及基线PNI是OS的独立影响因素。见表3。

表2 211例直肠癌患者无病生存及总生存的单因素分析

表3 211例直肠癌患者DFS及OS多因素分析
2.3 分层分析
多因素预后分析结果显示,基线炎症和营养指标中仅PNI是病理反应状态、DFS及OS的独立影响因素。参考既往经典研究[17],以45为临界值对PNI进行分组,高PNI组患者(PNI>45)5年无病生存率及总生存率显著高于低PNI组(无病生存率78.6%vs. 65.7%,P=0.001,图1A;总生存率84.7%vs.70.6%,P=0.001,图1B)。依据ypN分期行分层分析,在ypN0患者中高PNI组5年DFS和OS长于低PNI组,但差异无统计学意义(无病生存率83.2%vs. 79.5%,P=0.252,图1C;总生存率89.2%vs. 85.1%,P=0.299,图1D);在ypN阳性患者中高PNI组5年DFS和OS显著长于低PNI组(无病生存率63.6%vs. 48.0%,P=0.002,图1E;总生存率69.2%vs.51.9%,P=0.005,图1F)。

图1 211例不同PNI水平直肠癌患者的生存曲线比较
3 讨 论
恶性肿瘤发生发展及治疗反应差异不仅取决于肿瘤自身特征,还与机体系统性炎症反应及营养状况密切相关。目前研究[18-20]显示,NLR、PLR、LMR及PNI是预测肿瘤患者预后的有效指标。然而,既往研究多局限于探讨单一的炎症和营养指标对肿瘤治疗反应及患者预后的影响,且不同肿瘤与不同炎症及营养指标的研究结果也不尽相同,各炎症和营养指标间是否相互独立或具有协同预测价值亦不得而知,炎症和营养指标对不同肿瘤的预后预测价值仍须进一步评估。
Li等[21]评估了基线NLR、PLR及LMR水平与直肠癌新辅助放化疗后病理反应的相关性,结果显示仅LMR是病理反应的独立影响因素。Dudani等[22]回顾性分析1 227例局部晚期直肠癌患者的资料,结果显示基线NLR及PLR水平并非新辅助放化疗后pCR的独立预测因素。Ward等[23]研究结果显示,治疗前高水平LMR患者5年生存率更高,而治疗前高水平NLR或PLR患者则预后较差。既往研究大多仅评估基于肿瘤炎症微环境及机体炎症免疫学说建立的SIR指标对病理反应及预后的影响,本研究在此基础上增加可综合反映患者营养和免疫状态的指标PNI并进行评估,结果显示病理反应患者基线平均NLR及PLR值低于非病理反应患者,基线平均LMR及PNI值高于非病理反应患者,但多因素分析结果显示,4项炎症和营养指标中仅基线PNI水平是影响病理反应状态的独立因素。直肠癌新辅助治疗后肿瘤病理反应状态可早期判断治疗效果,初步预测患者预后,常作为初级观察终点,而评价疗效的最终观察指标依然是患者预后生存时间。Park等[24]回顾性分析725例就诊于安德森癌症中心行新辅助放化疗及手术的直肠癌患者的临床病理资料,结果显示新辅助治疗后病理反应及非病理反应患者的5年无复发生存率分别为83.6%、58.5%。本研究结果显示,病理反应和非病理反应患者5年无病生存率分别为83.6%、55.2%(P<0.001),与既往研究基本一致。生存分析结果显示,基线炎症和营养指标中仅PNI水平是患者DFS、OS的独立因素,高PNI组患者5年DFS及OS显著长于低PNI组。本研究首次发现在接受直肠癌新辅助治疗的患者中,基线PNI的疗效预测价值优于PLR及LMR,而基线NLR水平仅与患者DFS相关,且非OS独立预测因素。
现阶段TNM分期仍是直肠癌患者治疗手段选择及预后评估的最基本依据,但即使是相同分期的患者,其临床进程及预后结果差异也很大,提示须进一步明确相关的临床、影像、病理特征以及炎症和营养生物标志物的作用以优化分期系统。本研究进一步分层分析显示,在ypN0患者中高PNI组5年DFS和OS虽高于低PNI组,但差异无统计学意义,而在ypN阳性患者中两组生存期差异有统计学意义。徐莹莹等[25]研究显示,治疗前PNI及N分期是老年食管癌放疗后预后的独立影响因素。Peng等[26]研究同样证实,术前PNI是Ⅲ期结肠癌患者术后生存结局的重要预测指标。究其原因,可能是由于合并淋巴结转移的患者肿瘤负荷更高、肿瘤侵袭性更强,促使机体系统性炎症反应水平增高及营养消耗加重,导致预后不良。
Noble等[27]研究显示,血清白蛋白水平是食管胃交界肿瘤患者预后的独立影响因素。Garcia-Martinez等[28]认为,在白蛋白缺乏前机体已存在炎症反应紊乱,低蛋白血症是炎症反应持续存在的结果。须联合其他炎症指标以提高白蛋白水平对患者预后的预测能力[29]。PNI由血清白蛋白及外周血淋巴细胞总数两项客观指标计算得出,是反映机体营养及免疫状况的综合性指标。关于PNI可预测直肠癌新辅助放化疗后病理反应及患者预后的潜在机制目前尚不明确,可能为:(1) 卡培他滨为直肠癌新辅助放化疗的一线用药,口服经肠黏膜吸收后在药物代谢酶作用下催化为氟尿嘧啶发挥作用,低白蛋白可能导致化疗药物结合转化及运输障碍、分布异常,影响新辅助治疗效果。(2) 直肠癌患者由于肿瘤消耗及长期蛋白质摄入不足,出现白蛋白降低提示机体营养不良,营养不良是肿瘤局部复发及预后差的危险因素[30];且营养不良可能会导致患者自身防御能力下降,增加死亡率;白蛋白降解产物可为肿瘤提供营养物质支撑,加快肿瘤生长增殖[31]。(3) 淋巴细胞参与肿瘤细胞破坏及凋亡进程,抑制肿瘤细胞增殖及迁移,是机体免疫应答的重要成分,淋巴细胞减少提示预后不良[32]。(4) 营养不良患者体内炎症因子水平显著升高,升高的炎症因子可能会通过募集细胞因子及肿瘤相关巨噬细胞,刺激肿瘤细胞生长,诱导新生血管生成等促进肿瘤细胞侵袭和转移,影响患者预后[28]。总之,关于PNI预测病理反应及预后的机制仍须进一步探索,但PNI的预后预测价值值得肯定,同时提示治疗前评估患者营养及免疫状况并给予适当干预,可改善患者预后。此外,PNI在ypN阳性直肠癌患者术后临床治疗方案决策方面的价值亦值得深入研究。
总之,本研究结果显示基线PNI水平与Ⅱ、Ⅲ期直肠癌新辅助放化疗后肿瘤病理反应状态及患者预后相关,其疗效预测价值优于NLR、PLR及LMR。PNI因简单无创、经济有效,可作为临床预后预测指标的补充,但未来仍须在前瞻性、大样本、多中心临床研究中进一步评估及验证PNI的临床应用价值。
