饲喂成年牛瘤胃液对哺乳犊牛生长性能、纤维消化和血清生化指标的影响
2021-11-05郭延菲沈宜钊赵晓静曹玉凤李秋凤高艳霞李建国
郭延菲 沈宜钊 李 妍 赵晓静 曹玉凤 李秋凤 高艳霞,4* 李建国,4*
(1.河北农业大学动物科技学院,保定 071001;2.河北农业大学动物医学院,保定 071001;3.保定职业技术学院,保定 071001;4.河北省牛羊胚胎技术创新中心,保定 071001)
出生到断奶是犊牛生长发育的关键时期,这一时期犊牛胃肠道微生物区系经历着巨大的变化,会对犊牛的生长性能和健康状况造成终身影响[1]。这一阶段的犊牛除了会受到与母牛分离和适应新环境所带来的应激[2],从饲喂牛奶到颗粒料的转变也是一个巨大的挑战。Yang等[3]的研究表明,犊牛平均日增重的减少可能是由于营养物质的消化吸收能力不足所致。犊牛较低的采食量和生长速度,增加其发病率和死亡率,降低生产效率。因此,如何提高营养物质消化吸收和抗应激能力是犊牛生长过程中的关键问题。
动物消化道内的微生物区系是维持消化道功能的重要组成部分[4]。前人研究发现,不管是接种同一物种还是不同物种的消化道微生物,均能够定向地改善受体动物的生产性能[5-6]。因此,通过人工干预消化道微生物定植可能是改善犊牛肠道功能的重要方式。哺乳犊牛早期消化道尚未形成稳定的微生物区系,可能更适合通过人工干预的方式改善肠道微生物区系组成。给幼龄反刍动物接种成年反刍动物的消化道微生物,能够改善幼龄反刍动物消化道微生物区系的组成[7],加速特定微生物种群的建立,从而促进瘤胃发育[8],还可以通过防止病原体黏附或平衡肠道微生物区系来改善应激犊牛的免疫反应。对反刍动物来说,瘤胃液微生物区系与十二指肠、空肠、回肠、结肠和粪便的微生物区系均有极显著相关性[9],因此可能是一种有效的消化道微生物区系调节供体。Belanche等[10]研究发现,新鲜瘤胃液比灭菌瘤胃液能够更有效地提高山羊断奶期间的平均日增重,而张鑫[11]的研究证实,灭菌瘤胃液和新鲜瘤胃液对犊牛的生长性能无显著影响,但是灭菌瘤胃液的灌注有效降低了犊牛的腹泻率。由此可见,饲喂新鲜瘤胃液和灭菌瘤胃液对犊牛影响的研究结果不尽一致,需要做进一步研究。本试验采用饲喂瘤胃液与牛乳混合物的方式,探讨饲喂不同成年牛瘤胃液对犊牛生长性能、消化代谢和血清生化指标的影响,为合理选择瘤胃液和哺乳期犊牛益生菌开发提供参考。
1 材料与方法
1.1 瘤胃液的制备
选择3头健康、体况、体重和月龄相近的装有永久性瘘管的成年荷斯坦阉牛作为瘤胃液供体牛。将每次取得的瘤胃液混合均匀进行饲喂。供体牛饲粮组成及营养水平见表1。
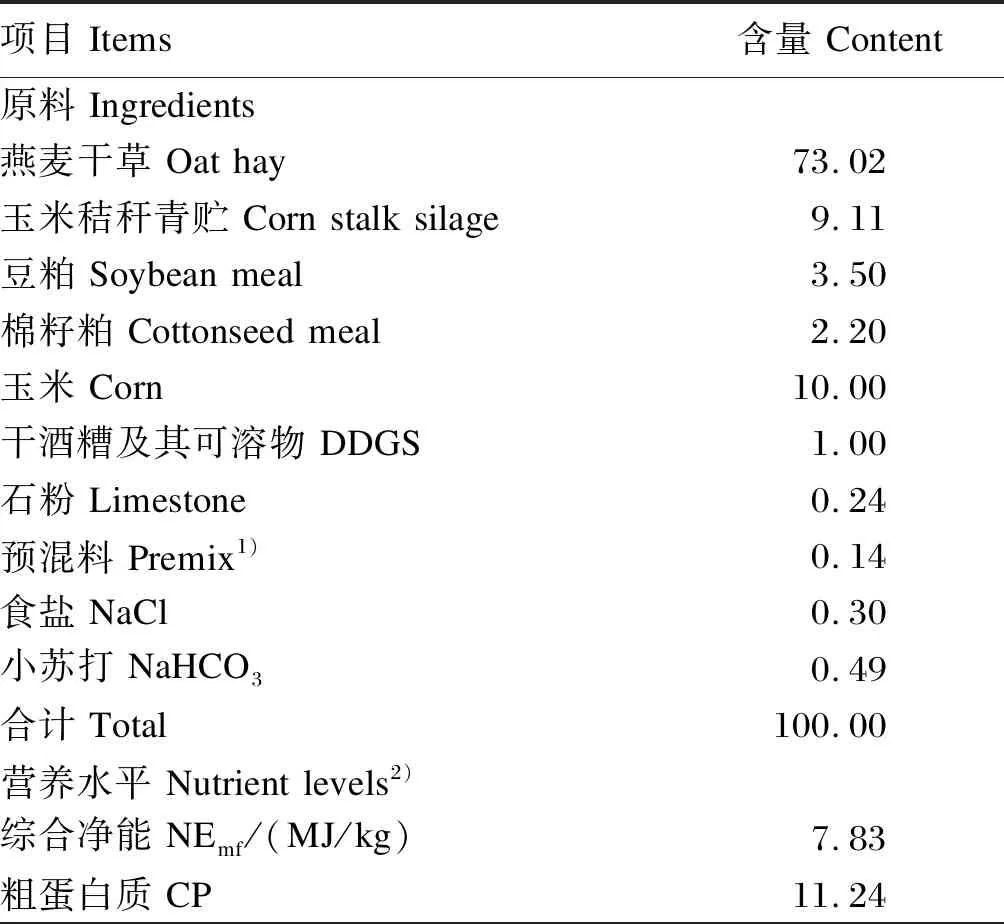
表1 供体牛饲粮组成及营养水平(风干基础)

续表1项目 Items 含量 Content中性洗涤纤维 NDF 50.16酸性洗涤纤维 ADF 31.15钙 Ca 0.61总磷 TP 0.40
1.2 试验设计
选择初生重(37.50~45.00 kg)相似的健康荷斯坦犊牛45头,随机分为3组,每组15头,各组间平均初生重差异不显著(P>0.05)。对照组犊牛饲喂生鲜牛乳,试验组犊牛在7~11日龄、21~25日龄和42~46日龄3个阶段饲喂的生鲜牛乳中分别添加50、80和110 mL新鲜成年牛瘤胃液(FRF组)或灭菌成年牛瘤胃液(ARF组)。供体牛的瘤胃液于晨饲之前通过瘘管采集,经4层无菌纱布过滤后,装入事先保温至约39 ℃的暖水瓶中,与牛乳混合后进行饲喂。其中,FRF组在采集瘤胃液后立即进行饲喂,而ARF组在瘤胃液采集完毕后于当日利用高压灭菌锅内进行灭菌,并于次日与FRF组同一时间饲喂。试验期共56 d。
1.3 犊牛饲养管理
犊牛出生后1 h内灌服4 L初乳,初乳在饲喂前需要通过折光率检测(不低于20)。之后安置于犊牛岛,单笼饲养,自由饮水。犊牛出生后的第1~7天每天每头饲喂牛乳7 L,第8~35天每天每头饲喂牛乳9 L,第36~56天每天每头饲喂牛乳5 L。从犊牛出生后第3天开始添加开食料,开食料及常乳的营养水平见表2。
1.4 样品的采集与处理
1.4.1 开食料与粪便样品的采集与处理
试验采用四分法采集开食料样品,于65 ℃烘48 h,制作成风干样品,粉碎过10目筛[用于测定中性洗涤纤维(NDF)和酸性洗涤纤维(ADF)含量]和40目筛[用于测定干物质(DM)、粗蛋白质(CP)、粗脂肪(EE)、粗灰分(Ash)、钙(Ca)和总磷(TP)含量],置于封口袋内保存。
分别在试验的第15~20天、第35~40天和第51~56天,每组随机选取12头牛,利用全收粪法收集粪便样品,取每天收集混匀后的粪便样品100 g,每次每头牛收集600 g,样品直接装入自封样品袋制备成风干样品,用于测定DM、NDF和ADF含量。
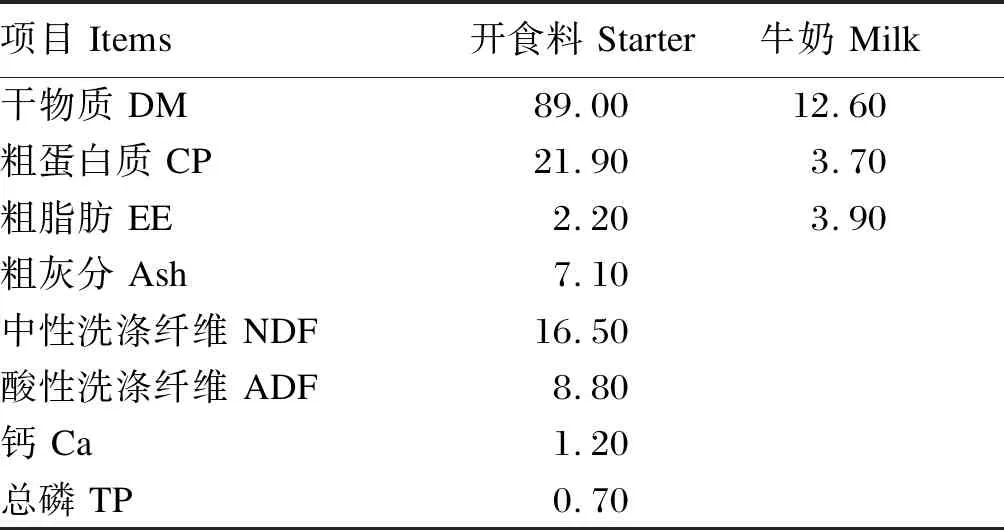
表2 开食料及常乳营养水平(风干基础)
1.4.2 血液样品的采集与处理
在试验的第56天晨饲之前,通过颈静脉采集犊牛血液样品于肝素抗凝管和促凝管中,将采集的血样37 ℃水浴30 min,1 240×g离心15 min,分装后于-20 ℃冷冻保存待测。
1.5 样品分析与测定
1.5.1 体重、体尺的测定
犊牛出生时和断奶当天(56日龄)晨饲前,空腹进行称重和体尺测定。平均日增重(ADG)为断奶重减去初生重除以56。体尺测定主要包括体高、体斜长、胸围、腹围和管围。其中,体高为从鬐甲最高点到地面的垂直距离,用测杖测量;体斜长为肩关节的前端到坐骨端的距离,用硬尺测量;胸围是肩胛骨后角处体躯的垂直周径,其松紧以能插上食指和中指上下滑动为准,用卷尺测量;腹围为后腿前部腹部的最大垂直周径,用卷尺测量;管围则是前掌骨1/3最细处的水平周径长度,用卷尺测量。
1.5.2 采食量的测定
试验期间,记录每头犊牛每天开食料的供给量和剩余量,采集新鲜开食料并于次日投料前采集各组剩余开食料300~500 g,于105 ℃烘至恒重,计算干物质(DM)含量。试验结束时,换算出各组犊牛的日均干物质采食量(ADMI)。
1.5.3 腹泻率的测定
每日早晚(08:00和17:00)各观察1次犊牛粪便情况,参考表3的评分标准对其进行评分,3分及3分以上记为腹泻。每头犊牛每腹泻1 d记为腹泻1次,按照下列公式计算犊牛腹泻率。
腹泻率(%)=(腹泻头数/总头数)×100。

表3 粪便评分标准
1.5.4 营养物质表观消化率的测定
开食料和粪便样品中DM含量根据AOAC官方方法934.01测定,NDF和ADF含量根据Van Soest等[12]的方法测定。酸不溶灰分法(GB/T 23742—2009)测定饲粮中DM、NDF和ADF的表观消化率,计算公式如下:
某营养物质表观消化率(%)=[(a/c-
b/d)/(a/c)]×100。
式中:a为饲粮中该营养物质含量(%);b为粪便中该营养物质的含量(%);c为饲粮中酸不溶灰分含量(%);d为粪便中酸不溶灰分含量(%)。
1.5.5 血清生化指标的测定
血清葡萄糖(GLU,A154-1-1)、总蛋白(TP,A045-4)、白蛋白(ALB,A028-2-1)、总胆固醇(T-CHO,A111-1-1)、甘油三酯(TG,A110-1-1)含量以及碱性磷酸酶(AKP,A059-2)、谷丙转氨酶(ALT,C009-2-1)、谷草转氨酶(AST,C0010-2-1)活性和总抗氧化能力(T-AOC,A015-3-1)采用南京建成生物工程研究所生产的试剂盒,使用酶标仪(Power wave XS2)测定。血清丙二醛(MDA,A003-1)含量采用南京建成生物工程研究所的试剂盒,使用分光光度计测定。
1.6 数据统计与分析
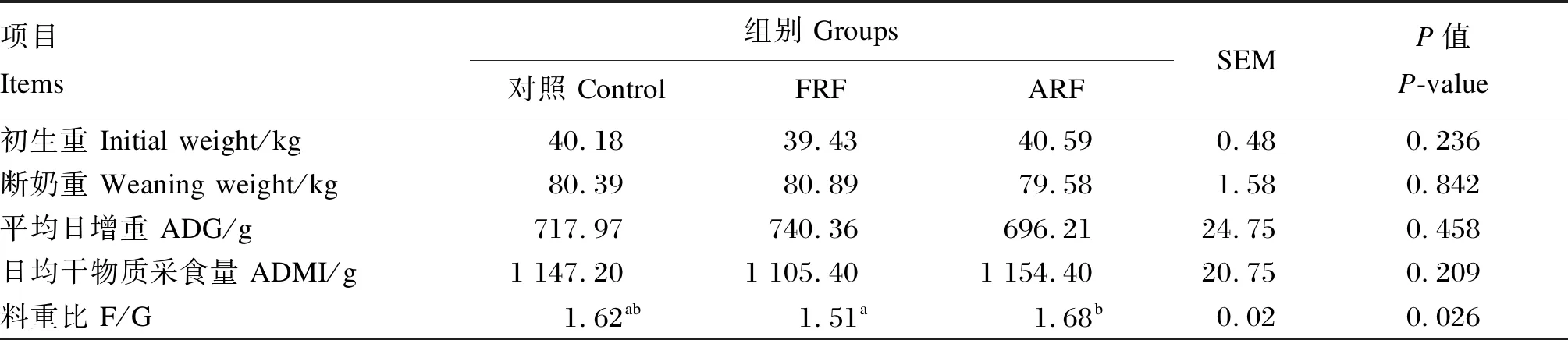
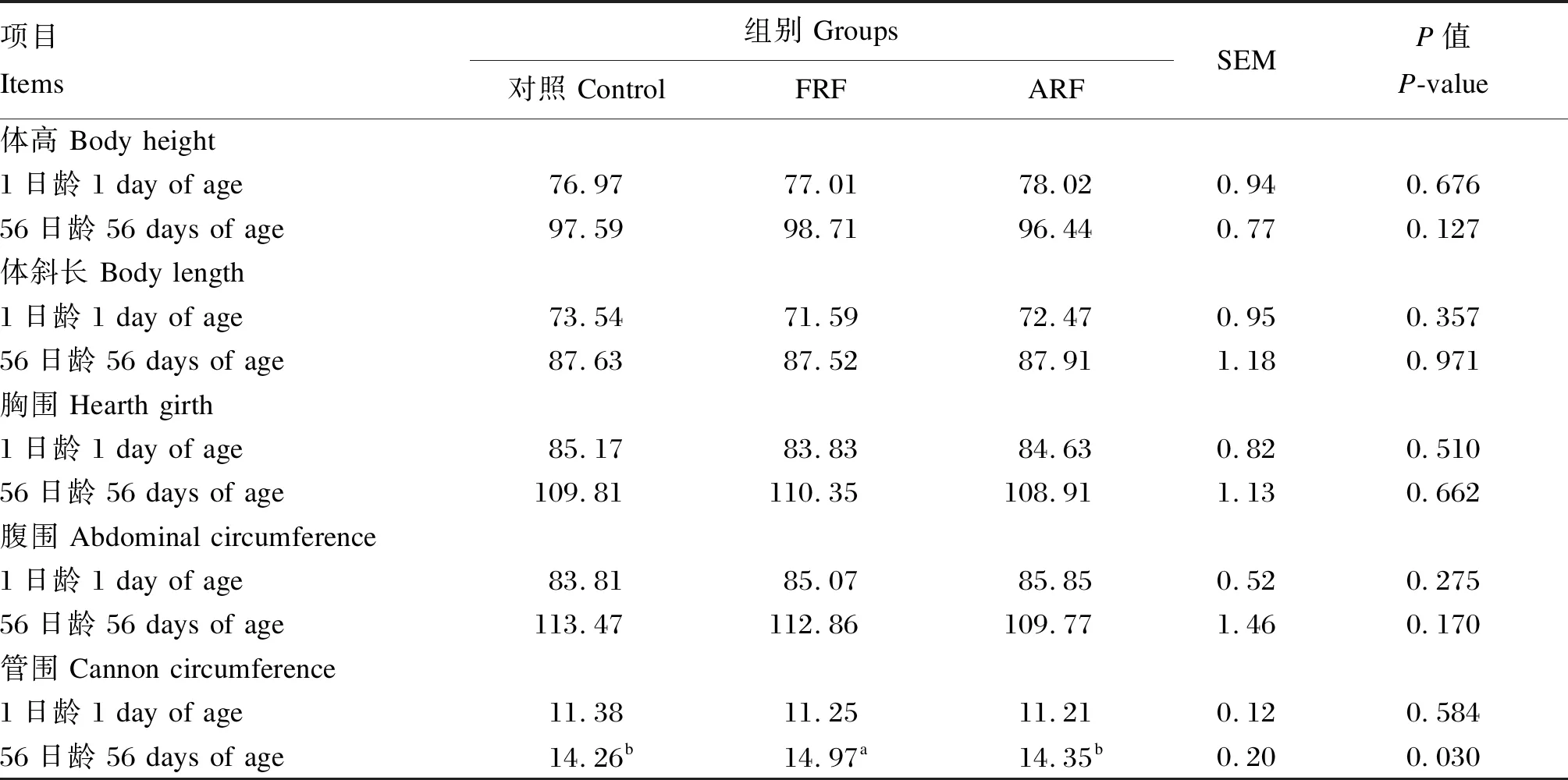
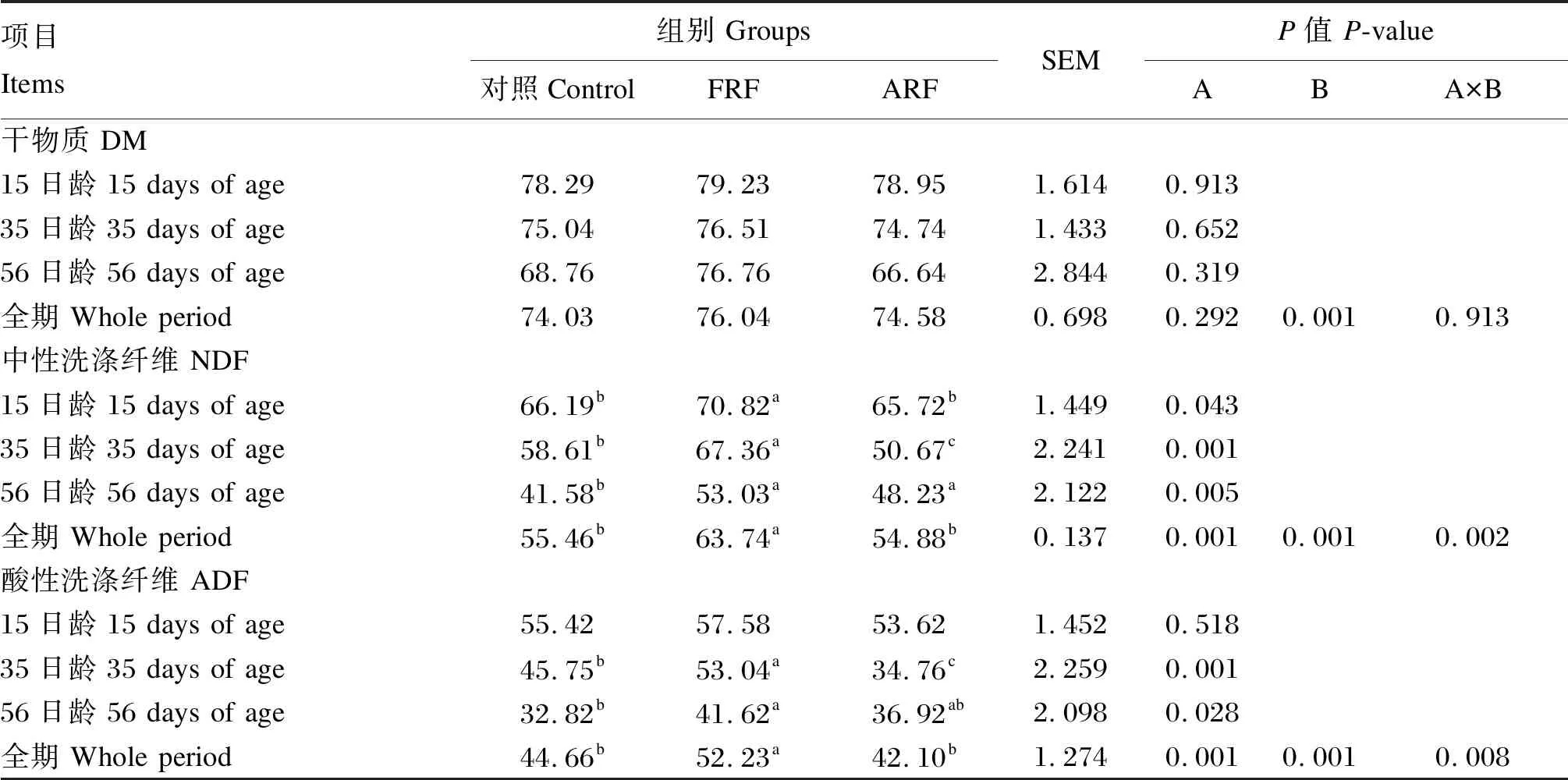
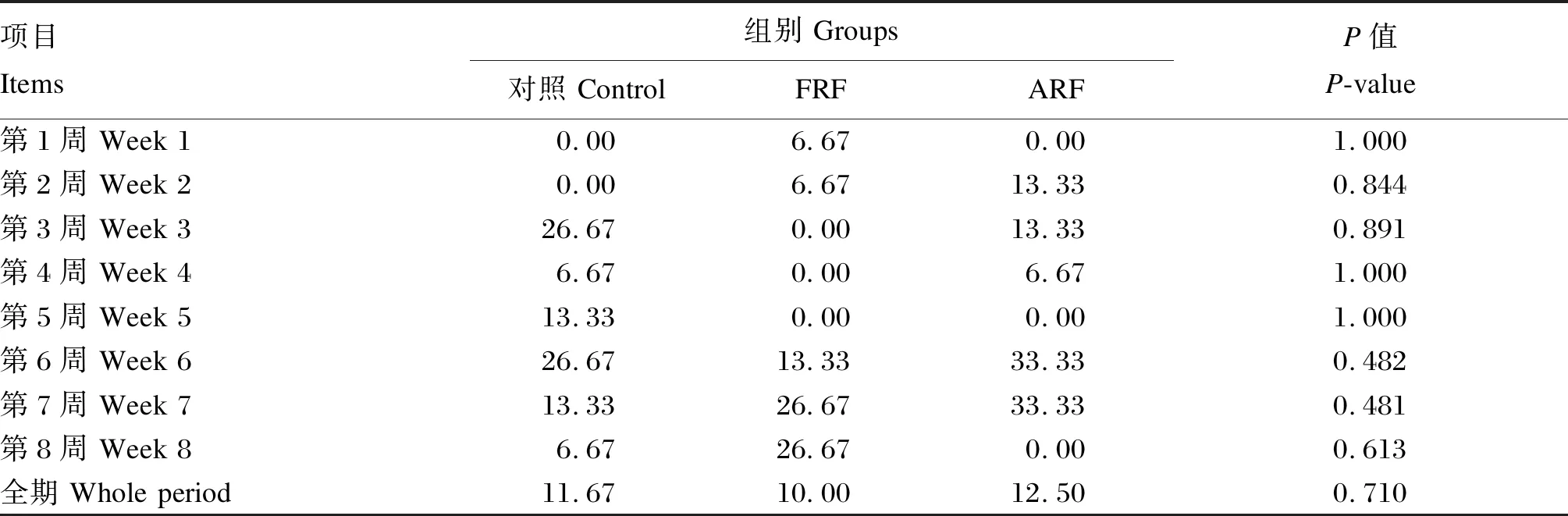
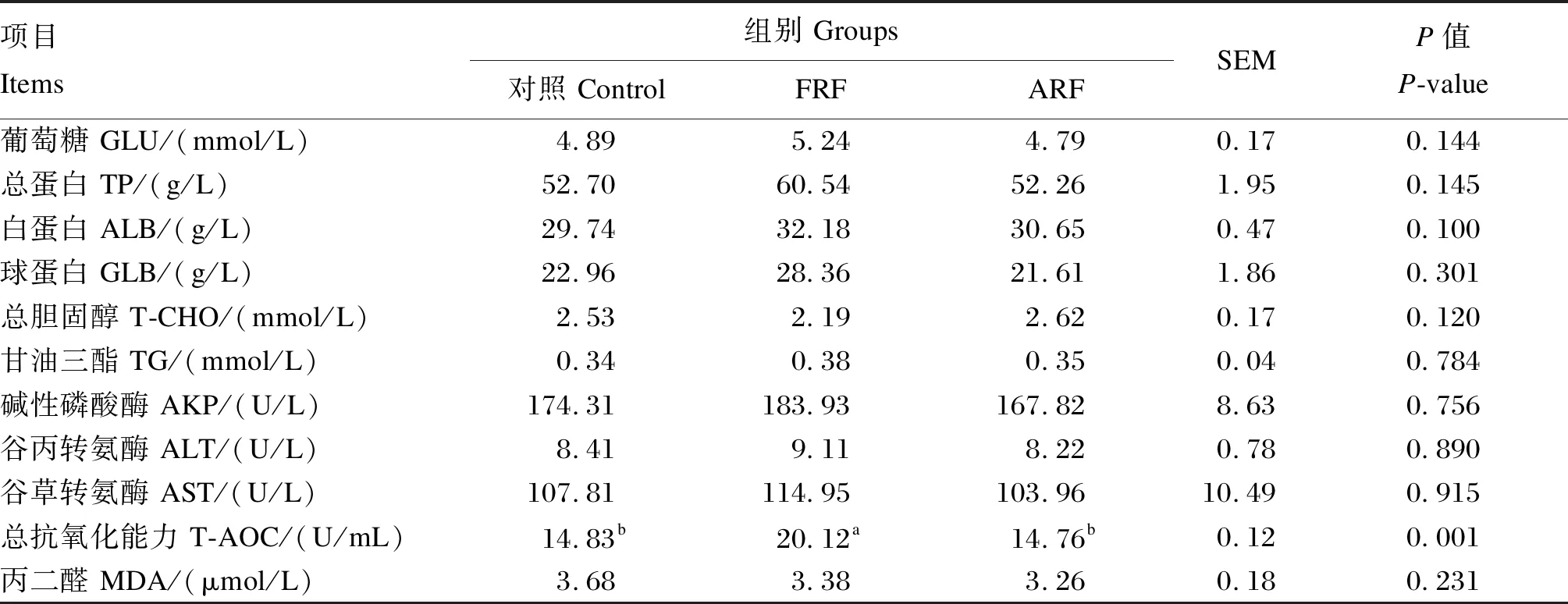
采用SAS 9.4软件的PROC MIXED模型进行数据分析,对于营养物质表观消化率指标,将试验处理、采样时间以及二者的交互作用作为固定因子,牛只作为随机因子进行方差分析。P≤0.05表示差异显著,0.05 由表4可知,各组犊牛的断奶重、平均日增重和日均干物质采食量均无显著差异(P>0.05),但是FRF组犊牛的料重比显著低于ARF组(P<0.05)。 表4 饲喂成年牛瘤胃液对犊牛生长性能的影响 由表5可知,1日龄时,各组犊牛的体高、体斜长、胸围和腹围均无显著差异(P>0.05)。56日龄时,除FRF组的管围显著大于对照组和ARF组外(P<0.05),各组犊牛的体高、体斜长、胸围和腹围均无显著差异(P>0.05)。 表5 饲喂成年牛瘤胃液对犊牛体尺的影响 由表6可知,不同处理对犊牛的DM表观消化率无显著影响(P>0.05),但是对NDF和ADF表观消化率有显著影响(P<0.05),处理和采样时间的交互作用对NDF和ADF表观消化率亦有显著影响(P<0.05)。15日龄时,FRF组犊牛的NDF表观消化率显著高于对照组和ARF组(P<0.05)。35日龄时,FRF组犊牛的NDF和ADF表观消化率均显著高于对照组和ARF组(P<0.05)。56日龄时,FRF组犊牛的NDF和ADF表观消化率显著高于对照组(P<0.05),与ARF组差异不显著(P>0.05)。综合全期(15~56日龄)的结果来看,FRF组犊牛的NDF和ADF表观消化率均显著高于对照组和ARF组(P<0.05)。 表6 饲喂成年牛瘤胃液对犊牛营养物质表观消化率的影响 由表7可知,各组犊牛的各周和全期(第1~8周)腹泻率均无显著差异(P>0.05)。 由表8可知,各组犊牛的血清GLU、TP、GLB、T-CHO、TG、MDA含量以及AKP、ALT和AST活性均无显著差异(P>0.05),但FRF组犊牛的血清T-AOC显著高于对照组和ARF组(P<0.05),而ALB含量相对于对照组和ARF组有提高的趋势(P=0.100)。 表7 饲喂成年牛瘤胃液对犊牛腹泻率的影响 表8 饲喂成年牛瘤胃液对犊牛血清生化指标的影响 动物消化道微生物-脑-肠轴在调节机体代谢过程中起着至关重要的作用[4],给围产后期奶牛灌注高产奶牛瘤胃液能够有效提高受体奶牛的采食量和采食频率[5],不同泌乳效率的奶牛瘤胃内容物互换其泌乳效率也随之改变[13]。Ribeiro等[6]报道,给肉牛灌注美洲野牛瘤胃液对饲粮DM和NDF的消化率无显著影响,却显著提高了瘤胃发酵效率和饲粮氮利用率。上述研究结果均证明新鲜菌群移植能有效改善受体动物的生产性能。然而,张鑫[11]研究发现,灌注新鲜瘤胃液与灭菌瘤胃液对犊牛生长性能无显著影响,但灭菌瘤胃液能够显著降低犊牛腹泻率,增加十二指肠绒毛高度,认为灭菌瘤胃液可能是改善犊牛生长性能的适宜处理方法。本试验发现,不管是新鲜瘤胃液还是灭菌瘤胃液,对犊牛ADG和ADMI均无显著影响,这与张鑫[11]的研究结果一致。本试验中,FRF组犊牛的饲料效率较对照组和ARF组有显著升高,这与FRF组犊牛的NDF和ADF表观消化率较高的结果是一致的,FRF组犊牛饲料效率的提高可能是由于该组犊牛对纤维物质的消化率高所致。本试验中FRF组和ARF组犊牛的ADG均无显著变化,这与前人的研究结果不一致。Muscato等[14]发现,饲喂新鲜瘤胃液和灭菌瘤胃液均可以提高犊牛的ADG,这可能与犊牛腹泻率的降低有关,本试验中犊牛的腹泻程度较低,因此瘤胃液处理对犊牛ADG并无显著影响。Belanche等[10]在山羊上的研究发现,在断奶前,不管是新鲜瘤胃液和还是灭菌瘤胃液对ADG均无显著影响,张鑫[11]在犊牛上的研究也未发现新鲜瘤胃液和灭菌瘤胃液对ADG存在显著影响,与本试验结果一致。 体尺是衡量犊牛生长发育的重要指标。体尺发育主要决定于犊牛的基因型,当营养摄入满足机体需要时,体尺通常差异不大[15]。本试验中,犊牛的体高、体斜长、胸围和腹围均不受试验处理的影响,与张鑫[11]的研究结果一致,这可能意味着整个试验期内各组犊牛的营养摄入足够。管围通常用来反映犊牛骨骼发育状况,主要受品种、遗传、年龄和饲养管理的影响[16],本试验中各组犊牛品种和年龄一致,FRF组管围显著高于对照组和ARF组,其原因可能与FRF组的ADG分别比对照组和ARF组提高3.12%和6.34%有关,是否与犊牛的遗传因素有关还尚需做进一步研究。 营养物质表观消化率是评定动物消化吸收能力的重要指标。犊牛的胃肠道发育程度、饲粮组成(牛奶、颗粒料、干草等)、采食量和环境是影响DM表观消化率的主要因素[17],本试验中各组犊牛的DM表观消化率差异不显著,可能是因为各组所用的饲粮组成和环境条件相同所致,这与Van Niekerk等[18]的研究结果一致,这也说明试验处理对胃肠道消化机能发育影响不大。FRF组犊牛纤维消化率更高可能与本研究所用的供体牛饲喂的是高粗料饲粮有关。Belanche等[10]在山羊上的研究发现,当供体动物饲喂高粗料饲粮时,能够显著提高受体动物消化道中的原虫数,而原虫本身能够有效提高饲粮中纤维成分的消化率[19],这可能是本试验中FRF组犊牛NDF和ADF表观消化率显著提升的原因之一。此外,新鲜瘤胃液中的活性耗氧细菌能够有效利用消化道中的氧气,为纤维降解菌提供更好的厌氧环境,而高粗料饲粮下,供体瘤胃液较高的pH也有利于纤维降解菌的生长,这可能是本试验中FRF组犊牛NDF和ADF表观消化率提升的原因之二。Zhong等[20]在山羊上的研究发现FRF组纤维消化率和饲料效率显著提高,而ARF组纤维消化率和饲料效率并无显著变化,这与本试验结果一致。犊牛前期NDF和ADF的消化率相对较高,可能与犊牛以牛奶为主要营养来源,纤维性碳水化合物饲料采食量较低有关。随着日龄的增加,犊牛以固体饲料为主的采食量随之增加,犊牛对NDF和ADF的消化率相对降低[1,21]。 GLU、TG和T-CHO是衡量机体能量代谢的重要指标,通常在机体自身激素调节的作用下,保持稳定,但是当机体能量摄入出现变化时,各指标也会随之变化[22]。本试验中,各组犊牛血清中GLU、TG和T-CHO含量均无显著差异,意味着各组犊牛的能量水平相对一致,这与本试验中各组犊牛的ADMI无显著差异一致。血清TP含量是衡量蛋白质代谢的重要指标,本试验中,各组犊牛的血清TP含量无显著差异。能量和蛋白质是保证机体生长发育最重要的营养素,本试验中,各组犊牛的血清GLU、TG、T-CHO和TP含量无显著差异,因此,各组犊牛的ADG和体尺也与之一致无显著差异。血清ALT和AST活性是衡量肝脏损伤的重要指标,其通常会在肝脏出现损伤时上升[23]。本试验中,各组犊牛的血清ALT和AST活性均无显著差异,这表明各组犊牛均未发生肝脏损伤。血液中的T-AOC和MDA含量是衡量机体抗氧化能力的重要指标,通常T-AOC越高意味着机体抗氧化能力越强,而MDA含量则与之相反[24]。本试验中,虽然各组犊牛血清MDA含量无显著差异,但是FRF组较高的T-AOC意味着该组犊牛的机体抗氧化能力有明显增强。前人研究发现抗氧化能力与应对各种应激的能力有明显的正相关关系[25-26],瘤胃内环境越稳定,机体的抗氧化能力越强,饲喂新鲜成年牛瘤胃液可能改善了犊牛胃肠道的健康,激活了与抗氧化有关的酶,这可能是FRF组血清T-AOC较高的原因。本试验中FRF组较高的血清T-AOC说明FRF组也许应对各种应激的能力更强,因此腹泻率最低。本试验中,各组犊牛腹泻率虽然差异不显著,但是T-AOC的提高可能与腹泻率缓解有关,这与卢奇成等[27]的研究结果一致。 新生犊牛饲喂新鲜成年牛瘤胃液对其ADG、ADMI、体尺和腹泻率等无显著影响,但提高了饲粮纤维的利用率和饲料效率,并改善了犊牛并改善了犊牛机体的抗氧化能力;新生犊牛饲喂灭菌成年牛瘤胃液对其生长性能、纤维消化和血清生化指标均无显著影响。2 结 果
2.1 饲喂成年牛瘤胃液对犊牛生长性能的影响
2.2 饲喂成年牛瘤胃液对犊牛体尺的影响
2.3 饲喂瘤胃液对犊牛营养物质表观消化率的影响
2.4 饲喂成年牛瘤胃液对犊牛腹泻率的影响
2.5 饲喂成年牛瘤胃液对犊牛血清生化指标的影响
3 讨 论
3.1 饲喂成年牛瘤胃液对犊牛生长性能的影响
3.2 饲喂成年牛瘤胃液对犊牛体尺的影响
3.3 饲喂成年牛瘤胃液对犊牛营养物质表观消化率的影响
3.4 饲喂瘤胃液对犊牛血清生化指标的影响
4 结 论
