菌根真菌对带叶兜兰驯化苗的生长效应
2021-11-05苏莉花陈宝玲龚建英杨开太周千淞汪小玉陶梦华
苏莉花,陈宝玲,舒 杰,龚建英,杨开太,周千淞,汪小玉,陶梦华
(1.广西壮族自治区林业科学研究院,广西南宁 530002;2.广西壮族自治区国有七坡林场,广西南宁 530225)
兰科(Orchidaceae)兜兰属(Paphiopedilum)植物在自然条件下繁殖力低,种群更新缓慢,野生资源濒危;其人工繁殖近年来发展较快,但存在人工繁殖系数低、成苗慢、成本高和产出少等问题,导致兜兰属植物产业发展遭遇瓶颈[1-3]。
兰科菌根真菌是指能与兰科植物的根(或根状器官)形成内共生关系或与兰科植物形成单向有利关系的真菌类群,有明显的专一性,并与共生兰科植物的稀有性和濒危性显著相关[1]。兰科菌根真菌具有独特的生态功能,可促进种子萌发和幼苗形态发生,有助于兰科植物的迁地保护、就地保护和离体保存与再引入,影响生物群落组成,有利于生态系统的保护、恢复与重建[4-5]。兰科菌根真菌有丰富的多样性,与宿主兰科植物在植株不同的生长阶段有不同的营养关系和作用方式,即兰科植物在每个生长阶段都有对其最有效的菌根真菌,菌苗始终保持共生关系[4-6]。在兰科植物的人工栽培中引入菌根化育苗技术,幼苗移栽成活率、鲜质量增长率、干物质积累及矿质元素吸收等均显著提高[7-8]。一些菌根真菌的代谢产物能分泌赤霉素和IAA 等植物生长调节剂[9-10],这些真菌可构成有益真菌群落。与大花蕙兰(Cymbidium faberi×hybridum)形成有益共生体的黄丝菌科(Cephalothecaceae)Cephalotheca属真菌通过侵染大花蕙兰的根被细胞,可极大地促进植株对钙、镁和锌等矿质元素的吸收,提高幼苗抗性,促进生长素和叶绿素的合成,减少叶绿素降解和碳水化合物的形成[10-12]。分离自野生石斛(Dendrobium nobile)根部的3 株优势真菌与两种石斛组培苗共生培养16 天后,可显著提高鲜重、酶活性及光效应,使植物保持较高的叶绿素a/b值[13]。目前,对兰科菌根真菌与兜兰属植物共生作用的深入研究较少。
本研究将分离筛选得到的有益菌根真菌与不同生长阶段的带叶兜兰(P.hirsutissimum)驯化苗分别进行共生培养,分析5 个月后驯化苗生长指标的变化,对比不同生长阶段驯化苗生长指标的差异,验证兰科菌根真菌的功效,探讨菌根真菌与带叶兜兰共生关系建立的最佳时期与不同菌根真菌的适用范围。将菌根真菌应用于菌根育苗实践,促进兜兰属植物幼苗的快速繁殖,缩短苗期,可为珍稀濒危植物的保护提供理论依据,为兜兰产业的规模化发展提供技术支撑。
1 材料与方法
1.1 试验材料
1.1.1 供试植株
供试的带叶兜兰驯化苗分别为试管苗出瓶移栽后的1年生和2年生苗,长势基本一致;1年生苗有4~6 条根,4~5 片叶,叶幅5~6 cm;2年生苗有7~8条根,6~7片叶,叶幅8~10 cm。
1.1.2 供试菌株
菌株为PF01、PF02、PF06 和PF07,其中PF01、PF06 和PF07 分离自广西天峨县野生带叶兜兰新鲜营养根,PF02 分离自广西那坡县野生紫纹兜兰(P.purpuratum)新鲜营养根,经筛选和验证均为带叶兜兰的菌根真菌。经16S rDNA序列测定与分析,PF01为Cladosporium perangustum,PF02 为Kirschsteinio⁃thelia tectonae,PF06 为Phialophorasp.,PF07 为Cy⁃phellophorasp.。
1.1.3 基质及容器
栽培基质为松树皮、火山岩和木炭的混合基质(4∶2∶1),高温灭菌后装入容器中。容器为塑料透明软杯;1年生苗的栽培容器为1.5 寸杯(口径5 cm、高5 cm、底径3.5 cm),基质粒径0.7~1.0 cm;2年生苗的栽培容器为2.5 寸杯(口径8 cm、高8 cm、底径5 cm),基质粒径1.5~2.0 cm;2株/杯。
1.2 试验方法
1.2.1 菌株活化
将供试的4 个菌株接种至PDA 培养基平板上,在光照培养箱中28 ℃恒温暗培养5~7天。
1.2.2 液体菌剂制备
用打孔器(直径5 mm)在活化的4 个菌株菌落边缘打孔,制成菌饼;将菌饼分别移入装有150 mL PDB 培养基的三角瓶中,每个三角瓶接种2~3个菌饼。接种后,将三角瓶置于28 ℃、140 r/min 的摇床上连续培养10 天,收获并过滤菌丝体;将菌丝体用无菌水冲洗3~5 次,置于研钵中研磨成匀浆;称取2.0 g 匀浆置于试管中,加入10 mL 无菌水,制成菌悬液备用。
1.2.3 接种方法
在离驯化苗茎基部2 cm 处,刨开表面基质,用10 mL 一次性注射器吸取菌悬液注入,用量为10 mL/杯。每处理30杯,重复3次。每20天浇施1次菌悬液,连续进行3~4 次,期间停止施肥及施药。以无菌水等量浇施为对照(CK)。
1.2.4 兰科菌根真菌重分离
共生培养150 天后,取带叶兜兰接种菌株的1年生和2年生驯化苗植株和CK 植株若干,挑选新生根系,经0.1% HgCl2溶液表面消毒1 min 后,用无菌水清洗4 次。采用组织块分离法[14]进行菌根真菌重分离,将新生根系置于含1 µL/mL 庆大霉素的PDA培养基上,28 ℃恒温暗培养7~10天,观察各处理根系长菌的情况。
1.3 指标测定
2021年2月,共生培养150 天后,采用电子天平(精度为0.000 1 g)测定幼苗鲜重;采用游标卡尺(精度为0.1 mm)测量根系长度、叶幅、叶长和叶宽等指标,记录新根数和萌芽数;晴天上午9 点,采用便携式叶绿素仪(SPAD-502)测定叶绿素的相对含量;取平均值。
1.4 数据处理
采用Excel 软件进行统计;采用DPS7.05 软件进行Duncan's新复极差检验。
2 结果与分析
2.1 共生关系的建立
培养150 天后,接种菌株的驯化苗植株在重分离中均能分离出对应的原接种菌株,在CK 植株中主要分离出镰刀菌(Fusarium)菌株(表1)。说明原接种菌株与带叶兜兰幼苗形成了共生关系,确定为带叶兜兰的兰科菌根真菌。

表1 菌根真菌重分离情况Tab.1 Re-isolation of mycorrhizal fungi
2.2 兰科菌根真菌对1年生驯化苗生长的影响
各处理间1年生驯化苗的生长差异较大,接种菌株驯化苗的整体长势优于不接种(图1a)。PF06处理的1年生驯化苗生长最好,各指标均表现较好;鲜重、叶幅和叶长均极显著优于其他处理(P<0.01)(表2)。PF06 处理的新根数最多(2.2 条),与PF07处理差异显著(P< 0.05),与CK 处理差异极显著(P<0.01);其次为PF01 和PF02 处理,分别为1.5 和1.4条。PF06处理的根最长(17.5 cm),与CK 处理差异显著(P<0.05);其次为PF07、PF01和PF02处理,分别为16.3、16.1 和13.5 cm,三者间差异不显著。PF06处理的叶最宽(1.6 cm),与CK处理差异极显著(P< 0.01)。PF01 处理的相对叶绿素含量最高(31.6%),与PF02 处理差异极显著(P<0.01)。在1年生阶段,最佳的菌根真菌为PF06,接种后,幼苗生长迅速,根系活力提高,新叶生长较快,平均萌芽数0.4 个,体现了良好的菌-苗共生关系,促生效果好;PF01 和PF02 有利于植株根的生长发育;PF01 有利于增强光合作用。
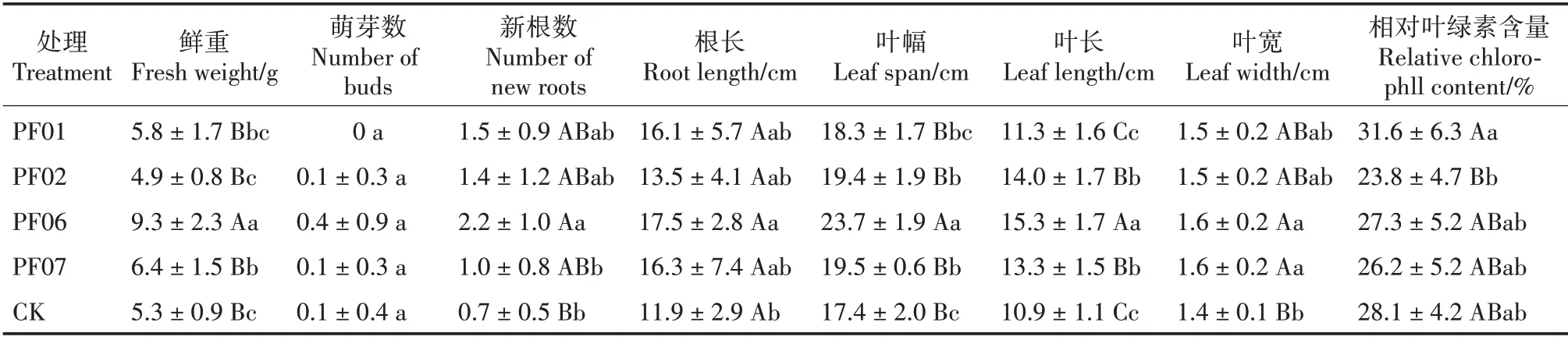
表2 菌根真菌对1年生驯化苗生长的影响Tab.2 Effects of mycorrhizal fungi on growth of 1-year-old seedlings
2.3 兰科菌根真菌对2年生驯化苗生长的影响
各处理间2年生驯化苗的生长差异也较大,接种菌株驯化苗的整体长势优于不接种(图1b)。PF06 处理的2年生驯化苗生长最好,除根长和相对叶绿素含量外,其他生长指标均表现最好,平均鲜重14.4 g,平均萌芽数1.5 个,新根数3.1 条,叶幅28.3 cm,叶长19.4 cm,叶宽1.9 cm,均极显著优于CK 处理(P< 0.01)(表3)。PF01 处理的根最长(28.4 cm);除叶幅与PF06 处理差异极显著(P<0.01)外,其他生长指标均与PF06 处理差异不显著。PF02 处理的相对叶绿素含量最高(31.5%);除鲜重与PF06 处理差异显著(P< 0.05)外,其他生长指标均与PF06 处理差异不显著。PF07 处理的叶片生长较好,叶幅、叶长和叶宽均显著或极显著优于CK 处理(P<0.05,P<0.01)。真菌PF06 为对2年生带叶兜兰驯化苗整体生长最好的菌株,PF01可较好地促进植株根系的生长发育,PF02可促进植株地上和地下部分的生长,PF07有利于植株叶片生长。

图1 菌根化育苗Fig.1 Mycorrhizal seedling
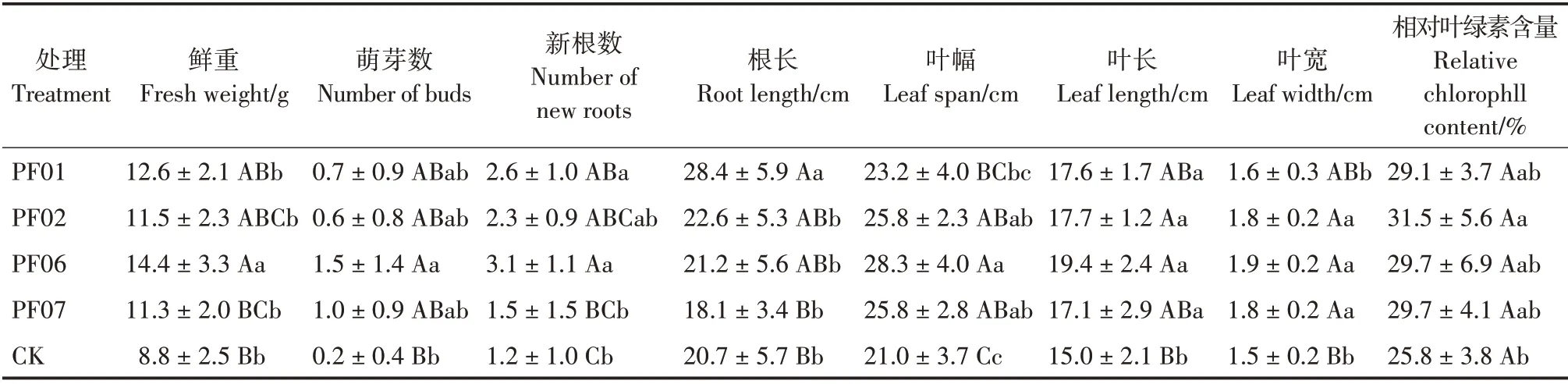
表3 菌根真菌对2年生驯化苗生长的影响Tab.3 Effects of mycorrhizal fungi on growth of 2-year-old seedlings
2.4 兰科菌根真菌对1年生和2年生驯化苗各生长指标增长的影响
对比分析共生150 天后接种PF06 与CK 处理的1年生和2年生驯化苗的各项指标(图2)。接种菌株植株在两个生长阶段的主要生长指标增幅基本一致,即PF06对两个生长阶段的植株均能产生较好的促生作用。接种PF06 处理两个阶段驯化苗的各生长指标增量(除1年生相对叶绿素含量)均高于CK处理,体现了菌根真菌较好的促生效果。

图2 PF06对带叶兜兰两个生长阶段驯化苗生长指标增长的影响Fig.2 Effects of PF06 on increments of growth indexes in two growth stages of P.hirsutissimum seedlings
3 讨论与结论
兰科植物是一种典型的菌根植物,要完成整个生命史并在生态系统中生存,离不开菌根真菌和微生物的促进作用。在同一兰科植物不同的生长阶段,适宜其生长的菌根真菌种类及真菌发挥的功能有所不同,菌苗间的营养关系表现各异[12,15-16]。苗期是兰科植物生长的瓶颈期,此时植株对不适宜共生病原菌的抗性最低[17]。五唇兰(Doritis pulcherrima)与内生真菌建立共生的专一性随生长形态(生理阶段)的不同而显著不同,种子共生萌发率低,但原球茎和幼嫩植株能与多种真菌有效共生,移栽后粗放管理的菌根苗成活率可达100%,成株后共生真菌的分布范围相对宽松,体现了兰科菌根体系的生存适应性[18-19]。根据植物的生长阶段,现有的兰科植物菌根化育苗技术可分为播种菌根化育苗、瓶内菌根化育苗和移栽菌根化育苗3 种[20],这些育苗技术在兰科植物栽培和保育中均有报道。
兜兰属植物为较原始的兰科植物种类之一,自然繁殖慢,人工繁殖难度比其他兰科植物大,生长周期长。将菌根真菌应用于带叶兜兰的人工育苗实践,可促进驯化苗生长,不同菌株在驯化苗的不同生长阶段促生效果不同。PF06 对带叶兜兰1年生和2年生驯化苗的整体生长均有较好的促生作用,体现了该菌对带叶兜兰幼苗促生的广谱性;PF01 有利于1年生与2年生植株根的生长发育,可增强植株叶片的光合作用;PF02 有利于1年生植株根的生长发育,可促进2年生植株地上和地下部分的生长;PF07 有利于2年生植株叶片的生长。在同一生理阶段,与对照相比,4 个不同菌株均有较好的促生作用,从一定程度上体现了菌苗共生关系建立的广泛性。本结论与陈宝玲等[5]、朱鑫敏等[7]、周玉杰等[16]、陈金花等[21]和谢玲等[22]的相关研究结论一致。对带叶兜兰1年生驯化苗,可优先接种PF06、PF01 和PF02 菌株或其中2~3 个菌株混合接种;对2年生驯化苗,可优先接种PF06、PF07 和PF02 菌株或其中2~3 个菌株混合接种,在这一阶段,进行大规模的菌根化育苗不仅可以有效地建立菌苗共生关系,而且更适合批量化操作,有非常好的应用前景。移栽后两年内的驯化苗均可接种菌根真菌,但在实际生产中需在驯化苗的不同生长阶段选择最合适的接种时期接种最适宜的菌根真菌,以达到最好的促生效果;PF06(Phialophorasp.)在两个生长阶段均表现出较好的促生效果,可作为带叶兜兰苗期的通用益生菌制剂,用于带叶兜兰的保育和栽培。
