BRAF突变晚期NSCLC的靶向和免疫治疗研究进展
2021-11-05李娜徐艳珺范云
李娜 徐艳珺 范云
肺癌是全球癌症中发病率和死亡率最高的癌症之一[1]。其中非小细胞肺癌(non-small cell lung cancer,NSCLC)的发生率为85%-90%,主要包括腺癌(占40%-50%)和鳞癌(占20%-30%)[2]。大约30%的NSCLC患者存在对靶向治疗敏感的基因改变[如表皮生长因子受体(epidermal growth factor receptor,EGFR)突变、间变性淋巴瘤激酶(anaplastic lymphoma kinase,ALK)重排和c-ros肉瘤致癌因子-受体酪氨酸激酶(ROS protooncogene 1, receptor tyrosine kinase,ROS1)融合][3],在肺腺癌中甚至高达45%[4]。随着精准医疗和基因检测技术的发展,越来越多的基因被发现与NSCLC相关,其中鼠类肉瘤病毒癌基因同源物B1(v-raf murine sar-coma viral oncogene homolog B1,BRAF)基因可能是NSCLC中又一个重要的驱动基因[5]。美国国家综合癌症网络(National Comprehensive Cancer Network, NCCN)指南已将其作为有效靶点进行常规筛查推荐[6]。并且,联合应用BRAF和MEK抑制剂也已成BRAFV600E突变NSCLC患者的标准治疗。然而对于非BRAFV600E突变的肺癌患者仍然遵循无驱动基因的治疗方案,缺乏有效的靶向治疗策略。免疫检查点抑制剂(immune checkpoint inhibitor, ICI)目前是另一个治疗驱动基因野生型肺癌的重要手段[7]。目前已有研究提示ICI治疗BRAF阳性的NSCLC有部分获益。本文将针对BRAF阳性晚期NSCLC患者的靶向和免疫治疗研究进展作一综述。
1 BRAF基因概述
1.1BRAF基因的生物学特征BRAF基因是一种重要的原癌基因,定位于7号染色体,有18个外显子,编码BRAF蛋白,与A-RAF和C-RAF同属于RAF家族[8],是RAS-RAFMEK-ERK通路的上游调节因子,参与丝裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK)级联反应,在调控细胞生长和繁殖中发挥重要作用。MAPK通路信号异常主要由RAS和BRAF突变所导致,当突变发生时,BRAF蛋白磷酸化并使下游细胞外调节激酶(extracellular regulated kinases, ERK)持续激活,最终导致肿瘤的发生[8,9]。所有RAF蛋白都能磷酸化MEK,但BRAF的激酶活性最高[10]。
BRAF基因突变主要发生于CR3激酶结构域的外显子11和15,根据激活RAS的信号机制和激酶活性可以将BRAF突变分为三个功能类别:激酶激活单体V600突变(I类)、激酶激活二聚体非V600突变(II类)和激酶受损的非V600突变异二聚体(III类)[11]。常见的V600E突变是第600位氨基酸上的缬氨酸(V)取代谷氨酸(E),允许BRAF作为结构性活性单体发挥作用[12];非V600突变可以增加或削弱BRAF激酶活性,以CRAF介导的方式激活ERK通路[13]。临床前研究[11]提示,与I类突变相比,II类和III类BRAF突变更有可能与RAS基因突变共存,即非V600突变更有可能发生RAS共突变,一项大型回顾性研究也得出了这一结论。Planchard教授[14]在2020年美国临床肿瘤学会年会(American Society of Clinical Oncology, ASCO)的报道提示BRAF突变同时具有KRASG13C、cMET14跳读、PIK3CA等共突变的患者接受靶向治疗同样显示疗效。
1.2BRAF突变的临床特征BRAF基因突变是一种广谱的基因突变,最早发现于人类尤文氏肉瘤,在恶性实体瘤中的发生率约为7%[9],恶性黑色素瘤中约为50%[8]、甲状腺乳头状癌为36%-53%、散发性结直肠癌为5%-22%,低级别卵巢浆液性癌约为30%[15]。BRAF突变在肺癌中的检出率为1%-3%,以肺腺癌多见[16],在不同国家和人种中没有显著差异[17-19],其中V600E突变和非V600E突变各占BRAF突变肺癌的50%[20]。
一项回顾性研究分析了1,837例EGFR突变NSCLC患者的临床和分子特征,发现在相同驱动基因的NSCLC患者中,不同的突变亚群可能具有不同的临床特征,并且他们从相同治疗中获益的程度可能存在差异[21]。另有一项纳入了1,046例NSCLC患者的回顾性研究发现,BRAFV600E突变肺癌患者多为女性、不吸烟者,且80%的V600E突变肿瘤具有微乳头特征,与较短的无病生存期(disease-free survival, DFS)和总生存期(overall survival,OS)显著相关,而非V600E突变者均有吸烟史,与预后无明显相关性[17,18]。最近的一项荟萃分析[22]报告了BRAF突变NSCLC的临床特征,纳入了16项研究共11,711例NSCLC患者,研究提示女性患者中的BRAF突变率略高于男性(3.02%vs2.43%,P=0.02),但这与另一项研究[23]中的荟萃分析结果相反,而V600E突变患者多无吸烟史,这与以往的研究结果相同。以上回顾性研究提示,与BRAF非V600E突变相比,V600E突变与NSCLC不良预后相关,一线化疗的DFS和OS较短,但两者在性别、年龄方面无显著差异[24]。2012年-2013年法国国家癌症中心的一项晚期NSCLC分子筛查项目(n=17,664)对其中的230例BRAF突变患者进行了为期1年的治疗效果跟踪评估[25],结果发现以化疗为主的这部分人群一线缓解率仅为23%,二线缓解率仅为9%,且与EGFR阳性或ALK阳性人群相比,其中位OS及无进展生存期(progression-free survival, PFS)均较短,这项结果显示BRAF突变NSCLC患者以化疗为主的治疗预后较差。
1.3BRAF突变的检测 目前NCCN指南推荐的BRAF突变检测方法有Sanger测序、实时聚合酶联反应(real-time polymerase chain reaction, RT-PCR)、二代测序(nextgeneration senquencing, NGS)等。Sanger测序属于一代测序,主要用于点突变和小变异突变,可以检测V600突变及罕见突变,但其灵敏度较低,无法检测到染色体拷贝数和易位的变化[26],对肿瘤细胞的含量要求较高(>20%)[27]。RT-PCR是一种能够检测已知突变的有针对性的方法,它的检测下限较低,能检测7%的突变DNA拷贝数,且价格低廉,灵敏度达到97.5%,对于V600E和V600K的检出率较高,主要缺点是罕见的BRAF突变亚型经常被遗漏[28,29]。NGS能够同时进行多基因检测,包括所有可能的变异类型,比如突变、插入和扩增,其DNA检测下限为5%,可以获得更广泛的分子图谱,确定患者可能获得靶向治疗的其他罕见基因驱动突变,缺点是耗时较长[30]。免疫组化(immunohistochemistry, IHC)是检测BRAFV600E突变的另一个可选方法,最常用的抗体是单克隆抗体VE1,具有较高的敏感性和特异性[31],对于所有BRAF非V600E突变的检测特异性也能达到100%。它的主要缺点在于由于BRAFV600E的高度异质性或低丰度可能出现假阴性,并且目前缺乏BRAFV600K或其他变异体的抗体,这种诊断测试不能确定是否存在其他突变。此外,由于IHC识别蛋白质而不是DNA,因此IHC和基于DNA的检测结果之间可能存在差异[28]。上述检测方法均以组织活检为基础,但近年来液体活检发展迅速,成为许多无法获取组织标本患者的替代选择。但由于血液缺乏解剖学特异性,血液中BRAF突变DNA的存在并不能提示肿瘤的数量或肿瘤的来源,液体活检仍存在局限性[28]。
2 BRAF突变NSCLC的靶向治疗
BRAF阳性NSCLC患者的靶向治疗药物主要包括BRAF抑制剂和MEK抑制剂,既往的研究发现两种靶向药物联合治疗疗效优于单药[32-34]。
2.1 BRAF抑制剂
2.1.1 维罗非尼(Vemurafenib) 维罗非尼是BRAF的选择性抑制剂,能有效抑制BRAF V600E的活性,半数抑制浓度(half maximal inhibitory concentration, IC50)可达到31 nmol/L,2011年被美国食品药物监督管理局(Food and Drug Administration, FDA)批准治疗含有BRAFV600E突变的不可切除或转移性恶性黑色素瘤。维罗非尼治疗NSCLC有抗肿瘤活性的第一个确凿证据来自一项针对BRAFV600E阳性非黑色素瘤癌症的篮子研究[35]。这项研究中的NSCLC队列入组了19例BRAFV600E阳性的经治患者,接受维罗非尼单药治疗,第8周客观缓解率(objective response rate, ORR)达到42%,中位PFS为7.3个月,12个月OS为66%。研究结果达到了预设终点,随后进行了队列扩展,共纳入62例NSCLC患者,其中包括54例经治患者和8例初治患者[36]。经过平均10.7个月的随访,经治患者ORR为37.0%(95%CI: 24.3%-51.3%),中位PFS为6.1个月,中位OS达到15.4个月。初治患者的ORR为37.5%(95%CI: 8.5%-75.5%),中位PFS为12.9个月,中位OS未成熟,最常见的不良反应是恶心(40%)。与经治患者相比,维罗非尼作为初治患者一线治疗时的PFS延长了1倍。
在一项回顾性EURAF队列研究中,共纳入35例BRAF突变晚期NSCLC患者,其中包括29例V600E突变、6例非V600E突变,接受不同的BRAF抑制剂治疗,包括维罗非尼、达拉非尼或索拉非尼[16]。31例患者接受一种BRAF抑制剂,4例患者前后接受了两种抑制剂。接受BRAF单药靶向治疗患者的ORR为53%(95%CI: 35.1%-70.2%),疾病控制率(disease control rate, DCR)为85%(95%CI:68.9%-95.0%)。其中24例接受维罗非尼治疗的可评价患者,ORR为54%(95%CI: 32.8%-74.4%),DCR为96%(95%CI: 78.9%-99.9%)。总体人群的中位PFS为5个月,OS为10.8个月;V600E突变组的PFS为9.3个月,非V600E突变组PFS为1.5个月。
法国国家癌症研究所有一项关于维罗非尼的篮子试验[37],以评估维罗非尼对BRAF阳性实体瘤的疗效和安全性。在NSCLC队列中有118例患者,包括101例BRAFV600突变,17例BRAF非V600突变,BRAFV600突变分别为97例V600E、2例V600K、1例V600D和1例V600M,中位随访时间为23.9个月。在BRAF非V600队列中,没有观察到客观反应,该队列被停止。在BRAFV600队列中,ORR为44.9%,中位PFS为5.2个月(95%CI: 3.8-6.8),OS为10个月(95%CI: 6.8-15.7)。以上研究均提示BRAFV600E突变肺腺癌患者相比非V600E突变的患者更能从靶向治疗中获益。
2.1.2 达拉非尼(Dabrafenib) 达拉非尼是BRAF激酶的可逆性抑制剂,通过抑制失控的BRAF蛋白抑制肿瘤生长。达拉非尼对BRAF突变NSCLC患者有效,最初是在一项I期试验[38]中发现的,该试验招募BRAF突变实体瘤患者。在这项研究中,唯一的BRAFV600E突变NSCLC患者对该治疗有反应,后来的全球研究中发现其作用类似于维罗非尼,2013年FDA批准其用于治疗BRAFV600E突变黑色素瘤。
Planchard教授[32]发起的BRF113828 II期临床研究中,84例BRAFV600突变NSCLC患者接受单药达拉非尼治疗,其中包括78例经治患者和6例初治患者。结果显示达拉非尼的ORR为33%,DCR为58%,中位PFS为5.5个月,中位OS为12.7个月。84例患者中有35例(42%)发生了严重不良事件,但大多数不良反应是可耐受的。这项二期临床研究提示达拉非尼单药治疗在BRAFV600E阳性NSCLC患者中有一定的抗肿瘤活性,但治疗效果有限。
2.2 达拉非尼联合Trametinib BRAF抑制剂单药的耐药机制可能与MAPK通路的重新激活有关,如果在BRAF抑制剂中加入MEK抑制剂,可能通过阻断ERK信号通路,从而延长了患者的疾病控制时间[9]。达拉非尼联合Trametinib在治疗BRAFV600E突变的NSCLC患者中表现出协同效应[39]。
BRF113928是一项达拉非尼单药或联合曲美替尼治疗BRAFV600E突变经治或初治晚期NSCLC患者的II期临床研究,研究分为三个队列:队列A是达拉菲尼单药组,队列B是达拉非尼与曲美替尼联合治疗经治患者组,队列C是联合治疗初治患者组。
队列B入组了57例患者,ORR达到了63.2%(95%CI:49.3%-75.6%),中位PFS为9.7个月(95%CI: 6.9-19.6),6个月OS为65%(95%CI: 51%-76%),数据截止时,中位OS不成熟[33]。初治组中共36例患者接受一线达拉非尼加曲美替尼治疗,经过中位15.9个月随访,ORR为64%(95%CI: 46%-79%),DCR为75%(95%CI: 58%-88%),中位PFS为10.9个月(95%CI: 7.0-16.6),中位OS为24.6个月(95%CI: 12.3-未达),最常见的不良反应是发热[34]。队列C中共36例初治患者接受一线联合治疗,中位PFS为10.9个月(95%CI: 7.0-16.6),中位OS为24.6个月,ORR达到64%[34]。与单药BRAF靶向治疗相比,双靶联合在一线和后线治疗BRAFV600E突变的NSCLC中均显示出获益。基于这项研究,2017年FDA批准了BRAF-MEK双靶治疗BRAFV600E突变的晚期NSCLC患者[4]。
法国的GFPC真实世界研究[40]纳入了40例既往经治或未治的晚期BRAFV600E突变NSCLC患者,接受达拉非尼联合曲美替尼治疗。结果显示,中位PFS和OS分别为17.5个月(95%CI: 7.1-23.0)和25.5个月(95%CI: 16.6-未达)。9例接受一线治疗患者的中位PFS为16.8个月(95%CI: 6.1-23.2),中位OS为21.8个月(95%CI: 1.0-未达),31例接受二线及以上治疗的患者中位PFS和OS分别为16.8个月(95%CI: 6.1-23.2)和25.5个月(95%CI: 16.6-未达),其中不良事件导致7例患者(18%)永久停止治疗,8例患者(20%)中断治疗,研究提示达拉非尼联合曲美替尼治疗经治或未治的BRAF V600E晚期NSCLC表现出客观的有效性和可控的安全性。
在一项中国NSCLC患者的回顾性研究[41]中,共纳入65例患者,其中54例存在BRAFV600E突变,11例是非V600E突变。在接受BRAF抑制剂治疗的30例V600E突变患者中,维罗非尼单药、达拉非尼单药以及达拉非尼联合曲美替尼治疗的中位PFS分别为7.8个月、5.8个月和6个月(P=0.970)。对于一线化疗,V600E和非V600E患者的中位PFS相似(5.4个月vs5.4个月,P=0.825)。这项研究提示BRAF靶向治疗对携带BRAFV600E突变的中国NSCLC患者有临床获益。
2.3 其他新药 Lifirafenib(BGB-232)是一种新型的RAF家族关键激酶和EGFR抑制剂,它对BRAFV600突变的实体瘤的疗效评估正处于一期临床试验阶段[42]。在这项一期研究中,53例BRAF突变实体瘤患者中,8例(15.1%)获得部分缓解(partial response, PR),27例(50.9%)为疾病稳定(stable disease, SD),结果提示Lifirafenib治疗BRAFV600突变实体瘤患者有一定程度的获益,但有必要进一步研究Lifirafenib单药治疗或联合使用的安全性和有效性。目前Lifirafenib联合MEK抑制剂治疗BRAF突变实体瘤的I期/II期试验已经开始招募(NCT03905148)。
所有的BRAF突变都会激活ERK磷酸化,因此推测ERK信号通路调控的转录因子是BRAF突变的潜在下游靶点[9],BRAF和MEK抑制剂的获得性耐药可能与MAPK信号通路中ERK的重新激活有关。临床前证据也发现小分子ERK抑制剂能延缓耐药性的出现。在一项多中心I期剂量递增和扩展的临床试验(NCT01781429)[43]中,BRAF基因突变患者共91例,ERK激酶抑制剂Ulixertinib在BRAFV600和非V600突变的实体瘤中均显示出抗肿瘤活性,其中28例BRAF非V600突变中50%有客观反应。这项研究首次提供了临床证据,提示BRAF非V600突变可能通过下游ERK抑制而起作用,这为治疗BRAF非V600突变的实体瘤患者提供了新的研究靶点。
磷脂肌醇3-激酶/蛋白激酶B/雷帕霉素靶蛋白(phosphoinositide-3 kinase/protein kinase B/mammalian target of rapamycin, PI3K/AKT/mTOR)通路参与了多种实体肿瘤的发生,包括黑色素瘤、NSCLC、乳腺癌、结肠癌等,可能是BRAF-MEK靶向治疗获得性耐药机制之一。PX-866是一种不可逆异构体PI3K抑制剂,与BRAF抑制剂联合应用对黑色素瘤细胞株的增殖有协同抑制作用。Yam等[44]在晚期BRAFV600突变肿瘤患者中进行了PX-866和维罗非尼联合用药的多中心I期研究,以确定PX-866和维罗非尼的联合用药的安全性。由于这项研究没有招募到BRAF突变的NSCLC患者,联合用药对这类患者的疗效是未知的,但联合使用PI3K抑制剂和BRAF抑制剂可能是治疗BRAFV600突变肺癌患者的另一种新的尝试。
3 BRAF突变NSCLC的免疫治疗
在驱动基因阳性的NSCLC患者中,ICI的活性相当弱,对于未经选择的NSCLC患者有效率为14%-20%[45]。因此,免疫治疗在驱动基因阳性肺癌患者中的疗效仍在探索阶段,免疫治疗在携带BRAF突变的NSCLC患者中的有效性也尚不明确。
IMMUNOTARGET是一项回顾性分析免疫治疗在驱动基因阳性晚期NSCLC中疗效的临床研究[46]。研究纳入551例各类驱动基因阳性肺癌患者,其中BRAF队列中入组了43例,中位治疗线数为二线,程序性细胞死亡受体配体1(programmed cell death ligand 1, PD-L1)中位表达水平是50%,ORR为24%,中位PFS为3.1个月,中位OS为13.6个月,这项研究提示免疫治疗对BRAF突变的NSCLC患者的疗效有限,BRAFV600E与其他BRAF突变的生存获益也没有统计学差异。在另一项GFPC研究[47]中也得出了相似的结论。

表1 BRAF突变晚期NSCLC靶向治疗临床研究汇总Tab 1 Summary of clinical study of targeted treatment for BRAF-mutant advanced NSCLC
在另一项以色列多中心回顾性研究[48]中,入组了39例BRAF突变晚期NSCLC患者,队列包括21例BRAFV600E突变患者(A组)和18例BRAF非V600E突变患者(B组)。A组和B组中分别有42%和50%的病例PD-L1高表达(TPS≥50%)(P=0.05)。在39例患者中,22例患者(A组57%,B组55%)接受了免疫治疗(Nivolumab,n=11;Pembrolizumab,n=10; Atezolizumab,n=1)。结果表明免疫治疗的ORR为28%,在V600E和非V600E突变队列中免疫治疗疗效与PD-L1表达水平之间无显著相关性。这项研究的局限性是缺乏接受ICI治疗的BRAF野生型患者作为对照,在意大利的一项回顾性研究[49]中补充了这一不足,这项研究共1,588例NSCLC患者接受Nivolumab二线治疗,BRAF状态未知人群OS为11.0个月,而BRAF野生型亚组和BRAF突变亚组的OS分别为11.2个月和10.3个月,ORR分别为9.1%和19.6%。因此,BRAF突变患者二线使用Nivolumab治疗疗效有限。
在2020年中国的一项多中心回顾性研究[50]中,收集了4,178例患者免疫治疗的信息,探索免疫治疗在BRAF突变NSCLC患者中的疗效。在BRAF突变型和BRAF野生型亚组分析中,野生型的PD-L1表达高于突变型(P=0.198),而突变型的TMB高于野生型(P=0.009),但OS在两组之间没有差异(P=0.334)。进一步分析发现BRAF非V600E组的中位OS远高于BRAFV600E组(14个月vs5个月),且达到了统计学差异(P=0.017)。
综上,免疫治疗在靶向治疗耐药的BRAF突变型患者的二线或后线治疗中,疗效与未经选择的患者无显著差异,BRAF突变型NSCLC患者从免疫治疗中有一定获益,但非常有限[49]。笔者收集了目前国内外针对或者包含BRAF突变NSCLC患者的靶向或者免疫治疗的临床研究,如表2所示。所有资料均来源于https://www.chinadrugtrials.org.cn和https://www.clinicaltrials.gov。
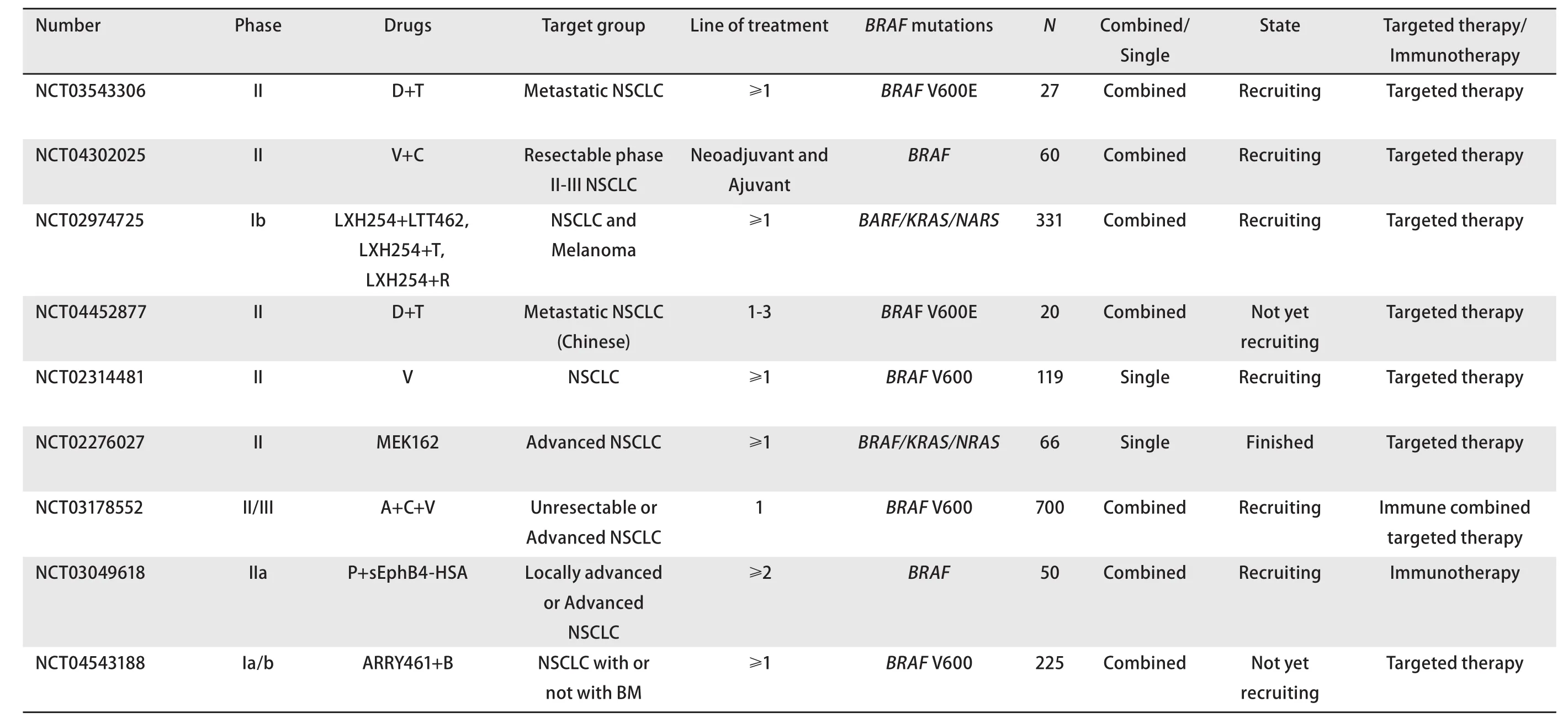
表2 BRAF突变晚期NSCLC患者的靶向或免疫临床研究概况Tab 2Summary of clinical studyof targeted treatment andimmunotherapy for BRAF-mutant advanced NSCLC
4 探索与展望
目前BRAF抑制剂联合MEK抑制剂是治疗BRAFV600E突变的晚期NSCLC患者最有效的策略,且不受治疗线数的影响[51]。对于靶向治疗耐药的患者,免疫治疗对其有一定疗效,但获益有限,双靶治疗联合免疫治疗仍处于研究探索阶段。
尽管靶向治疗已经取得了显著的疗效,但大部分患者的耐药仍不可避免。目前对黑色素瘤的获得性耐药机制研究较多,对NSCLC患者的BRAF靶向耐药机制尚未完全阐明。在对BRAF抑制剂耐药的黑色素瘤患者中检测到了PTEN缺失,且具有PTEN缺失的患者接受BRAF抑制剂治疗的PFS更短,这或许提示PTEN缺失与BRAF抑制剂原发耐药有关[51]。有相关研究[52-54]报道BRAFV600E突变NSCLC患者靶向治疗出现耐药,涉及KRASG12D、KRASG12V或NRASQ61K突变的出现,且最初的BRAFV600E驱动突变并未消失,因此RAS抑制剂联合BRAF抑制剂双靶治疗减少耐药的发生可能是一种新的研究方向。此外,BRAFV600E突变也被发现可能是第三代TKI奥希替尼的耐药机制之一,有病例报道使用奥西替尼耐药的EGFR突变患者接受达拉非尼、曲美替尼和奥希替尼三靶治疗获得了13.4个月的临床应答[55],但其安全性及有效性仍有待后续大样本的研究。
目前针对BRAF非V600E突变的NSCLC的治疗策略尚未有系统的靶向治疗方案,化疗仍是其首选的治疗方案。一项基础研究[24]发现MEK抑制剂和EGFR抑制剂联合应用可以使BRAF非V600E突变型小鼠肺癌瘤体显著退缩。可能的机制是,在激酶活性升高的BRAF非V600E细胞中,EGFR通过野生型CRAF激活MAPK信号,使RAS强烈激活,但EGFR抑制剂可以中断此途径。因此,EGFR突变在激活MAPK信号中起关键作用,在激酶活性降低的BRAF非V600E突变细胞中也是MAPK信号的主要调节因子。EGFR抑制剂联合MEK抑制剂或许可以使BRAF非V600E患者受益,但需要进一步的临床研究证实。
5 总结
BRAF突变是NSCLC的不良预后因子,目前双靶联合是BRAFV600E突变晚期NSCLC的一线标准方案,对比单靶治疗、化疗和免疫治疗,双靶治疗显示出疗效和安全性上的双重优势。探索耐药机制、克服耐药机制以及研发新型的靶向药物是目前BRAF突变晚期NSCLC的热门研究方向。
