血管活性药物评分与心血管外科术后急性肾损伤的相关性研究
2021-11-05侯克龙沈骁李静邹磊章淬穆心苇
侯克龙 沈骁 李静 邹磊 章淬 穆心苇
233000 蚌埠市第三人民医院重症医学科(侯克龙);210006 南京医科大学附属南京医院(南京市第一医院)重症医学科(沈骁、李静、邹磊、章淬、穆心苇)
急性肾损伤(acute kidney injury,AKI)是心血管外科手术后常见且严重的并发症之一,严重危害患者健康和生命[1-2]。近年研究表明,血管活性药物评分(vasoactive-inotropic score,VIS)可预测接受心脏手术的成年患者术后预后和死亡率,特别是术后24 h内VIS最高值(the maximum of vasoactive-inotropic score,VIS-max)被发现是心脏手术后不良结局的良好预测指标[3-7],但目前缺乏针对VIS-max与心血管外科手术后急性肾损伤(cardiac and vascular surgery-associated acute kidney injury,CVS-AKI)相关性的研究。本研究回顾性分析了VIS-max是否与CVS-AKI独立相关。
1 对象和方法
1.1 研究对象
本研究为单中心回顾性观察性研究。筛选2017年9月至2019年5月南京医科大学附属南京医院重症医学科收治的所有开胸心脏和大血管外科手术患者。研究对象纳入标准:(1)年龄≥18周岁;(2)体外循环下接受心血管外科手术,包括冠状动脉旁路移植术、瓣膜置换或修复术、心脏移植术、升主动脉或主动脉弓置换手术以及左心房黏液瘤切除术等其他手术。排除标准:(1)慢性肾脏病;(2)既往有肾脏切除术、肾脏移植术或肾动脉狭窄病史;(3)术前存在AKI;(4)术后24 h内死亡。本研究经南京医科大学附属南京医院(南京市第一医院)伦理委员会批准(伦理批号:KY20180713-02);本研究为回顾性观察性研究,故可免除患者知情同意。
1.2 数据收集
收集并整理患者的临床资料,记录术前特征:年龄、性别、体质指数(body mass index,BMI)、既往高血压、冠心病和2型糖尿病等病史、估算肾小球滤过率(estimated glomerular filtration rate,eGFR)、血肌酐(serum creatinine,SCr)、血红蛋白(hemoglobin,Hb)、白蛋白、血尿酸以及血中性粒细胞明胶酶相关脂蛋白(neutrophil gelatinase associated lipocalin,NGAL)等;围术期变量:手术方式、手术时间、体外循环时间、术中输血量;术后24 h内变量:VIS-max、血乳酸、液体平衡等;术后行持续性肾脏替代治疗(continuous renal replacement therapy,CRRT)的相关信息。
根据KDIGO指南定义,(1)SCr在48 h内升高≥0.3 mg/dl(26.5 μmol/L);(2)或在7 d内SCr升高达到基线值的1.5倍;(3)或尿量<0.5 ml·kg-1·h-1持续6 h,作为AKI的诊断标准[8]。根据患者术后是否发生AKI,分为CVS-AKI组和非CVS-AKI组。
1.3 计算VIS-max
记录患者术后24 h内血管收缩性药物和正性肌力药物的使用剂量,并选取最高值作为VIS-max。VIS计算公式[3-5, 9]:VIS=多巴胺(μg·kg-1·min-1)+多巴酚丁胺(μg·kg-1·min-1)+100×肾上腺素(μg·kg-1·min-1)+50×左西孟旦(μg·kg-1·min-1)+10×米力农(μg·kg-1·min-1)+10 000×血管升压素(units·kg-1·min-1)+100×去甲肾上腺素(μg·kg-1·min-1)。
1.4 统计学方法
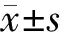
2 结果
2.1 基本临床资料
本研究共筛选2 112例心血管外科术后患者,排除年龄<18岁5例、慢性肾脏病患者51例、既往肾脏切除术6例、术前存在AKI 6例和术后24 h内死亡3例,最终纳入2 041例患者,其中非CVS-AKI组1 644例(80.5%),CVS-AKI组397例(19.5%)。
术后发生AKI的患者年龄较大,男性较多,更可能既往存在高血压、2型糖尿病、脑卒中和吸烟史;另外,此类患者术前SCr、NGAL和尿酸水平较高,术前Hb、白蛋白和eGFR较低,手术时间和体外循环时间更长,需要输注更多的红细胞悬液,详见表1。

表1 两组患者的基本临床资料比较
按照KDIGO标准的定义[8],在2 041例接受心血管外科手术患者中,从术后第1天到第7天共279例患者发生AKI-1期(13.7%)、73例患者发生AKI-2期(3.6%)和45例患者发生AKI-3期(2.2%)。其中,有41例患者需行CRRT治疗,AKI-1期患者中有4例(0.2%),AKI-1期患者中有17例(0.8%)以及AKI-3期患者中有20例(1.0%),详见表2。

表2 2 041例患者术后AKI分期及CRRT治疗情况[例(%)]
2.2 相关变量与术后AKI的相关性分析
单因素logistic回归分析显示年龄、SCr、血尿酸等指标具有统计学意义,进一步将单因素logistic回归分析有统计学意义的变量纳入多因素logistic回归分析方程,结果显示,术前SCr、NGAL、Hb和血尿酸水平,术中红细胞输注量,术后24 h内血乳酸水平和VIS-max(OR=1.30,95%CI:1.24~1.37,P<0.001)与患者术后AKI发生存在一定相关性,详见表3。

表3 术后AKI发生的相关性分析
2.3 VIS-max对术后AKI的预测作用
在表3的多因素logistic回归分析结果中,VIS-max的OR值比术后24 h内血乳酸水平和术中红细胞输注量的OR值小,但根据ROC曲线分析结果显示,VIS-max(ROC曲线下面积:0.847,95%CI:0.827~0.868,P<0.001)对CVS-AKI发生的预测能力优于术后24 h内血乳酸水平(ROC曲线下面积:0.686,95%CI:0.654~0.717,P<0.001)和术中红细胞输注量(ROC曲线下面积:0.595,95%CI:0.564~0.627,P<0.001)。另外,当取VIS-max截断值为6.5分时,其预测CVS-AKI发生的敏感度为83.4%,特异度为72.8%(图1)。

图1 VIS-max预测CVS-AKI发生的ROC曲线
3 讨论
心血管外科手术后患者并发AKI常常与预后密切相关,不仅增加了患者的住院时间和病死率,而且随着AKI病情加重,慢性肾脏病的发病率和远期病死率均升高。因此,寻找可纠正的危险因素以及有效且特异性强的预测指标对预防CVS-AKI的发生尤为重要[1, 10]。
1995年,Wernovsky等[11]首次描述了正性肌力药物评分(inotrope score,IS),该评分可用于量化心血管药物支持的量,并在临床研究中用于衡量接受心脏手术的患者的疾病严重程度[12]。2010年,Gaies等[13]将IS评分扩大到其他常用的血管活性药物,包括米力农和去甲肾上腺素等,并将其称为VIS。此后的一些研究表明,VIS对婴幼儿、青少年和成人心脏手术后短期不良预后均具有良好的预测准确性和判别能力[3-6, 14-15]。
目前,针对VIS与心脏大血管手术后AKI相关性的研究不多。Shahin等[16]发现,心脏手术后患者正性肌力药物使用与肾功能不全(校正OR=2.7,95%CI:1.5~4.6,P<0.05)和住院病死率(校正OR=2.3,95%CI:1.2~4.5,P<0.05)独立相关。也有学者发现,心脏手术后较高的VIS与AKI之间存在关联(OR=1.2,95%CI:1.06~1.35,P=0.003)[17]、体外循环心脏手术结束时较高VIS的患者更易发生不良预后事件(包括肾功能不全)(OR=4.87,95%CI:1.51~18.94,P=0.007)[4]。本研究发现,VIS-max是CVS-AKI的独立危险因素,当VIS-max≥6.5分能有效预测CVS-AKI的发生(ROC曲线下面积=0.847,95%CI:0.827~0.868,P<0.001)。
VIS-max与CVS-AKI之间具有相关性,其解释可以分为两个方面。一方面,通过血流动力学紊乱来间接说明。CVS-AKI的病因包括血流动力学紊乱、局部缺血-再灌注损伤、氧化应激反应的激活以及游离血红蛋白和铁的释放等[1-2, 9],在这些危险因素中,血流动力学紊乱,尤其是肾灌注不足,被认为是心血管手术后AKI发生的重要决定因素[1, 9]。在CVS-AKI的患者中,围术期常使用血管活性药物和正性肌力药物来治疗低血压和心血管功能障碍,可以认为VIS量化了心血管药物支持的量,间接说明更高的VIS表示更严重的血流动力学障碍[5, 13]。因此,术后AKI更易发生在血流动力学障碍、VIS更高的患者中。另一方面,血管活性药物可能对肾脏具有直接损伤作用。有研究表明,高剂量血管活性药物和正性肌力药物,尤其是儿茶酚胺类,对器官功能产生有害作用,并引起免疫介导的损伤[6, 18]。一项研究结果显示,心脏手术后儿茶酚胺水平更高的患者AKI发病率更高(31%比19.5%比13.7%,P=0.038),并且这类患者肾功能恶化更严重,需要肾脏替代治疗(7.8%比2.4%比0%,P=0.026)[19]。
目前,针对计算VIS-max的最佳时机尚无定论。本研究选择在心血管外科术后第1个24 h内计算VIS-max的原因有以下两点:第一,心血管外科手术中及术后的多种因素会导致患者心功能下降、血容量不足以及外周血管阻力改变,这些情况在术后首个24 h内更为显著,而且在这段时间内患者的生命体征也最不稳定。因此,相对于术前、术后48 h或术后72 h,在术后24 h内这个时间段计算血管活性药物和正性肌力药物的使用剂量峰值,以用于评估血流动力学紊乱对肾功能的影响更有价值[3, 5]。第二,本研究2 041例心血管外科术后患者中共1 892例患者(92.7%)在术后第2天就已转回心胸外科普通病房,无法准确地进行每小时监测血管活性药物的使用情况、平均动脉压等信息,所以通过计算术后72 h或48 h的VIS-max来预测全部的2 041例患者术后AKI具有一定的偏倚性。另一方面,也有国外研究表明,在心脏手术前[15]、术后36 h内[14]及术后48 h内[6]的VIS-max与术后肾功能不全存在相关性。因此,为了能充分明确VIS对心血管外科术后AKI的预测价值,在未来的大样本前瞻性研究中有必要在手术前或其他时间(如在手术期间或术后24、48或72 h内)测量VIS的峰值。
本研究存在以下局限性。首先,这是一项回顾性观察性研究,存在数据和资料不全的缺点,如缺少术中VIS、血乳酸、平均动脉压和中心静脉压水平的监测、术后是否并发出血或感染等,这些因素可能与CVS-AKI相关。其次,我们未将VIS-max与其他心脏手术风险评分[9, 20](如Cleveland评分或CRATE评分)进行比较。最后,本研究缺乏有关CVS-AKI患者长期预后(如1年死亡率)和生存分析的相关信息,后期需要更多前瞻性研究来进一步验证。
综上所述,术后24 h内VIS-max与心血管外科手术后AKI发生存在一定的相关性,并且可在一定程度上预测术后AKI的发生,提示VIS-max可能为心血管外科手术后AKI的早期诊断提供一定的指导价值。
利益冲突:无
