纤花香茶菜苗期抗旱性鉴定及抗旱生理特性初步研究
2021-11-05赵双双刘军民邱佳佳王德勤詹若挺
赵双双, 刘 洋,2, 刘军民,2, 叶 姿, 邱佳佳, 王德勤, 詹若挺,2
(1.广州中医药大学中药学院, 广东 广州 510006;2.岭南中药资源教育部重点实验室(广州中医药大学), 广东 广州 510006;3.广州白云山和记黄埔中药有限公司, 广东 广州 510515)
唇形科(Labiatae)香茶菜属(Isodon)植物纤花香茶菜(Isodonlophanthoides(Buch.-Ham. Ex D.Don)var.Graciliflora(Benth.)H. Hara)是中药溪黄草的主要来源之一,具有清热利湿、凉血散瘀的功效,临床上常用来治疗急性黄疸型肝炎、急性胆囊炎、肠炎等[1-2],也是消炎利胆片、胆石通胶囊等多种中成药的主要原料。纤花香茶菜主产于岭南地区,生于水湿条件丰富的溪边、水沟旁、河岸、田边及林下潮湿处。由于野生资源满足不了药用需求,当前在岭南地区广泛栽培。
干旱是制约植物生长的重要因素,植物受到干旱胁迫后不仅形态会发生改变,体内生物量的积累以及次生代谢物的形成也会受到影响。苗期是植物生长过程中的关键时期,苗期生长的好坏直接影响植株后期的生长和繁殖,受到干旱胁迫的幼苗体内会产生一系列生理生化物质的变化,这些变化可能导致植物产量变低、质量变差甚至死亡。纤花香茶菜生长过程中对水分的要求较高,苗期对水分的耐受力直接影响到其生长发育全程,如遇干旱植株会萎蔫,严重影响后期的生长及生物量的积累。生产上为了满足其对水分的需求,不仅种植地的选择受到限制,种植地灌溉、遮阴等设施成本也随之增加。因此亟需对不同居群的纤花香茶菜种质进行抗旱性鉴定,筛选优良抗旱种质用于药材生产。
研究表明,植物的抗旱能力一般是由遗传因素和环境因素决定,抗旱性鉴定则是筛选和评价植物抗旱能力的过程,对现有种质资源进行芽期和苗期抗旱性鉴定并定向选择是可行有效的[3]。纤花香茶菜种质资源具有较高的遗传多样性,且居群间分化大于居群内分化[4],芽期抗旱性鉴定结果显示,不同类型种质芽期表现出不同的抗旱能力[5],为了筛选出两生育期均具有良好抗旱特性的种质,本文进一步开展了纤花香茶菜种质资源的苗期抗旱性鉴定研究,并分析比较3份不同抗旱性种质在干旱胁迫下的生理生化特征变化,探究其生理特性的变化规律。本研究结果可为纤花香茶菜优良抗旱品种的选育研究及抗旱机制的探索提供参考。
1 材料与方法
1.1 仪器、试剂与材料
1.1.1仪 器
便携式土壤墒情分析仪(DK-W型,深圳市德卡科技股份有限公司);便携式叶绿素仪(SPAD-502型,日本美能达公司);数显卡尺(MNT-150型,上海美耐特实业有限公司);电子天平(JY-3002型,广州玉治仪器有限公司);叶面积测定仪(YMJ-C型,浙江托普仪器有限公司);超低温冰箱(DW-HL 528型,日本SANYO公司);双光束紫外可见分光光度计(A 560型,上海翱艺仪器有限公司);电热恒温水浴锅(HWS 24型,上海一恒科技有限公司);BP-110 S型分析天平(德国Sartorius公司)。
1.1.2试 剂
磺基水杨酸、PEG-6000、冰乙酸、茚三酮、甲苯、磷酸二氢钠、磷酸氢二钠、二硫苏糖醇、聚乙烯吡咯烷酮、考马斯亮蓝G-250、蒽酮、浓硫酸、甲硫氨酸、氮蓝四唑、乙二胺四乙酸二钠、核黄素、Tris、过氧化氢、愈创木酚、三氯乙酸、硫代巴比妥酸等均为国产分析纯。脯氨酸(标准物质,国家食品药品检定研究院)、无水葡萄糖(分析纯,天津市大茂化学试剂厂)、牛血清白蛋白(标准物质,上海阿拉丁生化科技股份有限公司)。
1.1.3试验材料
试验材料为广东、福建等地收集的不同居群纤花香茶菜种质17份,经广州中医药大学刘军民教授鉴定为纤花香茶菜(Isodonlophanthoides(Buch.-Ham. Ex D.Don)var.Graciliflora(Benth.)H. Hara),收集后均种植于广州中医药大学时珍山种质资源圃。种子成熟后采收,待其自然干燥后密封保存于4 ℃冰箱中。详细信息见表1。

表1 供试材料种质来源及类型
1.2 试验方法
1.2.1苗期抗旱性鉴定
采用盆栽反复干旱法,在岭南中药材种子种苗繁育基地(云浮)温室大棚中进行。供试土壤为泥炭土、黄土、沙子(比例为4∶4∶1),种子与沙子按照1∶20比例混匀撒播在育苗床上,当幼苗长出一对真叶和一对心叶时移栽到育苗杯中(8 cm×8 cm),待长出三对真叶后,移栽到装有3 kg混合土的花盆(25 cm×16 cm×19 cm)中,每盆定植5棵。本试验为完全随机区组设计,每份材料设置正常供水和反复干旱处理,每个处理重复3次。
当干旱处理组的所有材料达到90%冠层萎蔫时进行第1次复水(间隔8 d),每盆材料浇水500 mL;第1次复水后干旱处理组不再供水,直到干旱处理组所有材料再次达到90%冠层萎蔫时(间隔6 d),对干旱处理组进行第2次复水,每盆浇水500 mL。
1.2.2抗旱生理特性研究
选择具有抗旱性差异的3份种质R 4、R 6、R 16为供试材料,采用霍格兰溶液水培法[6]。待植株生长至20 cm左右时,洗净根部泥土,放入敞口玻璃瓶中,每瓶5株,处理瓶中加入含10% PEG-6000的霍格兰营养液,对照瓶中加入等量霍格兰营养液,每种处理3次重复。不同处理时间模拟不同程度的干旱胁迫,分别于0 h、24 h、48 h取上部成熟功能叶,液氮速冻后保存于-80 ℃超低温冰箱中。
1.3 测定项目与方法
1.3.190%冠层萎蔫
当所有居群植株达到三叶期后进行控水处理,观察各个居群植株叶片的萎蔫程度,记录不同材料达到90%幼苗出现萎蔫的时间,为90%冠层萎蔫。
1.3.2叶片含水量
在第1次复水前一天上午,剪取3个不同花盆的第3对叶称量鲜重,之后将叶片在105 ℃杀青20 min,80 ℃烘干至恒重,称量干重。
叶片含水量=(鲜重-干重)/鲜重。
1.3.3株高茎粗
在第2次复水后72 h,随机选取3棵植株,测量株高和茎粗。株高为茎顶端生长点到根茎之间距离,茎粗为主茎中部最长节中部的直径。
1.3.4叶片形态
使用便携式叶面积仪测量叶面积、叶长、叶宽。
1.3.5SPAD值
即叶绿素的相对含量。采用SPAD-502便携式叶绿素仪进行测定,在第2次复水24 h后,对第3对成熟叶片进行测定。
1.3.6生物量
第2次复水72 h后,每个居群植株带根整个挖出,将泥土洗净并吸干表面水分,称取幼苗重量,即地上部分鲜重,称取根系鲜物质重量即为根鲜重。
1.3.7生理生化指标测定
叶片中脯氨酸(Pro)含量、可溶性蛋白含量及可溶性糖含量,分别采用酸性茚三酮法、考马斯亮蓝G-250染色法及蒽酮-浓硫酸法进行测定[7]。叶片中超氧化物歧化酶(SOD)及过氧化物酶(POD)活性测定、丙二醛(MDA)含量测定,分别采用氮蓝四唑光化还原法、愈创木酚法及硫代巴比妥酸比色法进行测定[7]。
1.4 数据处理与分析
采用Excel 2010软件对数据进行整理以及抗旱系数计算,采用SPSS 22.0软件对苗期各指标的抗旱系数进行相关性分析和主成分分析,对平均抗旱隶属函数值进行聚类分析,采用Spearman相关(双尾)分析进行相关性分析,聚类分析采用系统聚类法(组间连接,平方欧氏距离),对各生理生化指标进行差异性分析。
其中,DC为抗旱系数,CDC为综合抗旱系数,Xi为某种质i指标处理组的实测值,cki为某种质i指标的对照组实测值,Ui为i指标的隶属值,U为抗旱性综合评价值。
2 结果与分析
2.1 干旱胁迫对纤花香茶菜幼苗生长的影响
对纤花香茶菜幼苗受到干旱胁迫后的各生长指标进行统计(表2)。干旱处理组各项指标的变异系数范围在4.20%~29.63%之间,其中以90%冠层萎蔫和SPAD值表现的差异最大,变异系数分别为29.63%和22.73%。对照组各项指标的变异系数范围在1.57%~24.55%之间,表明供试的纤花香茶菜各指标之间存在明显差异,其中株高和根鲜重的变异系数最大,分别为21.61%和24.55%,表明各种质之间的株高和根鲜重存在较大差异。对照组与处理组各指标相比较分析可知,经干旱胁迫的纤花香茶菜所有性状指标均受到抑制。

表2 干旱胁迫下17份供试材料苗期各指标变化统计
2.2 抗旱系数与隶属函数值的相关性分析
对干旱胁迫下纤花香茶菜苗期各指标的抗旱系数进行相关性分析(表3)。其中各抗旱系数呈显著或极显著相关关系的均为正相关。平均隶属函数值与叶片含水量、叶面积、叶长、叶宽、根鲜重均呈极显著相关,其中与叶长和叶面积的相关性较大,相关系数分别为0.833和0.830;与90%冠层萎蔫、地上部分鲜重呈显著相关;与株高、茎粗、SPAD值相关性不显著。多数指标的抗旱系数未达到显著相关,其中株高、茎粗和SPAD值与其他指标均无明显相关性。
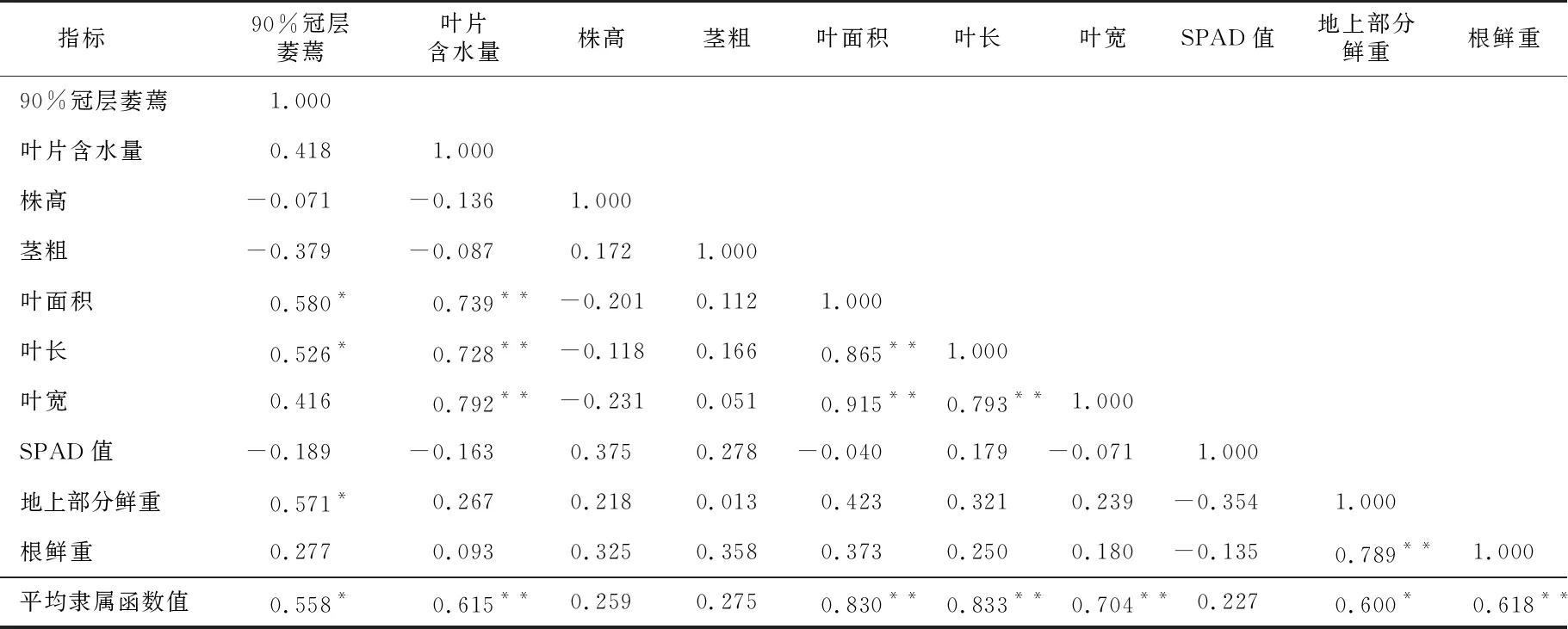
表3 干旱胁迫下17份纤花香茶菜种质资源10个性状抗旱性系数间的相关系数
2.3 抗旱系数主成分分析
对纤花香茶菜苗期各指标的抗旱系数进行主成分分析,前3个主成分贡献率分别为36.64%、20.699%、17.1%,累计贡献率为74.438%,且各成分特征值均大于1(表4)。提取前3个主成分,可以代表11个指标大部分信息。主成分1(F 1)特征值为3.664,对应载荷量相对较大的是叶面积、叶宽、叶片含水量,都与光合作用相关,称为光合因子,受到干旱胁迫的植株,其光合作用亦会受到抑制。主成分2(F 2)特征值为2.07,对应载荷量相对较大的是地上部分鲜重、根鲜重,与生物产量相关,概括为产量因子,干旱胁迫会使植物地上部分鲜重降低。主成分3(F 3)特征值为1.71,对应载荷量相对较大的是茎粗、SPAD值,与植物的生长密切相关,归为生长因子,干旱胁迫会影响茎粗及SPAD值的增大。
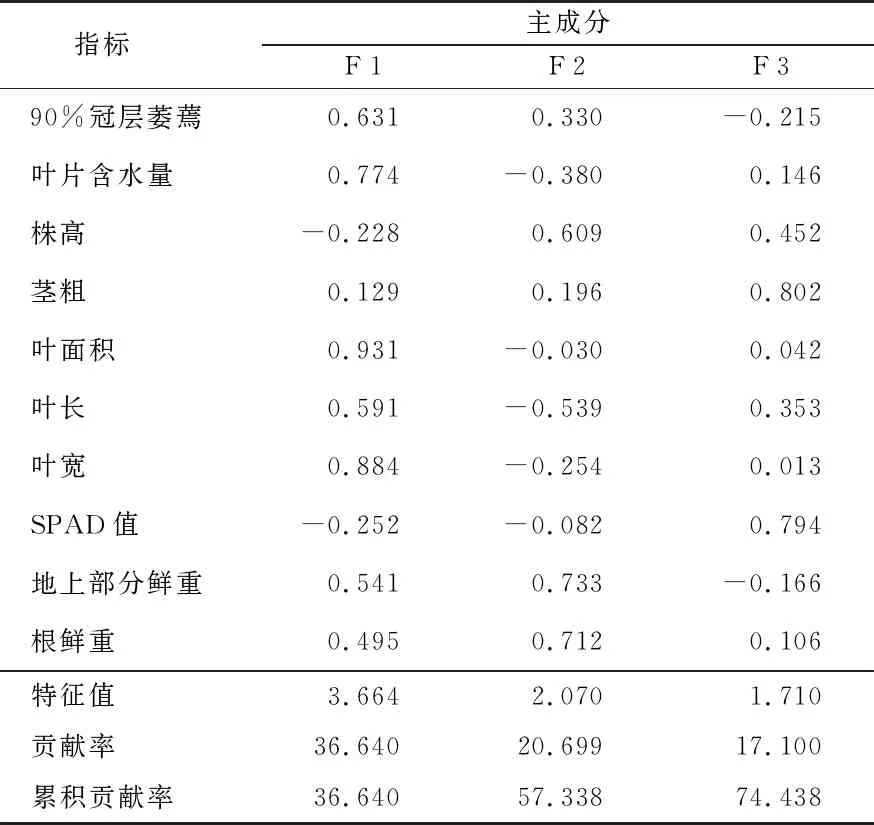
表4 干旱胁迫下纤花香茶菜种质资源苗期抗旱系数的主成分分析
2.4 综合抗旱性评价与抗旱性聚类分析
计算供试材料各指标的抗旱系数的隶属函数及平均隶属函数并排序(表5),对各生长指标的平均隶属函数值进行聚类分析(图1),当平方欧氏距离为5时,17份纤花香茶菜种质被分为强抗旱型、中抗旱型、弱抗旱型和抗旱性敏感型四种类型。强抗旱型包括R 3、R 11、R 13,平均隶属函数值在0.616~0.674之间;中抗旱型包括R 9、R 16、R 10、R 6、R 15,平均隶属函数值在0.487~0.546之间;弱抗旱型包括R 4、R 5、R 7、R 8、R 17,平均隶属函数值在0.334~0.434之间;抗旱性敏感型包括R 1、R 14、R 12、R 2,平均隶属函数值在0.220~0.260之间。

图1 纤花香茶菜种质资源苗期平均隶属函数值的聚类分析
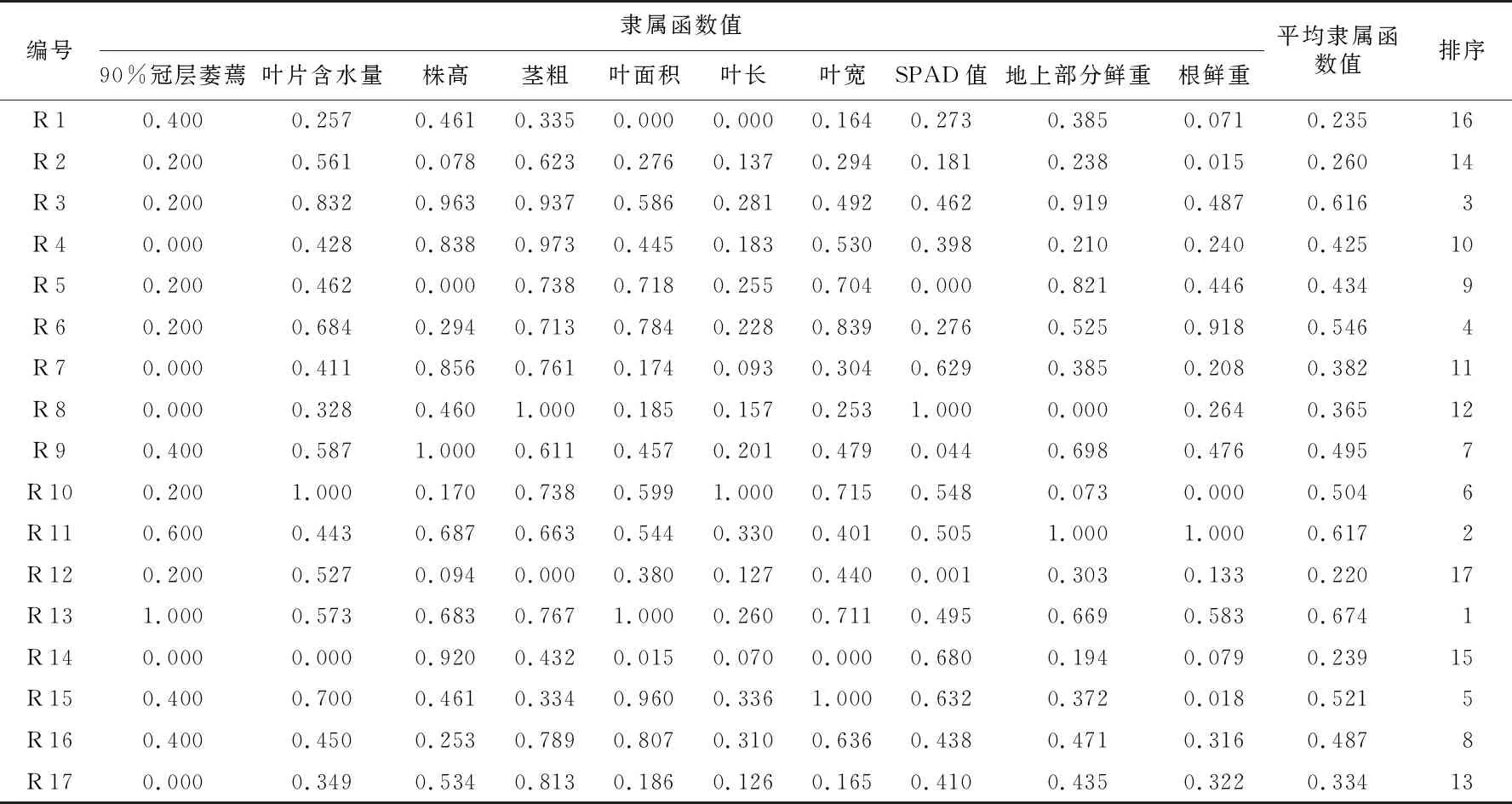
表5 反复干旱处理后纤花香茶菜种质资源苗期各指标抗旱系数的隶属函数与排序
根据各指标的平均隶属函数值以及种植过程中各性状实际情况,可筛选出5份抗旱性优良种质,分别为R 3、R 6、R 9、R 10和R 16。其中R 3平均隶属函数值为0.616,抗旱性最好。
2.5 纤花香茶菜抗旱生理特性研究
对3份抗旱性差异种质的生理特性研究发现,干旱胁迫下3份材料的Pro、可溶性蛋白、可溶性糖等渗透调节物质的含量随胁迫时间的延长而不断增加(图2)。当干旱胁迫时间为24 h,3份种质Pro含量均有所增加,轻度干旱胁迫下Pro的积累有利于渗透调节;R 6、R 16的可溶性蛋白小幅度增加,R 4可溶性蛋白含量显著增加;可溶性糖含量均有不同程度增加,三者含量大小为R 16>R 6>R 4。干旱胁迫48 h时,3份种质Pro含量均快速上升,R 4的Pro含量积累最多;R 6、R 16的可溶性蛋白含量大幅增加,而R 4可溶性蛋白含量略微增加;R 4、R 16可溶性糖含量较0~24 h增加多,R 6相对增加较少。在模拟干旱胁迫处理期间3份种质的Pro含量、可溶性糖含量均有极显著差异;R 6可溶性蛋白含量呈极显著差异,R 16呈显著差异,R 4差异不显著。

图2 干旱胁迫下纤花香茶菜不同种质叶片中3种渗透调节物质的变化
SOD和POD是植物酶系统的重要成员,MDA是判断膜系统受伤害程度的重要指标之一。对不同干旱胁迫时间下SOD和POD活性、MDA含量测定结果(图3)显示,R 4、R 16的SOD活性先下降后上升,并且整个胁迫期间SOD活性的变化量均较小,而R 6的SOD活性先上升后下降,R 16的SOD活性在模拟干旱胁迫期间有显著性差异,R 4、R 16则没有显著差异;胁迫时间从0 h增加到24 h时,R 4的POD活性大幅上升,增幅达6倍以上,整个胁迫期间3份材料的POD活性均有不同程度增加,R 6、R 16的POD活性在胁迫期间均有极显著差异,R 4无显著性差异;胁迫0 h时,3份材料的MDA含量大小为R 4>R 16>R 6,胁迫时间为24 h时,三者积累的MDA含量相近,胁迫时间延长至48 h时,三者MDA含量继续增加,其中R 4增幅最大,R 4、R 16在胁迫期间MDA含量均有极显著差异,R 6有显著性差异。

图3 干旱胁迫下纤花香茶菜不同种质叶片中SOD、POD活性及MDA含量的变化
3 讨论与结论
3.1 抗旱性鉴定方法及性状指标的选择
关于植物抗旱性鉴定已有大量的研究报道,但植物的抗旱性因时间、地点甚至生长发育阶段不同而难以精确测量。虽然鉴定方法标准不一,但李瑞雪等[8]、张智猛等[9]、谢小玉等[10]的研究仍具有重要参考价值。苗期抗旱性鉴定方法有高渗溶液法、田间直接鉴定法、旱棚或人工气候室法及盆栽法等,其中盆栽法简便易行、稳定性较好,已应用在薏苡[11]、绿豆[12]、糜子[13]等植物上,被认为是植物苗期抗旱性鉴定中较好的处理方法。植物苗期的抗旱性与多种性状有关,是由多种影响因素构成的复杂的数量性状,所有因素综合作用才能促进抗旱性的形成,仅应用单一性状指标无法准确判断,因此一般进行多指标测定,从而对抗旱性进行综合评价[3]。目前,研究人员多从形态结构[14]、生理生化[15]以及生长产量[16]等方面对植物种质资源的抗旱性进行多指标测定研究,并运用多种分析方法,如隶属函数法、主成分分析法、灰色系统理论法、聚类分析等对所得指标数据进行综合评价。王琪等[17]通过研究水分胁迫下芍药的表型性状、光合指标、水分生理指标等,运用主成分分析法和隶属函数法对4个芍药品种的抗旱性进行了排序。曾辉等[18]对30份菜豆进行抗旱性鉴定发现不同材料之间存在明显的抗旱差异性,其中发芽率、地下鲜重、地上鲜重、全株鲜重、电导率和Fv/Fm可以作为普通菜豆苗期抗旱性筛选的主要鉴定指标。因此,本研究采用盆栽反复干旱法对17份纤花香茶菜种质资源的苗期的多个形态及生长指标进行测定,运用隶属函数法、相关性分析、主成分分析、聚类分析等方法对这些指标进行综合分析。结果17份种质被分为4种不同抗旱类型,初步筛选出5份苗期抗旱性优良种质,综合分析可将叶面积作为其苗期抗旱性鉴定的主要测定指标。观测植株生长状态发现,相对矮小的种质所表现出的抗旱性优于植株较为高大的种质,如矮小的植株发生90%萎蔫的时间明显延长、积累的生物量更多,可能由于矮小的植株生长所需的水分较相对高大的植株少,因此在干旱胁迫下受到的影响较小。结合芽期与苗期抗旱性鉴定结果并考虑植株实际生长状况,最终筛选出R 16为综合抗旱性优良种质。
3.2 干旱胁迫对不同抗旱性种质生理特性的影响
植物受到干旱胁迫后通过调整体内的生理生化代谢来适应环境,这个过程是一系列复杂的多方面的变化,目前研究人员多从生理渗透调节和保护酶活性方面进行研究。渗透调节是植物在水分胁迫下,通过主动积累溶质来提高细胞液浓度,降低渗透势,在水势下降时维持细胞膨压来适应干旱环境[19]。植物在利用氧气的过程中会产生具有毒害作用的活性氧(ROS),当植物受到干旱胁迫时会破坏ROS产生与清除之间的平衡,导致膜脂、生物膜系统、组织等受到伤害,并产生和积累过氧化产物MDA,MDA含量可反映膜脂过氧化程度,参与植物清除ROS的酶类主要有SOD和POD等[20]。Yin等[21]发现,高粱幼苗通过降低Pro含量和渗透势、增加可溶性糖含量来应对干旱胁迫。张翠梅等[22]研究发现,在不同程度的干旱胁迫下,不同抗旱性苜蓿品种存在形态特征相同,生理特性不同的生长及生理响应策略,其中在轻度和中度干旱胁迫下,弱抗旱性品种通过改变细胞膜系统稳定性、根系活力及渗透调节能力来应对干旱;在重度干旱胁迫下,不同抗旱性品种均可通过改变根系生长特征和启动抗氧化系统来适应干旱。谢小玉等[10]对10个甘蓝型油菜种质苗期的抗旱性进行评估,发现其MDA、Pro、可溶性糖、可溶性蛋白含量和SOD、POD活性相对值都呈现出上升趋势,与本研究结果类似。在本研究中,随着干旱胁迫时间延长,纤花香茶菜叶片中的Pro、可溶性蛋白、可溶性糖含量不断增加,胁迫48 h时,叶片表观形态损伤严重,Pro含量大幅增加,尤其R 4种质增加最多,说明R 4受到胁迫损伤最严重,与抗旱性鉴定结果相符;可溶性蛋白含量在胁迫24 h时就有明显差异,而可溶性糖含量的积累主要在胁迫后期。3份种质的SOD活性在胁迫期间均变化不大,而POD活性快速上升,MDA含量有不同程度的积累,其中R 4在应对干旱胁迫时的POD活性以及MDA含量在3份种质中增加最多。弱抗旱型种质(R 4)在应对干旱胁迫时的渗透调节物质含量以及抗氧化酶活性都处于较高水平,膜脂过氧化严重,说明弱抗旱型种质需要做出更强烈的生理应答来应对干旱胁迫,与前人的研究结果一致;而抗旱性较强的种质(R 6、R 16)主要通过增加渗透调节来适应干旱胁迫;同为抗旱种质的野生型(R 6)和栽培型(R 16)在应对干旱胁迫时的生理生化指标变化亦不同,野生型的渗透调节物质和酶活积累量较少。综上,抗旱性不同的种质对干旱胁迫的应答机制不同,弱抗旱型种质需要做出更强烈的生理应答来应对干旱胁迫。
