FOXA2改善肝内胆汁淤积伴高脂血症小鼠肝脏功能和血脂水平
2021-11-04张梦洁陈思聪翟华立杨晓明
张梦洁,杨 洋,陈 慧,陈思聪,翟华立,杨晓明,,于 淼,,焦 轶
(1.安徽医科大学基础医学院人体解剖学教研室,安徽 合肥 230032;2.军事科学院军事医学研究院生命组学研究所,蛋白质组学国家重点实验室,北京 100850)
叉头框蛋白A2(forkhead box A2,FOXA2)是肝脏中重要的转录因子,通过高度保守的翼状螺旋结构域以单体形式结合在靶基因启动子区的DNA序列上[1]。FOXA2与其它肝细胞核因子(hepatocyte nuclear factors,HNFs)协同调控大量肝脏功能基因的表达,包括血浆蛋白、载脂蛋白、凝血因子、以及葡萄糖、脂肪酸、氨基酸代谢中的关键代谢酶,参与肝脏发育、器官形成、代谢和稳态维持等多种生物学过程[2]。由于神经管发育异常,FOXA2全身敲除小鼠胚胎致死;在肝细胞中特异性敲除FOXA2不会影响小鼠发育,但是会导致肝脏胆汁酸代谢稳态失衡,增加小鼠对高胆酸饮食损伤的敏感性,主要原因是FOXA2调控的多种参与胆汁酸代谢的基因表达异常[3]。FOXA2还可以通过将cAMP响应元件结合蛋白(cAMP response element binding protein,CREB)和糖皮质激素受体(glucocorticoid receptor,GR)募集到染色体上调节糖异生过程[4]。利用重组腺病毒在小鼠体内过表达FOXA2可以通过调节脂质β氧化改善高脂饮食小鼠以及瘦素敲除小鼠胰岛素抵抗[5]。临床研究显示,在原发性硬化性胆管炎患者以及胆道闭锁患者的肝脏中,FOXA2表达明显下调[6]。FOXA2的表达也与肿瘤的发生发展密切相关,在肝癌、肺癌、胰腺癌、胃癌、甲状腺癌以及大肠癌患者体内FOXA2表达明显下调[7]。FOXA2表达也受自身调节,在FOXA2启动子上游-138 bp--126 bp存在肝细胞核因子6的识别位点;在大鼠子宫中,Hedgehog蛋白参与FOXA2的表达调控;在卵巢癌细胞中,miR-590-3p通过与FOXA2的3‘-UTR区结合抑制其表达[8];然而,目前关于FOXA2自身的表达调控研究相对较少,仍需要进一步研究。
胆汁淤积(cholestasis)是指胆汁合成、分泌和排泄障碍引起肝脏以及血液循环中胆汁过度堆积,慢性胆汁淤积患者通常会并发肝功能失调以及高脂血症[9]。熊去氧胆酸(ursodeoxycholic acid,UDCA)是目前治疗胆汁淤积性肝病的首选药物[10],但药效局限于疾病早期,需要研究人员寻找新的治疗靶点。鉴于FOXA2在肝脏胆汁酸代谢中的重要作用,我们通过尾静脉高压注射在小鼠体内过表达FOXA2,观察FOXA2对高胆固醇/胆酸饲料(cholic acid diet,CAD)诱导的肝内胆汁淤积小鼠肝脏功能及血脂水平的影响,以期为肝内胆汁淤积肝病的临床治疗提供新的策略。
1 材料与方法
1.1 材料
1.1.1实验动物 健康野生型C57BL/6J小鼠,雄性,8周龄,体质量(20±2) g,购买自北京维通利华实验动物技术有限公司,饲养于SPF级动物实验室,饲喂保持昼夜节律,期间自由摄取水和食物。动物生产许可证编号:SCXK(京)2016-0006;本研究中所有动物实验均通过军事医学研究院实验动物管理与使用委员会批准(IACUC-DWZX-2020-598)。
1.1.2实验仪器 高通量组织研磨器(宁波新芝生物科技);电泳仪设备、酶标仪(美国BIO-RAD公司);病理切片全景扫描仪(匈牙利3DHISTECH);RT-PCR仪、PCR仪、高速冷冻离心机(美国Thermo Fisher公司)。
1.1.3实验试剂 CA饲料(TP06108,南通特洛菲饲料公司); Lamin A/C抗体(A19524,ABclonal公司);单克隆抗-FLAG®M2小鼠抗体(F-1804,Sigma公司);FOXA2抗体(sc-374375,Santa公司);FOXA2-flag质粒由本实验室构建;转染试剂(MIR5340,Mirus公司);组织TCHO酶法测定试剂盒(E1015,北京普利莱公司);小鼠TBA酶联免疫试剂盒(SY-E02319,上海双赢生物公司);RNA TRIzol(T9424,Sigma公司);SYBR®Green Real time PCR Master Mix(货号:QPK-201,ToYoBo公司);质粒小提试剂盒(货号:DP103,TIANGEN公司);反转录试剂盒(货号:C4360,Promega公司);北京洛奇生物医学检验中心提供血生化指标测定;上海生工生物工程有限公司合成实验涉及的PCR引物,引物序列如下:Primer(5′-3′)
FOXA2-Forward CCCTACGCCAACATGAACTCG;FOXA2-Reverse GTTCTGCCGGTAGAAAGGGA;TBP-Forward GCTCTGGAATTGTACCGCAG;TBP-Reverse CTGGCTCATAGCTCTTGGCTC;SHP-Forward GACCTGTCACTCTCGGTATCG;SHP-Reverse AGGGCTTGGATGATTCTAGTCA;NTCP-Forward CAAACCTCAGAAGGACCAAACA;NTCP-Reverse GTAGGAGGATTATTCCCGTTGTG;CYP7A1-Forward GGGATTGCTGTGGTAGTGAGC;CYP7A1-Reverse GGTATGGAATCAACCCGTTGTC;CYP8B1-Forward CCTCTGGACAAGGGTTTTGTG;CYP8B1- Reverse;GCACCGTGAAGACATCCCC;BSEP-Forward TCTGACTCAGTGATTCTTCGCA;BSEP- Reverse CCCATAAACATCAGCCAGTTGT; NTCP2- Forward GTCTGTCCCCCAAATGCAACT; NTCP2- Reverse CACCCCATAGAAAACATCACCA; OSTA- Forward CAGCGGGCATGGTCACTATC; OSTA- Reverse CCGTCCACGCTAAGCACTG; OSTB-Forward AGATGCGGCTCCTTGGAATTA;OSTB-Reverse TG GCTGCTTCTTTCGATTTCTG;MRP2-Forward GTG TGGATTCCCTTGGGCTTT;MRP2-Reverse CACAA CGAACACCTGCTTGG;MRP3-Forward CTGGGTC CCCTGCATCTAC;MRP3-Reverse GCCGTCTTGAG CCTGGATAAC;MRP4-Forward AGGAGCTTCAAC GGTACTGG;MRP4-Reverse GCCTTTGTTAAGGAG GGCTTC。
1.2 方法
1.2.1实验分组 将48只8周龄♂的C57BL/6J小鼠分组。18只小鼠给予正常饲料,其中5只饲喂前给予尾静脉高压注射FOXA2-flag质粒(ND+FOXA2组),5只饲喂前给予尾静脉高压注射空白对照载体质粒(ND+Mock组),其余8只小鼠不作其他处理(ND组)。30只小鼠给予CAD饲料,其中5只饲喂前给予尾静脉高压注射转染质粒(CAD+FOXA2组),5只饲喂前给予尾静脉高压注射空白对照载体质粒(CAD+Mock组),其余20只小鼠不作其他处理(CAD组)。
1.2.2CAD模型建立[3]每日定时定量给予每只小鼠CA饲料5 g,连续7 d,因CA饲料易氧化,故每日更新饲料。于造模1、3、5、7 d时随机选取5只小鼠,每组小鼠放入代谢笼中禁食16 h后称质量,脱颈处死,摘眼球取血,取胆囊、肝脏,拍照称质量。
1.2.3小鼠尾静脉高压注射法转染质粒 取20 μg质粒稀释至200 μL体积,混匀后静置5 min,加入2 mL转染试剂,混匀后室温静置15 min,通过尾静脉在5-8 s内将混合物注入小鼠体内。ND+Mock组、CAD+Mock组注射空白对照载体质粒,ND+FOXA2组、CAD+FOXA2组注射FOXA2-flag质粒。
1.2.4血清检测 摘除小鼠眼球取血,抗凝管中的血液室温沉淀2 h,置于4 ℃离心机,3 000g离心20 min,分离血液上清,采用全自动生化分析仪检测血清中ALT、AST、TCHO、LDL-C、HDL-C及TBA含量。
1.2.5病理学检测 小鼠处死后取肝脏称质量,切取肝脏最大叶部分组织用10%中性甲醛固定,石蜡包埋切片进行HE染色;切取块状肝组织液氮速冻,冰冻切片包埋后用于油红O染色;病理切片全景扫描观察肝组织损伤情况。
1.2.6蛋白印迹检测 取小鼠肝脏组织约20 mg,加入200 μL RIPA裂解液,充分匀浆后取上清液,进行蛋白定量。配制10% SDS-PAGE凝胶,进行电泳分离、电转,封闭2 h;4 ℃孵育第一抗体(FLAG,1 ∶1 000稀释;FOXA2,1 ∶400稀释)过夜;洗膜;常温孵育第二抗体(anti-mouse,1 ∶4 000稀释)40 min,加入显色液后进入暗室显影定影。
1.2.7实时荧光定量PCR检测 将10-20 mg新鲜小鼠肝组织放入1 mL TRIzol试剂中提取总RNA,取1 μL RNA按试剂盒说明书进行逆转录。用Applied Biosystems Quant Studio 3实时PCR系统和SYBR Premix Ex TaqTM试剂盒进行RT-PCR。反应条件如下:95 ℃ 3 min;95 ℃ 10 s,60 ℃,40 s,40个循环。以TBP为内参,检测与胆汁酸代谢转运相关基因。根据2-ΔΔCT方法计算差异表达。

2 结果
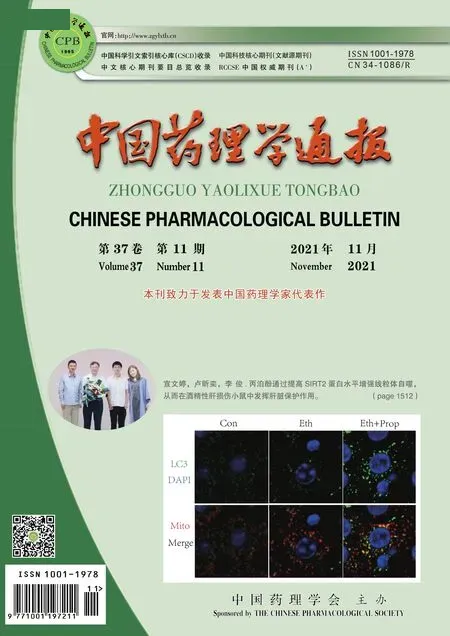
2.1 CAD饲喂1周对小鼠体质量、肝脏及胆囊的影响随着CAD饲喂时间延长,CAD组小鼠体质量呈下降趋势,在d 7时小鼠体质量较饲喂前明显下降(P<0.01, Fig 1A);肝体比呈上升趋势,d 7时肝体比较饲喂前明显增加(P<0.01, Fig 1B);胆囊逐渐增大,d 7的胆囊质量较饲喂前明显增加(P<0.05, Fig 1C,D)。
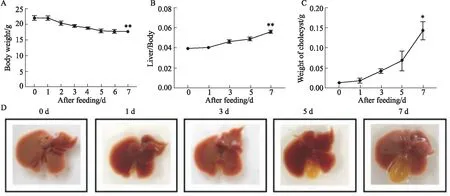
2.2 CAD饲喂1周对小鼠肝脏组织结构、脂质积累、肝功及血脂的影响正常饮食下,小鼠肝脏组织HE染色显示肝细胞形态结构完整。采用CAD饲喂1周后,小鼠肝组织结构松散,可见炎细胞浸润水肿。油红O染色结果显示,CAD组小鼠肝组织出现明显的脂类物质积累,提示脂质代谢出现异常(Fig 2A)。与ND组小鼠相比,CAD饲喂1周后小鼠血清转氨酶ALT及AST均明显升高(P<0.01),提示出现肝损伤;血清和肝脏中的胆汁酸TBA水平均明显升高(P<0.01),提示小鼠肝脏胆汁淤积严重;血清和肝脏胆固醇(TCHO)含量均升高(P<0.05,P<0.01)、肝脏甘油三酯(TG)含量明显升高(P<0.01),血清低密度脂蛋白胆固醇(LDL-C)水平升高(P<0.05),提示出现高脂血症(Fig 2B)。
Fig 2 Liver damage and abnormal lipid metabolism in mice with cholestasis induced by CA n=5)
2.3 FOXA2在CAD小鼠肝脏中表达下调通过Western blot检测FOXA2的表达,结果显示,与ND组相比,CAD组FOXA2表达明显下调(Fig 3A),通过Real-time PCR检测FOXA2在转录水平的变化,发现CAD小鼠肝脏中FOXA2的mRNA水平也明显降低(P<0.01, Fig 3B)。

Fig 3 Down-regulation of FOXA2 in liver of CAD n=5)
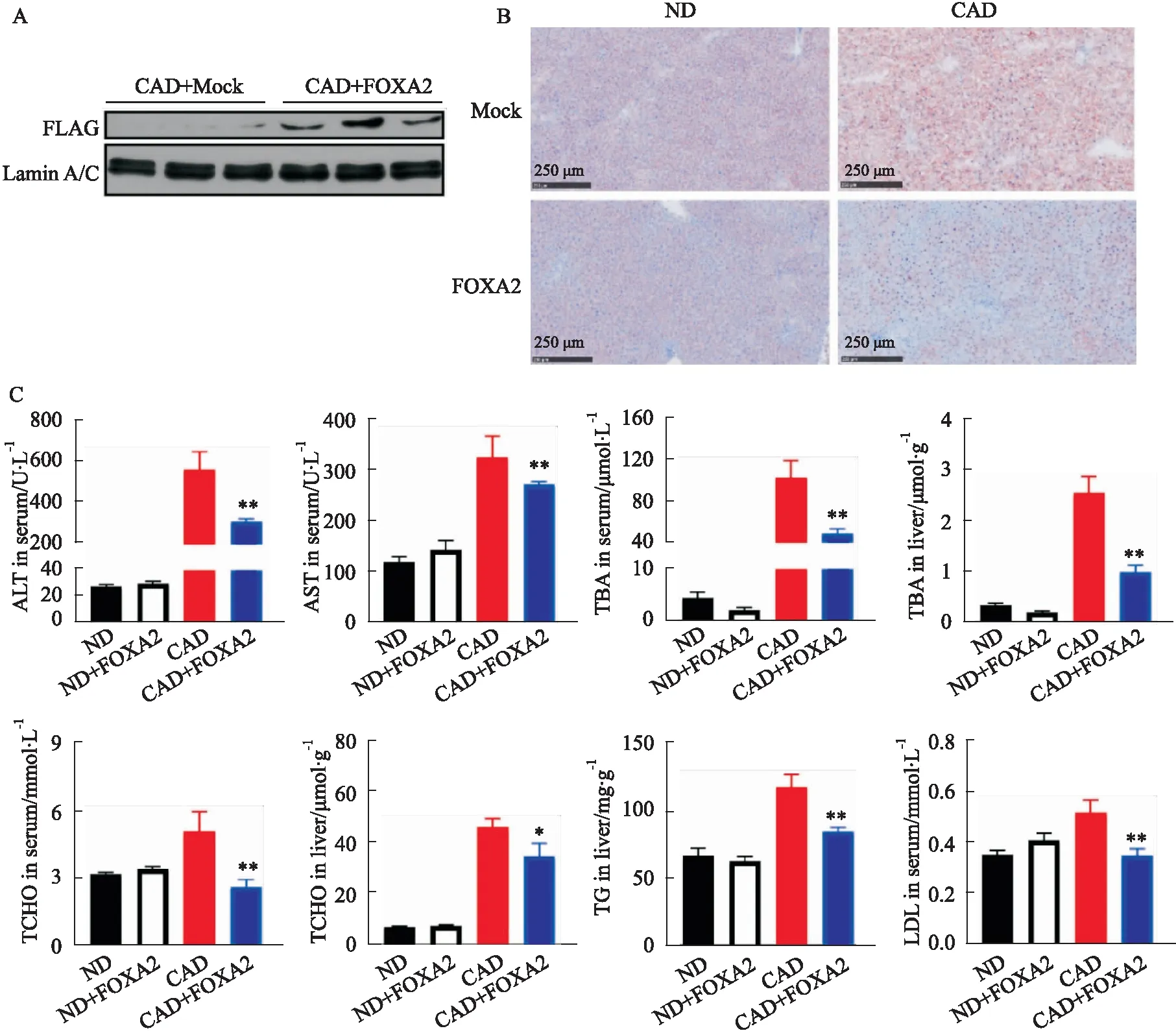
2.4 过表达FOXA2减轻CAD小鼠肝损伤及脂质积累前期研究表明,肝细胞特异性敲除FOXA2小鼠进食CAD后,可出现肝内胆汁酸淤积、内质网应激和肝损伤[3]。为研究FOXA2在CAD小鼠模型中发挥的作用,我们利用尾静脉高压注射法将FOXA2-flag质粒转染入小鼠体内,使得质粒通过肝门静脉直接进入肝脏细胞,在肝脏中过表达FOXA2,随后用CAD饲喂1周,观察过表达FOXA2对小鼠肝脏和血脂的改变。通过Western blot证明注射FOXA2-flag质粒的小鼠肝脏中检测到FOXA2-flag表达(Fig 4A)。肝组织油红O染色结果显示过表达FOXA2可明显减轻CAD小鼠的脂质积累情况(Fig 4B)。正常饮食下,过表达FOXA2对小鼠血清转氨酶、胆汁酸、血脂、肝脏脂质以及肝脏胆汁酸水平无明显影响。而CAD饲喂1周后,过表达FOXA2可以明显降低小鼠血清中ALT、AST、TBA、TCHO、LDL-C(P<0.01)水平;肝脏中的胆汁酸(P<0.01)、胆固醇(P<0.05)、甘油三酯(P<0.01)水平也明显降低(Fig 4C)。提示FOXA2过表达可改善CAD饲喂小鼠的肝损伤,减轻胆汁酸淤积及脂质积累。
2.5 FOXA2调控与胆汁酸合成转运相关基因FOXA2已经被证实通过直接调控胰岛素信号通路以及胆汁酸代谢相关基因的表达来影响机体脂代谢和维持胆汁酸稳态[11]。我们通过Real-time PCR检测过表达FOXA2对CAD小鼠胆汁酸代谢相关基因的影响,结果显示,与对照组相比,FOXA2过表达上调参与胆汁酸合成的基因SHP、CYP7A1、CYP8B1的表达,参与胆汁酸转运的基因NTCP、NTCP2、BSEP、OSTA、OSTB、MRP2、MRP3、MRP4也出现上调趋势(Fig 5),提示FOXA2过表达可促进肝脏胆汁酸合成,维持胆汁酸正常转运代谢,有利于分解肝脏累积的胆固醇,减轻肝脏内胆汁淤积。
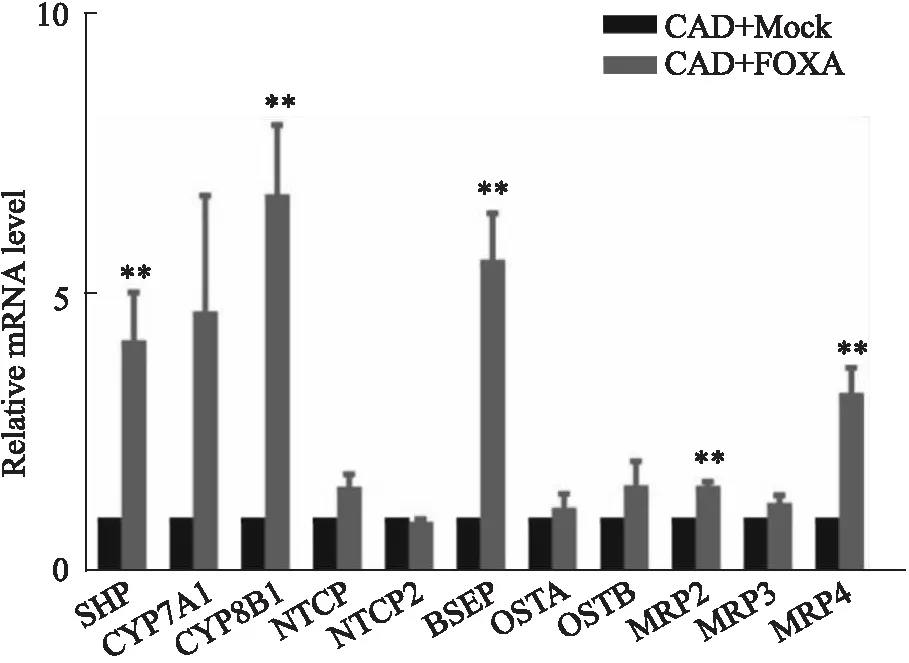
Fig 5 Genes related to bile acid synthesis and transport regulated by n=5)
3 讨论
胆汁酸主要在肝脏中由胆固醇合成,在脂肪的消化吸收和胆固醇代谢中发挥重要作用。然而当胆汁酸代谢异常时,肝细胞内的胆汁酸浓度过高会导致肝细胞毒性、肝损伤和肝内胆汁淤积。
前期研究发现在临床胆汁淤积性肝病患者肝脏中FOXA2表达明显下调[3]。在本研究中,我们通过给小鼠饲喂添加胆酸的饲料构建肝内胆汁淤积模型,文献研究[12]显示饲料中添加CA会引起肝脏单细胞坏死,通常用来模拟胆汁淤积、胆汁酸代谢障碍来探究胆汁酸转运蛋白与胆汁酸毒性之间的相互作用。本研究通过给予8周龄野生型C57BL/6J小鼠一周CA饮食,发现小鼠血清和肝脏中胆汁酸水平明显升高,肝组织病理出现大量炎症细胞且出现局部坏死,说明我们建模成功。我们的检测结果也发现CAD小鼠肝脏中FOXA2的mRNA水平和蛋白质水平均明显降低,与文献报道一致,因此提出科学假设:如果外源性注射FOXA2质粒使肝细胞过表达FOXA2,是否可以缓解高胆酸饮食诱导的胆汁淤积性肝损伤?于是我们利用水动力学原理在小鼠体内转染FOXA2质粒,该法主要取决于注射体积和注射速率,当注射速率超过心输出量时,下腔静脉中的溶液会积聚,并且在下腔静脉中产生高的静水压力,这种静水压迫使注射溶液将以与正常循环相反的方向被迫进入肝脏,使得DNA分子在与血液混合之前直接暴露在肝细胞中。该方法转染效率较高,是外源基因在动物体内导入和表达的有效手段[13]。结果显示,与对照组相比,过表达FOXA2组血清转氨酶降低,炎症损伤减轻,肝脏和血清中胆汁酸、胆固醇水平降低,脂质积累减轻,明显改善了CAD饲喂小鼠的肝功能和血脂情况,说明我们的策略可以逆转由于CAD饲喂造成FOXA2下调后对小鼠肝脏胆固醇代谢的影响。
为了确定过表达FOXA2如何调控小鼠肝脏中胆汁酸代谢,我们通过实时定量PCR检测了胆汁酸合成及转运蛋白的mRNA水平。前期研究结果已知胆汁酸代谢分为初级、次级胆汁酸的生成以及肠肝循环[14]。胆固醇经胆固醇-7α-羟化酶(CYP7A1)催化生成胆酸(CA)和鹅去氧胆酸(CDCA),CYP7A1是胆汁酸合成途径中的限速酶,决定胆汁酸生成量,通常75%的胆汁酸通过该经典途径产生。胆汁酸在肝脏中合成后主要由胆盐输出泵(BSEP)转运蛋白输入胆小管[15],小部分胆汁酸经过多药耐药性相关蛋白2(MRP2)运输至胆囊中。进食后,胆囊收缩将胆汁排入肠道中,在回肠通过胆汁酸转运体(ASBT)主动重吸收入小肠黏膜细胞,肠道中的胆汁酸经过MRP家族相关转运蛋白运输后通过门静脉运输回肝脏中,在钠/胆汁酸共转运蛋白(NTCP)、有机溶质转运蛋白Alpha(OSTA)和有机溶质转运蛋白Beta(OSTB)的运输下,胆汁酸被肝细胞重新吸收,胆汁酸的肠肝循环需要多种转运蛋白协同合作,在此过程中,胆汁酸被充分利用,发挥促进脂类消化吸收的作用[16]。在本研究中,通过对胆汁酸合成基因蛋白的检测,发现过表达FOXA2后,负责胆汁酸合成的基因(SHP、CYP7A1、CYP8B1)表达增多,参与胆汁酸转运的基因(NTCP、NTCP2、BSEP、OSTA、OSTB、MRP2、MRP3、MRP4)的表达也明显上调,在胆汁酸代谢中胆汁酸转运蛋白发挥重要作用,在此过程中,FOXA2过表达促进胆汁酸合成和转运,分解肝脏累积的胆固醇,减轻胆汁淤积性肝病诱发的高脂血症,FOXA2在此过程中的具体调控机制有待进一步研究。
本文通过观察FOXA2对肝内胆汁淤积小鼠肝脏功能及血脂水平的影响为胆汁淤积性肝病伴高脂血症疾病机制探索及药物研发提供了参考。