淡竹叶盐对脂多糖诱导的RAW264.7细胞炎症抑制作用和肝细胞生长影响的研究
2021-11-04季红福赵雯雯王丹洪郑文豪肖竹钱戴静王永江毛建卫
季红福,赵雯雯,王丹洪,郑文豪,肖竹钱,戴静,王永江*,毛建卫,2*
1(浙江科技学院 生物与化学工程学院,浙江省农产品化学与生物加工技术重点实验室,浙江省农业生物资源生化 制造协同中心,浙江 杭州,310023)2(浙江工业职业技术学院,浙江 绍兴,312000)
食盐是人类日常饮食中可不或缺的成分,不仅可以维持细胞渗透压,还可以改善高血压,肥胖等各类疾病[1]。竹盐作为一种食用盐,是将日晒海盐放入竹段中,用天然无污染的黄土封盖,以松枝为燃料,在800~1 000 ℃高温下煅烧,最终获得的灰白色的固体盐[2]。经过高温煅烧,竹盐与竹筒、黄土中的矿物元素充分融合,使得其中金属元素(如钙、硅、钾、镁、铁、锌、硒等)的种类和含量均高于普通食盐,因而具备一些普通食盐没有的功能。金属微量元素是人体所必需的,对人体的生理健康起到重要作用。对现代中药药理活性物质的研究表明,人体的一些疾病与金属微量元素的失衡有关,一旦超过或者低于平衡水平,可能会引发人体疾病[3]。
淡竹叶是禾本科多年草本植物,具有清热解毒、消痰、去烦热、利小便等功效。研究表明,淡竹叶较其他竹叶,含有丰富的钾、镁、钙、铁、锰等元素[4],以淡竹叶为载体,代替传统竹筒,采用竹盐的工艺制备淡竹叶盐,将淡竹叶中一些无机成分溶入原盐中,得到富含矿物元素的食用盐,也可作为竹叶开发应用的一个方向。目前,淡竹叶盐的研究鲜有报道。
非酒精性脂肪性肝病(non-alcoholic fatty liver disease,NAFLD)是一种代谢应激性肝损伤,主要表现为脂肪酸等脂质物质过度积累。随着人类生活水平的提高,越来越多的人受到NAFLD的影响,且人数随着肥胖、Ⅱ型糖尿病和代谢综合征的流行而增多[5]。研究表明,炎症应激会改变肝脏脂质的平衡,导致过量的脂质积累在肝脏中,是诱发NAFLD的重要分子机制。NAFLD患者往往肝脏中游离的脂肪酸水平较高,容易刺激肝脏局部促炎细胞因子的产生,这可造成NAFLD逐步演变成非酒精性脂肪性肝炎、肝纤维化、肝硬化和肝细胞癌[6]。目前,已有文献报道,竹盐具有抗氧化[7-8],抗炎[9-10]、抑菌[11-12]、保护肝脏[13-15],治疗胃肠道疾病[16]、抑制肿瘤细胞增殖[17-18]及抗皮肤衰老[19-20]等功效。因此,本研究采用竹盐制备工艺,用淡竹叶代替竹筒,得到淡竹叶盐,与原盐、精制海盐和传统竹盐进行比较研究,探究淡竹叶盐在基础理化性质、抗炎以及抗肝癌方面的活性,为新型竹盐产品的开发提供依据。
1 材料与方法
1.1 材料与仪器
粗海盐、精制海盐、一次煅烧竹盐,浙江临安三和园竹盐食品有限公司;淡竹叶盐,实验室制备;淡竹叶,丹贝尔生物科技有限公司;3年生竹段,杭州市小和山国家森林公园;浓盐酸、乙酸、无水乙醇,分析纯,上海凌峰化学试剂有限公司;MEM(minimum essential medium)基础培养基、DMEM(dulbecco′s modified eagle medium)基础培养基、胎牛血清、青霉素、链霉素、人肝癌细胞(HepG2)、人正常肝细胞(WRL68),武汉普诺赛生命科技有限公司;噻唑蓝(thiazolyl blue tetrazolium bromide,MTT),德国BIOFROXX公司;中性红染色液、Griess试剂盒、BCA试剂盒、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素-1β(interleukin-1β,IL-1β)试剂盒、Annexin V-FITC细胞凋亡检测试剂盒,武汉博士德生物工程有限公司;RAW264.7细胞,上海富衡生物科技有限公司。
pHS-3C精密酸度计,杭州齐威仪器有限公司;SpectraMax iD3多功能酶标仪,美谷分子仪器有限公司;Avio 200 ICP-OES电感耦合等离子体发射光谱仪,美国PerkinElmer公司;BB150二氧化碳培养箱、MSC-AdvantageTMA2型II级生物安全柜,美国Thermo Fisher Scientific公司;CKX53倒置显微镜,日本Olympus公司;CytoFLEX流式细胞仪,美国贝克曼库尔特有限公司。
1.2 试验方法
1.2.1 淡竹叶盐的制备
将淡竹叶与粗海盐按质量比1∶9混合均匀放入坩埚中,用高温管式炉加热到850 ℃,升温程序为5 ℃/min,保温2 h,冷却至室温后,取出坩埚,得到淡竹叶盐。
1.2.2 盐的理化性质分析
pH测定。用超纯水准确配制质量分数为0.25%、0.5%、1%、2.5%和5%的粗海盐、精制海盐、一次煅烧竹盐和淡竹叶盐溶液。在25 ℃下,采用pHS-3C精密酸度计测定其pH值。
矿物元素分析。准确称取0.50 g竹筒灰、淡竹叶灰和4种盐样品于样品瓶中,加入2.5 mL浓盐酸和2.5 mL超纯水,在90 ℃下进行硝化处理2 h,稀释200倍配制成溶液,采用电感耦合等离子体发射光谱仪(inductively coupled plasma optical emission spectrometer,ICP-OES)测定溶液中Na、K、Ca、Mg、Fe、Al、P、Se、Sr元素含量。
1.2.3 盐对小鼠巨噬细胞炎症的抑制作用
RAW264.7培养。RAW264.7细胞复苏后,用含10%(质量分数)胎牛血清的DMEM培养液,于5% CO2、37 ℃饱和湿度的培养箱中培养。传至3代后,待细胞状态稳定后移至96孔板中(每孔1×104个细胞)孵育至对数生长期,分组实验。
盐样品对细胞生长毒性的测定。实验分组:配制最终样品质量分数分别为0%、0.1%、0.2%、0.4%、0.6%、0.8%的DMEM细胞培养液。在96孔板中加入混合均匀的细胞悬浮液100 μL(每孔1×104个细胞),培养24 h后移去培养基,按上述分组加入100 μL盐样品溶液,于5% CO2、37 ℃饱和湿度的培养箱中培养24 h,空白对照组只加完全培养基。采用MTT法测定不同浓度样品对细胞存活率的影响。
细胞炎症模型建立。实验分组:配制脂多糖(lipopolysaccharide,LPS)质量浓度分别为0.25、0.5、1、2、4 mg/L的DMEM细胞培养液。在24孔板中加入混合均匀的细胞悬浮液1 mL(每孔1×105个细胞),培养24 h后移去培养基,按上述分组加入1 mL盐样品溶液,于5% CO2、37 ℃饱和湿度的培养箱中培养24 h,空白对照组只加完全培养基,每组设置3个复孔。采用Griess试剂盒测定上述细胞上清液的NO含量,选择NO释放量与对照组有显著性差异的LPS浓度进行后续实验。
盐样品对RAW264.7细胞吞噬能力测定。在96孔板中加入混合均匀的细胞悬浮液100 μL(每孔1×104个细胞),在5% CO2、37 ℃饱和湿度的培养箱中培养24 h,分组实验,每组6个复孔。实验分组:正常对照组(不加样品干预处理)、LPS组(1 mg/L)、质量分数为0.1%的粗海盐、精制海盐、竹盐和淡竹叶盐组,空白对照组(只加DMEM完全培养基)。移去培养基,按上述分组加入100 μL盐样品溶液,于5% CO2、37 ℃饱和湿度的培养箱中培养24 h,空白对照组只加完全培养基,每组设置6个复孔,24 h后弃去培养基,加入100 μL 0.1%(体积分数)中性红染色液,孵育1 h后弃去中性红染色液,用PBS润洗2遍,加入100 μL已配好的细胞裂解液(50%乙酸-50%无水乙醇,体积比1∶1),振荡仪振荡30 min,静置2 h后,在540 nm处测定其吸光值,计算各组细胞吞噬指数。细胞吞噬指数计算如公式(1)所示:
(1)
式中:A表示细胞吞噬指数,%;A0表示空白对照组吸光度;A1表示样品组吸光度。
盐样品对LPS诱导的RAW264.7细胞NO释放量和细胞因子TNF-α、IL-1β含量测定。在24孔板中加入混合均匀的细胞悬浮液1 mL(每孔1×105个细胞),在5% CO2、37 ℃饱和湿度的培养箱中培养24 h,分组实验,每组3个复孔。实验分组:正常对照组(不加样品和LPS干预处理)、LPS组(1 mg/L)、LPS(1 mg/L)+质量分数为0.1%的粗海盐、精制海盐、竹盐和淡竹叶盐组,空白对照组(只加DMEM完全培养基)。弃去培养基,按上述分组加入1 mL盐样品溶液,于5% CO2、37 ℃饱和湿度的培养箱中培养24 h,空白对照组只加完全培养基,每组设置3个复孔,收集细胞上清液,采用Griess试剂盒测定不同样品对RAW264.7细胞释放NO的含量,采用TNF-α、IL-1β试剂盒测定上清液中TNF-α、IL-1β的含量。收集上清液,加入100 μL RIPA细胞裂解液提取细胞核蛋白,采用BCA蛋白浓度测定试剂盒测定每孔蛋白含量。
1.2.4 盐对肝癌细胞和正常肝细胞增殖、凋亡的作用
HepG2/WRL68培养。HepG2/WRL68细胞复苏后,分别用含10%胎牛血清的MEM/DMEM培养液于5% CO2、37 ℃饱和湿度的培养箱中培养。传至3代后,待细胞状态稳定后移至96孔板中(每孔1×104个细胞)孵育至对数生长期,分组实验,每组6个复孔。
MTT法检测细胞存活率。在96孔板中加入混合均匀的HepG2/WRL68细胞悬液100 μL(每孔1×104个细胞),培养24 h,弃去培养基,加入100 μL终盐样品质量分数分别为0.1%、0.2%、0.4%、0.6%和0.8%的细胞培养基,空白对照组只加完全培养基,每组设置6个复孔,于5% CO2、37 ℃饱和湿度的培养箱中培养24 h,采用MTT法测定不同浓度样品对细胞存活率的影响。
流式细胞仪检测细胞凋亡。细胞培养和处理方法同上述方法,收集用0.6%盐样品浓度处理的细胞,用PBS洗2次,用PBS轻轻重悬细胞并计数,取5~10万重悬的细胞,1 000×g离心5 min,弃上清液,加入195 μL Annexin V-FITC结合液轻轻重悬细胞,加入5 μL Annexin V-FITC,轻轻混匀,加入10 μL碘化丙啶染色液,轻轻混匀,室温(20~25 ℃)避光孵育10~20 min,随后置于冰浴中,立即用流式细胞仪检测,记录数据。
1.2.5 统计学处理
实验所有数据用平均值±标准差表示,采用SPSS19.0软件进行统计分析,用方差进行显著性检验P<0.05,Origin 8.0软件制图表。
2 结果与分析
2.1 矿物元素分析
矿物元素分析如表1所示,淡竹叶与竹段相比,含有更为丰富的K、Ca、Mg元素,故淡竹叶盐中的K、Ca、Mg含量也略高于竹盐,而竹盐和淡竹叶盐中K、Ca、Mg、Fe、Se、Sr等含量均高于粗海盐和精制海盐,说明竹盐和淡竹叶盐通过竹盐工艺的高温煅烧,其矿物质的种类增多、矿物质的含量提高。在粗海盐和精制海盐中分别检测出质量浓度为0.061和0.003 mg/L的Pb,而竹盐和淡竹叶盐并没有检测出Pd。严雅丽等[20]研究表明经过高温煅烧的新型功能性植物盐,均具有丰富的元素组成,且重金属Pd的含量显著低于原盐,说明高温煅烧工艺还可以降低重金属污染以及各类有机污染物等风险。

表1 竹段、竹叶和各类盐的矿物质元素含量比较Table 1 Comparison of mineral element contents of bamboo section, bamboo leaf and various salt
2.2 pH分析
根据不同盐样品的酸碱性(图1)可知,在低浓度(0.25%~0.5%)下,4种盐的pH值均小于7,呈弱酸性;在高浓度下,粗海盐和精制海盐溶液的pH仍呈弱酸性,在0.25%~5%(质量分数)时,竹盐和淡竹叶盐的pH值与浓度呈正相关关系,且在质量分数为2.5%时,竹盐和淡竹叶盐的pH明显呈碱性,这是由于竹盐和淡竹叶盐是由粗海盐通过竹盐工艺高温煅烧而成,含有一定量的竹子和淡竹叶灰烬,因而其含有一定量的碳酸根离子,导致其在高浓度条件下呈弱碱性。陈湄沁[22]研究表明,5%的盐浓度下,竹盐的pH值为11.0,而原盐为6.0,两者pH值相差显著,与本实验的结果一致。血液的pH值对人体健康是非常重要的,正常人体血液的pH值约为7.4,呈弱碱性。适当以淡竹叶盐代替传统海盐可以中和人体内多余的酸,如胃酸,对保持人体血液酸碱平衡具有一定的作用。
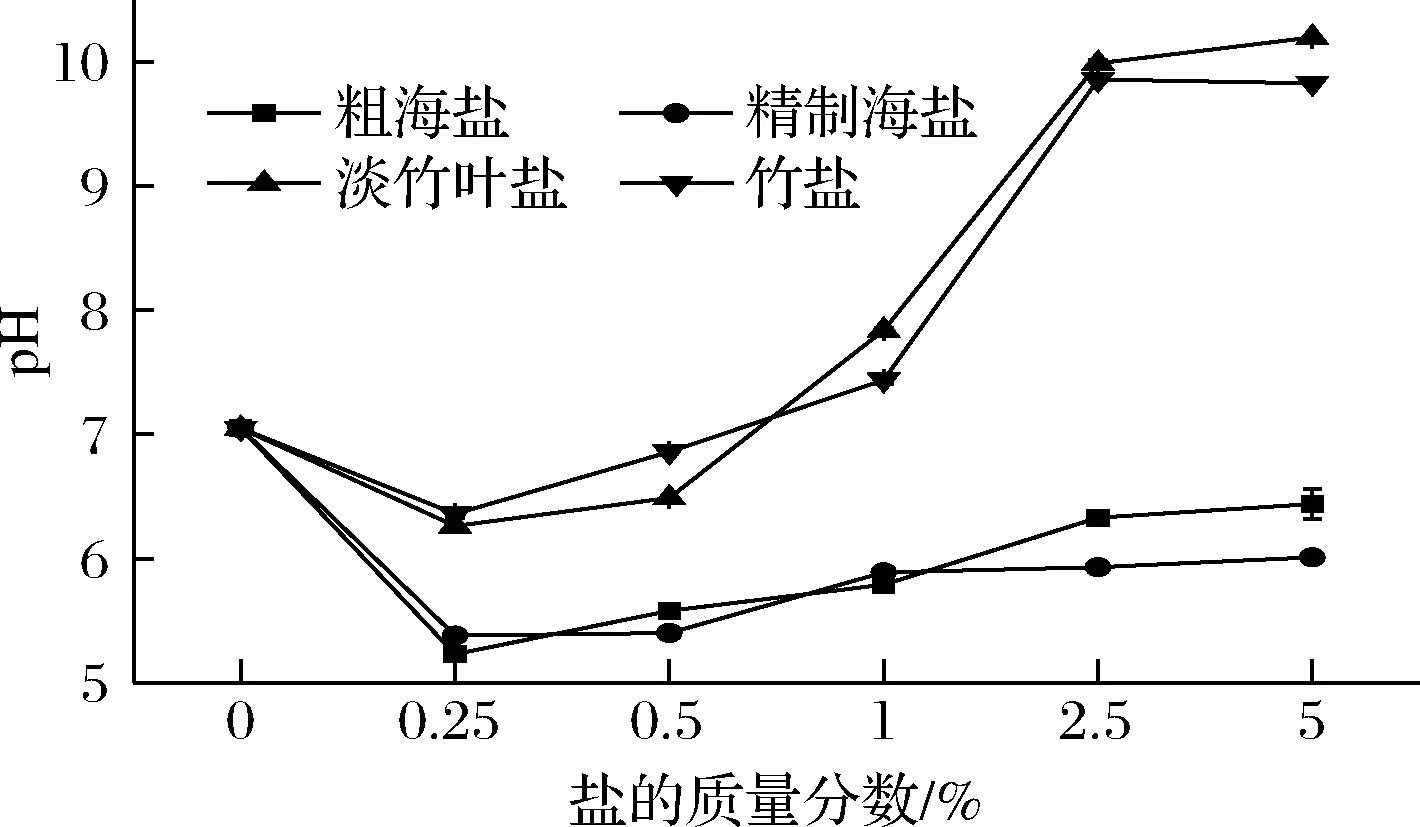
图1 不同质量分数的各类盐的pHFig.1 pH of various salt with different concentrations
2.3 盐样品对RAW264.7细胞炎症的作用
2.3.1 盐样品浓度对RAW264.7细胞毒性和吞噬能力的影响
盐样品浓度对RAW264.7细胞毒性如图2-A所示,通过MTT检测,质量分数为0.1%的盐样品作用于RAW264.7细胞24 h后,与对照组相比,细胞活力无显著性差异。而随着盐样品浓度增加,RAW264.7细胞的存活率与盐样品浓度呈负相关关系。因为随着盐浓度增大,细胞培养基中的渗透压也会增加,从而影响细胞生长,故选择0.1%盐样品浓度进行后续实验。盐样品浓度对RAW264.7吞噬能力的影响如图2-B所示,LPS组和不同盐样品组均能显著增强RAW264.7细胞的吞噬能力;粗海盐组与精制海盐组对RAW264.7细胞的吞噬能力无显著性差异,竹盐组和淡竹叶盐组对RAW264.7细胞的吞噬能力无显著性差异,但与粗海盐组、精制海盐组相比,其对RAW264.7细胞的吞噬能力存在显著性差异。上述结果表明竹盐和淡竹叶盐能更有效增强RAW264.7细胞的吞噬能力。
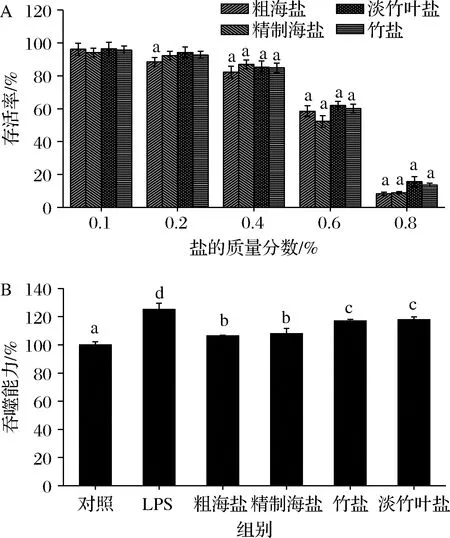
A-细胞毒性;B-吞噬能力图2 盐样品浓度对RAW264.7细胞的影响(n=6)Fig.2 Effect of salt sample concentration on RAW264.7 cells(n=6)注:与对照比较,不同字母表示在相同浓度下差异显著(P<0.05)
2.3.2 LPS浓度对RAW264.7细胞释放NO含量的影响
用LPS诱导RAW264.7细胞产生炎症是一种常用的细胞炎症模型[23]。如图3所示,通过Griess试剂盒检测,0.25~4.00 mg/L的LPS作用于RAW264.7细胞24 h后,与对照组相比,其NO释放量均有极显著性差异,说明建模成功。参考林杨等[24]的研究,最终选择1 mg/L的LPS浓度进行后续实验。
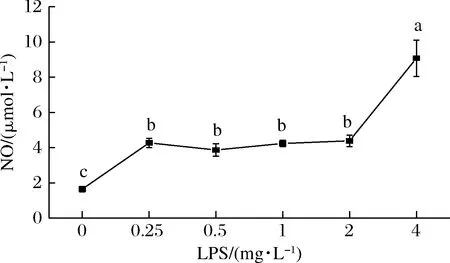
图3 LPS浓度对RAW264.7细胞释放NO含量的影响(n=3)Fig.3 Effect of LPS concentrations on NO production in RAW264.7 cells(n=3)注:不同字母表示与空白组比较,实验组存在显著差异(P<0.05)
2.3.3 盐样品对LPS诱导RAW264.7细胞炎症中NO、TNF-α和IL-1β含量的影响
当LPS对RAW264.7细胞产生刺激时,RAW264.7细胞会被激活,产生炎症介质NO和炎症细胞因子TNF-α、IL-1β等,测定炎症细胞因子TNF-α、IL-1β的含量是评价炎症严重程度的重要指标[25]。由图4-A可知,与对照组相比,LPS组RAW264.7细胞释放NO的含量显著提高(P<0.01)。0.1%粗海盐和精制海盐组与LPS组对RAW264.7细胞释放NO的含量无显著影响(P>0.05),而同浓度的竹盐和淡竹叶盐组可显著降低RAW264.7细胞释放NO的含量(P<0.05),说明了竹盐和淡竹叶盐都具有一定的抗炎作用。由图4-B、4-C可知,LPS模型组中TNF-α、IL-1β的含量显著高于对照组(P<0.05)。0.1%(质量分数)的粗海盐和精制海盐组与LPS模型组相比, RAW264.7细胞中TNF-α、IL-1β的含量无显著性差异,而同质量浓度的竹盐和淡竹叶盐组可显著降低LPS诱导的RAW264.7细胞中TNF-α、IL-1β的含量(P<0.05)。上述实验结果表明:竹盐和淡竹叶盐可通过下调RAW264.7细胞中TNF-α、IL-1β的含量而起到抗炎作用。LEE等[10]的研究表明竹盐可以显著降低人牙龈成纤维细胞中炎症细胞因子IL-1β、IL-8和TNF-α的表达,从而起到抗炎的作用,缓解口腔炎症,与本实验结果类似。研究表明,高盐饮食会诱发高血压和心血管疾病[26],而本实验采用盐溶液质量分数为0.1%,摄入量小,符合我国推荐每日盐摄入量(6 g/d),且又具有一定的抗炎功效,适当以淡竹叶盐代替传统食用盐可能在国民健康中具有较好的应用前景。
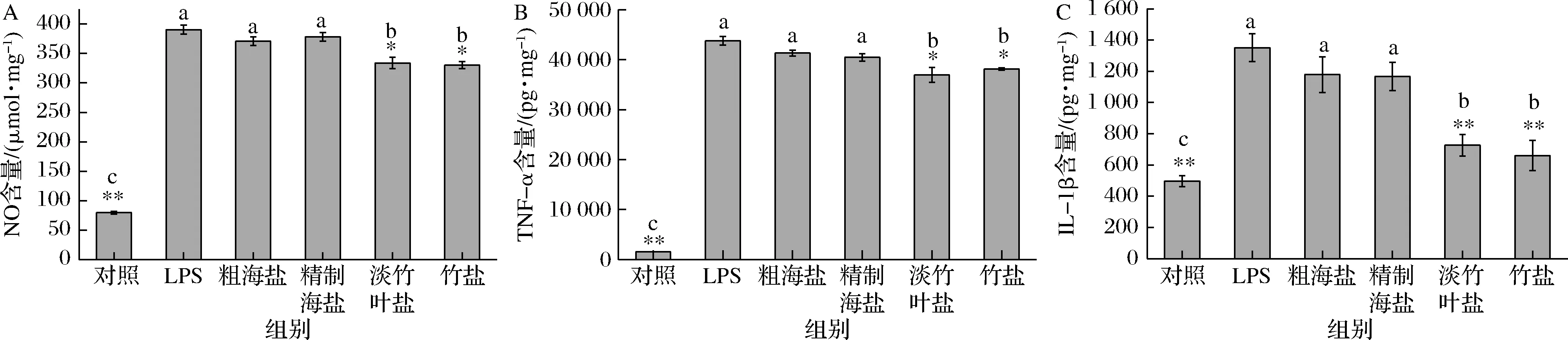
A-NO;B-TNF-α;C-IL-1β图4 盐样品对LPS诱导RAW264.7细胞分泌炎症因子的影响(LPS 1 mg/L、盐质量分数0.1%)(n=3)Fig.4 Effect of salt sample on LPS induced secretion of inflammatory factors in RAW264.7 cells(LPS 1 mg/L、 salt concentration 0.1%)(n=3)注:*表示与LPS组比较,实验组存在显著差异(P<0.05),**表示与LPS组比较,实验组存在极显著差异(P<0.01),不同字母表示 在相同浓度下差异显著(P<0.05)
2.4 盐样品浓度对肝细胞增殖、凋亡的作用
2.4.1 盐样品浓度对HepG2/WRL68增殖的影响
盐样品对HepG2/WRL68增殖的影响如图5所示,由图5可以看出,在盐的质量分数为0.1%~0.8%时,随着盐浓度增加,4种盐样品对于HepG2/WRL68细胞抑制率呈浓度依赖关系,在高浓度下,其样品对HepG2/WRL68细胞有很大的毒性。对于HepG2细胞,在0.6%质量分数下,粗海盐组和精制海盐组存活率为75%左右,而竹盐组和淡竹叶盐组存活率分别为66%和62%。对于WRL68细胞,在同0.6%质量分数下,粗海盐和精制海盐组存活率为80%左右,竹盐和淡竹叶盐组存活率为88%左右。实验结果表明,竹盐和淡竹叶盐的抑制肝癌增殖效果优于粗海盐和精制海盐,而对于正常肝细胞的保护作用高于粗海盐和精制海盐。
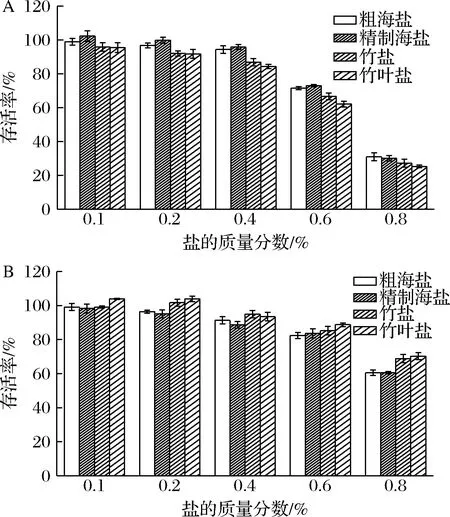
A-HepG2细胞;B-WRL68细胞图5 不同盐样品对HepG2/WRL68的毒性影响Fig.5 Toxic effects of different salt samples on HepG2/WRL68 cells
2.4.2 盐样品对HepG2细胞凋亡的影响
由2.4.1可知,在高浓度下(质量分数为0.8%),盐样品均对HepG2细胞有很大的毒性,而在低浓度下(质量分数为0.1%~0.4%),盐样品对HepG2细胞存活率的影响较弱,故选取质量分数为0.6%的盐样品处理细胞。如图6所示,采用质量分数为0.6%的盐样品作用HepG2细胞24 h后,与正常对照组相比,淡竹叶盐组可以显著抑制HepG2细胞增殖,促进HepG2细胞的凋亡,且促凋亡效果优于竹盐组、粗海盐组和精制海盐组。由图7可知,质量分数为0.6%的盐样品作用HepG2细胞24 h后,淡竹叶盐的总凋亡率为(45.85±2.93)%,高于竹盐组[(38.89±2.56)%]、粗海盐组[(31.78±4.18)%]和精制海盐组[(29.63±1.89)%];其中,淡竹叶盐主要影响肝癌细胞的早期凋亡,竹盐主要影响肝癌细胞的晚期凋亡。PARK等[27]研究表明竹盐对HepG2细胞具有较好的抗癌作用且高于同浓度原盐和精制盐,与本实验的结果一致。YI等[18]研究表明不同煅烧次数的竹盐对抑制小鼠体内的肿瘤增殖效果存在显著差异,其中九烤竹盐增殖抑制效果优于三烤竹盐、一烤竹盐,且不同煅烧次数的竹盐均高于精制食盐和原盐,说明竹盐中的微量元素含量与其生理活性具有密切相关的联系。

A-对照;B-0.6%粗海盐;C-0.6%精制海盐;D-0.6%竹盐;E-0.6%淡竹叶盐图6 不同盐样品对HepG2细胞凋亡的影响Fig.6 Effect of different salts on apoptosis of HepG2 cells
2.4.3 盐样品对WRL68细胞凋亡的影响
根据2.4.2,采用质量分数为0.6%的盐样品处理WRL68细胞。由图8可知,与正常对照组相比,竹盐组和淡竹叶盐组对WRL68细胞的凋亡率远低于粗海盐组和精制海盐组,说明竹盐和淡竹叶盐的抑制凋亡效果更加显著,可以抵制 WRL68细胞的凋亡,保护正常肝细胞的生长。由图9可知,质量分数为0.6%的盐样品作用肝细胞24 h后,与对照组相比,淡竹叶盐组的细胞存活率[(83.67±2.72)%]显著高于竹盐组[(81.56±2.37)%]、粗海盐[(75.57±2.20)%]和精制海盐[(77.35±3.49)%],表明在高盐浓度下,淡竹叶盐对正常肝细胞损伤程度低于粗海盐、精制海盐和精制海盐。ZHAO等[28]的研究表明竹盐可以显著降低肝损伤的大鼠血清中天门冬氨酸氧基转移酶和谷氨酸氨基转移酶的活性,降低大鼠的肝脏组织的受损程度,说明竹盐对肝损伤具有一定的保护作用。

A-对照;B-0.6%粗海盐;C-0.6%精制海盐;D-0.6%竹盐;E-0.6%淡竹叶盐图8 不同盐样品对WRL68细胞凋亡的影响Fig.8 Effect of different salts on apoptosis of WRL68 cells
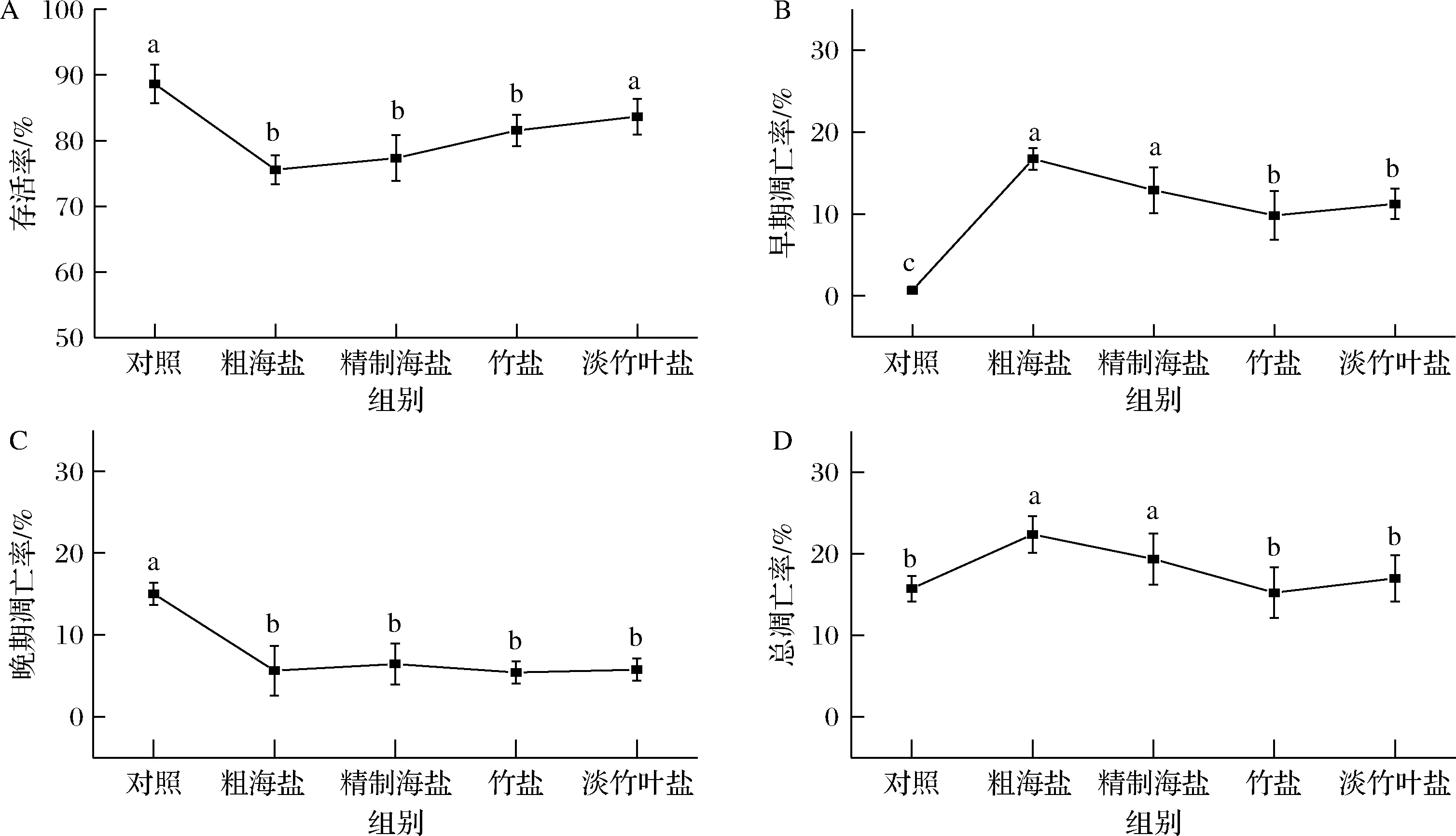
A-细胞存活率;B-早期凋亡率;C-晚期凋亡率;D-总凋亡率图9 不同盐样品对WRL68细胞凋亡率的影响(n=3)Fig.9 Effect of different salts sample on apoptosis rate of WRL68 cells(n=3)
3 结论
研究采用竹盐制备工艺制备淡竹叶盐,比较研究了粗海盐、精制海盐、传统竹盐和淡竹叶盐的pH、矿物元素含量等理化指标,分析了4种盐的抗炎效果及抑制肝癌细胞的效果。结果表明:淡竹叶盐呈弱碱性,矿物元素组成丰富,尤其是K、Ca、Mg含量较高。抗炎实验结果表明:淡竹叶盐能显著增强RAW264.7细胞吞噬能力,抑制NO释放以及降低TNF-α、IL-1β分泌。抑制肝癌细胞的实验结果表明:淡竹叶盐对肝癌细胞的抑制增殖作用显著强于粗海盐、精制海盐和竹盐;在高盐浓度下,其对正常肝细胞保护作用高于粗海盐、精制海盐和竹盐;因此淡竹叶盐在品质上优于粗海盐、精制海盐和竹盐。同时淡竹叶盐中K含量较高,可以减少钠的吸收,预防高血压等慢性病。由于人类的健康与盐的摄入具有重要的关系,以淡竹叶盐为例的新型功能性盐的开发与探究都具有重要的意义。若在人们饮食中用新型功能性盐代替部分普通食盐,将会对国民健康起到积极作用。