降钙素原、D-二聚体和脑钠肽在老年医院获得性肺炎诊断、病情判断及预后评估中的应用分析
2021-11-03闫登峰朱春雨
肖 庆,喻 东,闫登峰,朱春雨,张 亚
医院获得性肺炎(hospital acquired pneumonia,HAP)是一种临床常见的医院获得性感染性疾病,具有病情进展快、预后差、发病率和病死率高等特点。调查显示,我国住院患者HAP发病率为3.22%~5.22%,普通病房患者HAP发病率低于重症监护病房患者,约15%的住院死亡患者与HAP密切相关[1]。老年患者由于呼吸道防御机能减弱,且常合并心脑血管疾病、糖尿病等基础性疾病,机体免疫功能降低,难以抵御院内环境中存在的细菌、病毒等病原微生物的侵袭,长期住院治疗时HAP的发病风险倍增[2]。目前,临床HAP诊断中常用的有体征/症状观察、X线/CT检查、痰培养等,但均存在较多缺陷。降钙素原(procalcitonin, PCT)是细菌感染标志物,其水平变化可反映肺炎严重程度;D-二聚体(D-dimer,D-D)为交联纤维蛋白降解产物,在感染、弥散性血管内凝血(disseminated intravascular coagulation,DIC)、组织坏死等情况下可升高;脑钠肽(brain natriuretic peptide, BNP)在心室容量增加和压力超负荷时由心肌细胞分泌并释放入血液,是心脏疾病标志物,但多种非心源性因素也可影响其水平。本研究主要探讨血浆PCT、BNP和D-D指标在老年HAP诊断、病情危险程度分层和预后评估中的应用,为老年HAP的诊断、病情判断及预后评估提供依据,现报道如下。
1 对象与方法
1.1 对象 选取2018年6月—2019年12月周口市中心医院呼吸内科收治的96例住院期间发生HAP的老年患者作为HAP组,其中男52例,女44例,年龄为61~77岁,平均为(68.25±4.26)岁。根据肺炎严重指数(pneumonia severity index,PSI)将96例患者分为低危组(PSI评分≤90分)39例,高危组(PSI>130分)22例和中危组(90分<PSI评分≤130分)35例。根据28 d生存情况将96例HAP患者分为死亡组(13例)和生存组(83例)。入选标准:①HAP患者诊断符合《中国成人医院获得性肺炎与呼吸机相关性肺炎诊断和治疗指南(2018版)》[3]标准;②研究对象临床资料齐全,征得患者或家属同意并签署知情同意书。排除标准:①伴发有心脏和/或肝脏等器官功能不全患者;②合并有恶性肿瘤、肺结核等疾病患者;③伴有精神疾病或有意识障碍者;④伴有机体其他部位感染者。另外随机抽样选择50例同期于我院体检中心健康体检无异常的老年人为健康对照组,其中男28例,女22例,年龄为62~78岁,平均为(68.59±4.83)岁。HAP组和健康对照组在年龄、性别、身体质量指数(body mass index, BMI)等基础资料方面相比,差异均无统计学意义(P均>0.05),具有可比性。见表1。
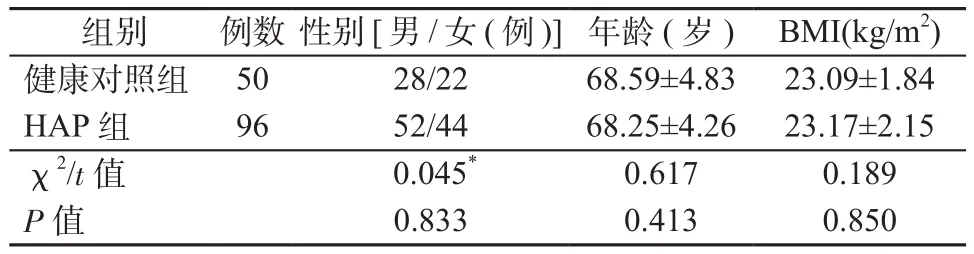
表1 2组基础资料比较Table 1 Comparison of basic data of 2 groups
1.2 PSI评分 根据HAP患者年龄、合并症(脑血管病、肿瘤、肾脏疾病、肝脏疾病、充血性心力衰竭)、生命体征(收缩压、呼吸频率、脉搏、体温)、血糖、动脉血pH、血钠、血尿素氮、血比容、二氧化碳分压等进行评分,分为Ⅰ~Ⅴ级。Ⅰ级:PSI评分≤50分。Ⅱ级:PSI评分51~70分。Ⅲ级:PSI评分71~90分。Ⅳ级:PSI评分91~130分。Ⅴ级:PSI评分>130分。PSI分值越高则患者病情越严重。
1.3 方法 采集HAP患者及健康对照组各观察时间点清晨空腹外周静脉血4 ml于枸橼酸盐抗凝试管,室温静置30 min,离心并分离出上层血浆。应用罗氏Cobas e601型全自动电化学发光免疫分析仪及配套试剂化学发光法测定血浆PCT和BNP;通过Sysmex-7000血凝分析仪用免疫比浊法测定血浆D-D。检测所用设备均经过校准并可正常运行,检测试剂盒均有批检报告,且在有效期内。PCT参考值为0~0.5 μg/L;BNP参考值为0~125 pg/ml;D-D 参考值为 0 ~ 550 μg/L。
1.4 统计学处理 采用SPSS 17.0软件对数据进行分析。计量资料符合正态分布以x±s表示,2组间比较用独立样本t检验和配对t检验,多组之间比较用单因素方差分析。计量资料用例(%)表示,比较用χ2检验。采用Pearson相关性分析法分析生存患者PCT、BNP和D-D与PSI评分的相关性,用ROC曲线比较PCT、BNP和D-D对HAP的诊断效能,P<0.05表示差异有统计学意义。
2 结 果
2.1 HAP组和健康对照组治疗前PCT、BNP和D-D水平比较 HAP组患者治疗前PCT、BNP和D-D平均水平均显著高于健康对照组(P均<0.05)。见表2。
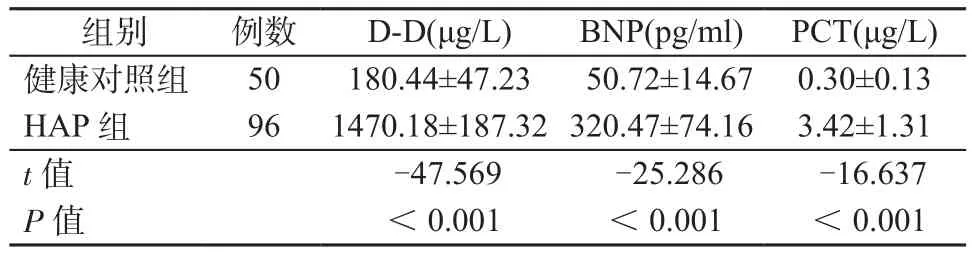
表2 HAP组和健康对照组PCT、BNP和D-D水平比较Table 2 Comparison of PCT, BNP and D-D levels between HAP group and healthy control group
2.2 治疗前PCT、BNP和D-D对HAP诊断效能比较 治疗前D-D水平诊断HAP的AUC为0.759(95%CI:0.654~0.865);治疗前BNP水平诊断HAP的AUC为0.814(95%CI:0.716~0.912);治疗前PCT水平诊断HAP的AUC为0.899(95%CI:0.835~0.964)。见图1。
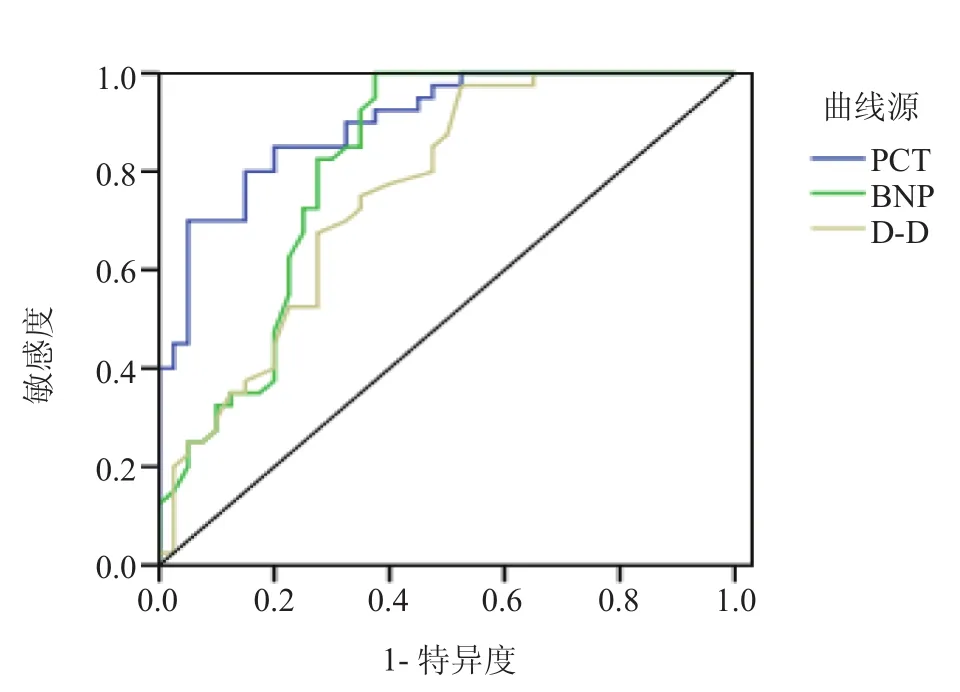
图1 PCT、BNP和D-D诊断HAP的ROC曲线Figure 1 ROC curve of PCT, BNP and D-D for diagnosing HAP
2.3 不同病情严重程度患者治疗前PCT、BNP、D-D水平及PSI评分比较 不同病情严重程度分组患者治疗前PCT、BNP、D-D水平及PSI评分比较,差异均有统计学意义(P均<0.05);高危组治疗前PCT、BNP、D-D水平和PSI评分均显著高于中危组和低危组(P均<0.05),中危组治疗前PCT、BNP、D-D水平和PSI评分均显著高于低危组(P均<0.05)。见表3。

表3 不同病情严重程度患者治疗前PCT、BNP、D-D水平及PSI评分比较Table 3 Comparison of PCT, BNP, D-D levels and PSI score in patients with different severities before treatment
2.4 不同预后患者治疗前PCT、BNP和D-D水平及PSI评分比较 死亡组治疗前PCT、BNP和D-D水平及PSI评分均高于生存组,差异有统计学意义(P均<0.05)。见表4。
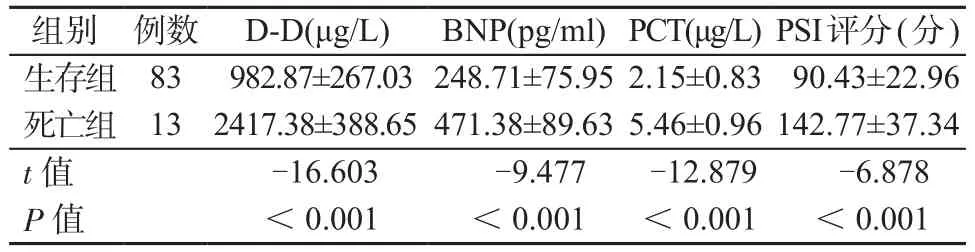
表4 不同预后患者治疗前PCT、BNP和D-D水平及PSI评分比较Table 4 Comparison of PCT, BNP, D-D levels and PSI score in patients with different prognosis before treatment
2.5 PCT、BNP和D-D水平与PSI评分相关性分析 HAP生存组患者治疗前D-D水平与PSI评分呈正相关(rD-D=0.647,P<0.001),PCT、BNP水平与PSI评分呈弱正相关(rBNP=0.489,P<0.001;rPCT=0.536,P<0.001)。见图2~4。
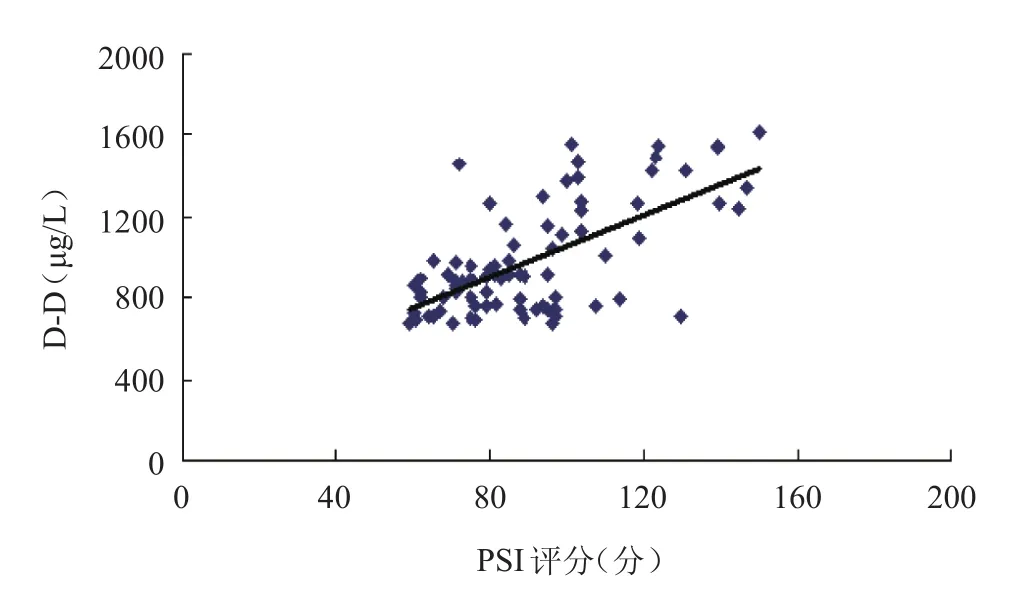
图2 D-D与PSI评分相关性Figure 2 Correlation of D-D with PSI scores

图3 BNP与PSI评分相关性Figure 3 Correlation of BNP with PSI scores
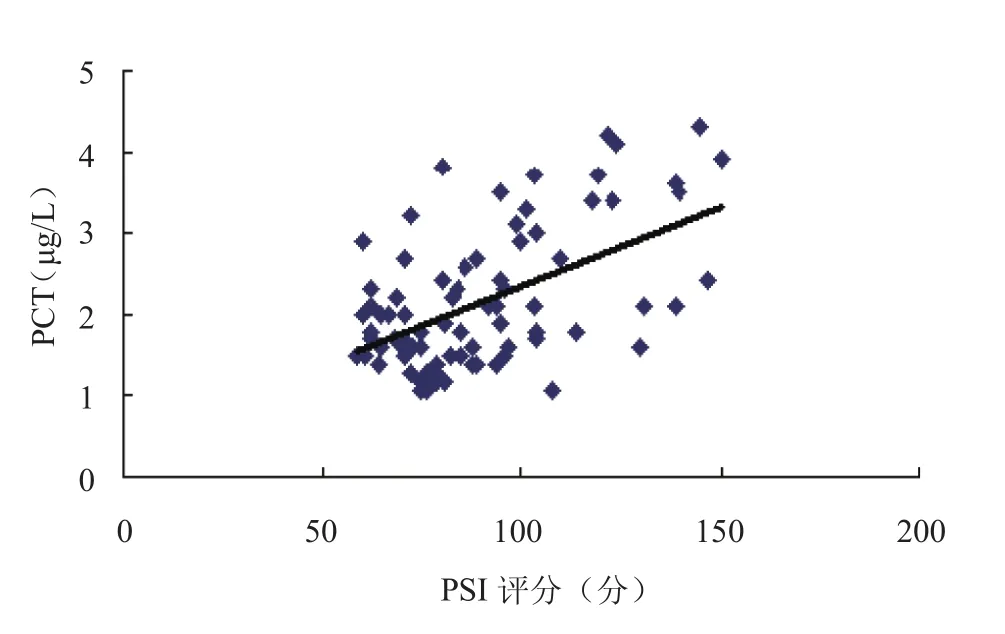
图4 PCT与PSI评分相关性Figure 4 Correlation of PCT with PSI scores
2.6 生存组治疗前后PCT、BNP和D-D水平比较 生存组治疗后PCT、BNP和D-D水平均低于治疗前,差异均有统计学意义(P均<0.05)。见表5。

表5 生存组治疗前后PCT、BNP和D-D水平比较Table 5 Comparison of PCT, BNP, D-D levels before and after treatment in survival group
3 讨 论
HAP是指患者在入院时不具有肺炎症状体征,也不处于肺炎感染的潜伏阶段,而是于住院48 h以后发生的由病毒、真菌、细菌等病原体感染引起的肺实质炎症性疾病。目前,HAP发病率居于我国医院内感染的首位,同时也是医院内感染控制的难点[4]。HAP发病凶险,患者病情进展快,病死率高,不仅可引起原发性肺损伤,也可引起急性肾损伤、心力衰竭、休克等诸多肺外并发症,且延长患者住院时间,严重影响患者的治疗效果和预后[5]。HAP多发生于老年体质较差、气管切开及气管插管机械通气治疗的患者,轻症肺炎可在短期内发展为重症,因此早期对患者作出诊断和病情评估,对指导临床调整治疗方案、改善预后尤为重要。PSI评分是评估肺炎病情严重程度的重要指标,其主要涵盖患者基础资料、体征/症状、实验室检查指标、基础疾病等因素,可对患者病情进展、预后进行评估,但这一评分方法观察变量多、评估所需时间较长,易延误患者治疗时机[6]。血清学检查因操作简便、重复性强等优点,越来越多应用于HAP诊断及病情评估。研究显示,抗炎介质与促炎介质平衡可维持肺炎患者机体内环境的稳定,HAP患者炎症因子的过表达以及抗炎介质与促炎介质的失衡,可导致肺泡毛细血管损伤,使肺泡毛细血管充血水肿,进而增加肺泡毛细血管通透性和促进患者病情进展,因而血清炎症因子检测对于HAP的诊断和病情严重程度评估以及预后评价具有重要作用[7-8]。正常情况下,人体血液中PCT水平极低,当机体受到细菌感染时,在炎症介质、细菌内毒素作用下血液中PCT水平快速升高,而机体受到病毒感染、过敏反应及发生自身免疫性疾病时,血液中PCT水平则不升高[9]。熊方等[10]研究显示,老年HAP患者中PCT呈高表达,且病情越严重,PCT水平越高。邢琳琳等[11]报道显示,HAP组(入住ICU期间发生HAP)患者血清PCT显著高于非HAP组(入住ICU期间未发生HAP),且随着患者病情加重而升高,可作为HAP疾病诊断、病情严重程度判断和预后评估的指标。BNP是由心室肌细胞合成、分泌反映心脏张力的一种神经内分泌激素,其与左心室收缩/舒张功能、心率等密切相关,是心力衰竭、心肌梗死等心脏疾病诊断的生物标志物[12]。研究显示,细菌内毒素、肺炎状态下产生的炎症因子(IL-6、TNF-α等)可促进心脏合成、释放BNP;此外,肺炎患者在炎症因子及缺氧作用下致肺小血管广泛收缩,引起心脏负荷增加和肺动脉压升高,进而促进BNP释放[13]。D-D是机体内交联纤维蛋白降解后形成的特异性产物,当机体血液高凝状态及内源性纤维蛋白溶解时,D-D水平升高,是诊断DIC前状态和DIC的分子标志物[14]。另外,娄坚江等[15]研究显示,D-D水平与PSI评分呈正相关,血液中高水平D-D提示患者肺炎危险程度及死亡风险较高。
本研究结果显示,HAP组患者治疗前PCT、BNP和D-D平均水平均显著高于健康对照组,与以往类似报道相符[16]。其原因可能为:老年患者肺部感染早期,在炎症介质和病原微生物产生的毒素作用下,可对肺部微血管的血管壁造成一定损伤,加之老年患者血流相对较慢,可进一步激活凝血系统,在微血管内形成微血栓,进而激活纤溶系统,纤溶酶裂解纤维蛋白(原)为纤维蛋白原降解片段,导致血液中D-D水平升高[17];老年HAP患者因肺血流/通气功能出现异常,在一氧化氮和内皮素等血管活性物质作用下致循环阻力升高,心脏负荷增加,进而释放更多BNP[18]。此外,PCT、BNP和D-D水平诊断HAP的AUC分别为0.899、0.814和0.759,提示早期检测上述3项指标对于HAP患者诊断具有一定的价值,其中以治疗前PCT水平对HAP发生的预测更为准确。本研究结果还显示,高危组HAP患者PCT、BNP、D-D水平及PSI评分显著高于中危组和低危组,中危组PCT、BNP、D-D水平及PSI评分均显著高于低危组,患者病情越严重,PCT、BNP、D-D水平及PSI评分越高,提示PCT、BNP、D-D水平与PSI评分判断患者病情相一致。
本研究中96例HAP患者经过治疗有13例(13.98%)死亡,死亡组治疗前PCT、BNP和D-D水平均显著高于生存组,生存组治疗后PCT、BNP和D-D水平均低于治疗前,因此对于PCT、BNP和D-D水平过高患者应给予足够重视,加强病情监测和治疗,以降低患者病死率。此外,生存组患者D-D水平与PSI评分呈正相关,提示在上述3项检查指标中,D-D检测可用于HAP患者病情严重程度的初步评估;而PCT、BNP与PSI评分相关性较差,这可能与本研究中HAP患者的选择或样本量较少有关。
综上所述,老年HAP患者PCT、BNP和D-D水平异常升高,并与肺炎严重程度呈正相关,PCT、BNP和D-D水平可反映老年HAP患者病情严重程度和预后情况。
