二甲双胍联合miR-145对胃癌BGC823细胞增殖凋亡及AKT信号通路的影响
2021-11-03田春阳刘晓政范军朝
田春阳 刘晓政 范军朝
微小RNA(microRNA,miRNA)是一类非编码短序列的RNA,多数miRNAs 在胃癌的组织或细胞中异常表达,参与肿瘤细胞的增殖凋亡等生物学过程,调控着胃癌的发生发展[1-2]。近年来有研究指出,miR-145 在胃癌中异常低表达,与胃癌的恶性增殖和转移关系密切[3-4],以miR-145 为治疗胃癌靶点的研究备受关注。二甲双胍是临床上常用的一种口服降糖药,其在胃癌治疗中也表现出良好的抗肿瘤作用[5-6]。有研究指出,miR-145 联合二甲双胍具有协同抑制人结肠癌细胞株HCT116增殖的作用[7]。本研究旨在阐明miR-145 联合二甲双胍抗胃癌的可行性,并探讨其可能的分子机制,以期为胃癌的治疗提供新的策略和理论依据。
1 材料与方法
1.1 主要试剂
人胃癌细胞株BGC823 购于中国科学院上海细胞库。RPMI1640 培养基、新生牛血清、Trizol 试剂和Lipofectamine 2000 购于美国Invitrogen 公司。miR-145 mimic、阴性对照NC 和PCR 引物购于上海吉玛制药技术有限公司。噻唑蓝(Methylthiazolyldiphenyl-tetrazolium bromide,MTT)试剂和二甲基亚枫购于Sigma-Aldrich 公司,逆转录-聚合酶链反应(Reverse Transcription-Polymerase Chain Reaction,RT-PCR)试剂和细胞裂解液购于北京全式金生物技术有限公司,甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)抗体购于Bioworld 公司,细胞周期素D1(Cyclin D1)抗体购于美国Cell Signaling Technology 公司,磷酸化蛋白激酶B(Phosphorylated protein kinase B,p-Akt)抗体、B 淋巴细胞瘤-2 基因(B-cell lymphoma-2,Bcl-2)抗体、辣根过氧化酶标记的羊抗鼠/兔IgG 购于美国Santa Cruz 公司,聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜和增强化学发光(enhancedchemiluminescence,ECL)试剂盒购于美国Millipore 公司,逆转录试剂盒、凋亡检测试剂盒购于上海碧云天生物技术有限公司,二喹啉甲酸(Bicinchoninic acid,BCA)蛋白定量试剂盒购于美国Thermo 公司。
1.2 主要仪器
HERA cell240 CO2细胞培养箱购于德国Heraeus 公司,Meddel680 酶标仪、Western blot 转膜系统购于美国BIO-RAD 公司,Moflo XDP 流式细胞仪购于美国Beckmancoulter 公司,Mastercycler pro梯度PCR 仪购于美国Eppendorf 公司。
1.3 方法
1.3.1 细胞培养与转染
用含10%胎牛血清、0.1 mg/mL 链霉素和100 U/mL 青霉素的RPMI1640 培养基在CO2体积分数为5%、温度为37℃和湿度饱和的细胞培养箱中培养BGC823 细胞。取对数生长期的BGC823 细胞,以每孔106个细胞种植到6 孔细胞板上,于培养箱内常规培养过夜。待细胞汇合度超过70%时进行转染。实验分为对照组(未转染)、NC 组(转染阴性对照NC)和miR-145 组(转染miR-145 mimic),参照转染试剂Lipofectamine 2000 使用说明书步骤根据上述分组进行转染。孵育6 h 后,更换含血清的培养基继续培养。48 h 后,采用RT-PCR 检测各组细胞中miR-145 的表达水平,以评价其转染效果。
1.3.2 RT-PCR 检测
采用Trizol 法提取对照组、NC 组和miR-145组细胞的总RNA,并以紫外分光光度计对总RNA进行浓度和纯度的定量。以RNA 为模板,参照逆转录试剂盒步骤合成cDNA。再跟据上海吉玛公司合成的miR-145 引物(上游5′ATTATATTGTCCAGTTTTCCCAGG-3′,下游5′-AAAGGTT-GTTCTCCACTCTCTCTC-3′)及内参U6 引物(上游5′-ATTGGAACGATA-CAGAAGATT-3′和下游5′-GGAACGCTTCACGAATTTG-3′),以50 μL 反应体系(上下游引物各1 μL、dNTP Mix 1 μL、Taq DNA 聚合酶1 μL、cDNA 模板2 μL 和ddH2O 44 μL)按照反应条件(94 ℃预变性3 min;94 ℃变性50 s,60 ℃退火50 s,72 ℃延伸50 s,共循环35 次;最后72℃后延伸6 min)进行PCR 扩增,取5 μL 扩增产物进行琼脂糖凝胶电泳,采用2-△△Ct法计算各组BGC823 细胞中miR-145 的表达水平。
1.3.3 MTT 法检测
取对数生长期BGC823 细胞,以每孔5×103个细胞种植到96 孔细胞板上,置于细胞培养箱内培养24 h。设置空白对照组(0 mmol/L 二甲双胍)和二甲双胍处理组(加入2.5、5、10、20 和40 mmol/L二甲双胍),并设置无细胞的调零孔。根据实验分组加入二甲双胍分别作用24、48 和72 h。其中,每个浓度设置3 个复孔。参照文献[8]上酶标仪检测各组细胞在570 nm 波长处的光密度值(optical density,OD 值),根据公式计算各组细胞的存活率。细胞存活率(%)=(二甲双胍组OD 值-调零组OD 值)/(空白对照组OD 值-调零组OD 值)×100%。每组实验重复检测3 次。
1.3.4 流式细胞仪检测
取对数生长期BGC823 细胞,以每孔3×104个细胞种植于6 孔细胞板上,孵育24 h 后,将其随机分为未处理组(不做处理)、二甲双胍组(加入10 mmol/l 二甲双胍)、miR-145 组(转染miR-145 mimic)和二甲双胍+miR-145 组(转染miR-145 mimic后加入10 mmol/l 二甲双胍),根据实验分组对BGC823 细胞进行转染和药物处理后,于细胞培养箱内培养72 h,参照凋亡检测试剂盒说明书步骤检测各组细胞的凋亡率。参照1.2.3 中的方法检测各组细胞的存活率。每组实验重复检测3 次。
1.3.5 Western blot 检测
收集未处理组、二甲双胍组、miR-145 组和二甲双胍+miR-145 组细胞,于冰上加入细胞裂解液提取总蛋白,所提总蛋白经BCA 法检测定量后,与上样缓冲液等量混合,上SDS-PAGE 凝胶电泳分离,然而采用转膜仪将其转至PVDF 膜上,以封闭液(含50 g/l 脱脂奶粉)处理2 h 后,分别依次加入1∶500 倍稀释的一抗于4℃反应24 h、1∶2 000 倍稀释的辣根过氧化酶标记的二抗于37 ℃反应1 h,抗原抗体充分反应后,以ECL 化学发光剂显色,成像仪成像,以GAPDH 为内参,Image J 软件分析。
1.4 数据分析
采用SPSS 20.0 软件进行统计学分析,计数资料()表示,多组间比较采用单因素方差分析,组间比较采用SNK-q检验,两组间比较采用独立样本t检验。以P<0.05 差异有统计学意义。
2 结果
2.1 转染后胃癌BGC823 细胞中miR-145 的表达
NC 组细胞中miR-145 表达与对照组比较差异无统计学意义(P>0.05),但miR-145 组中miR-145表达较对照组显著升高,差异有统计学意义(P<0.05)。见表1。
表1 转染后各组胃癌BGC823细胞中miR-145的表达(±s)Table 1 The relative expression of miR-145 in gastric cancer BGC823 cells after transfection(±s)

表1 转染后各组胃癌BGC823细胞中miR-145的表达(±s)Table 1 The relative expression of miR-145 in gastric cancer BGC823 cells after transfection(±s)
注:与对照组相比,aP<0.05。
组别对照组NC 组miR-145 组F 值P 值miR-145 1.00 0.96±0.07 3.65±0.34a 177.513 0.000
2.2 二甲双胍对胃癌BGC823 细胞增殖的影响
以不同浓度二甲双胍处理胃癌BGC823 细胞24、48 和72 h 后,MTT 法筛选出接近半数抑制浓度的二甲双胍。与空白对照组(0 mmol/L)相比,二甲双胍处理组中细胞的存活率均显著降低(P<0.05),且呈时间-剂量依赖性。在72 h 作用时间下,10 mmol/L 二甲双胍对BGC823 细胞的抑制作用接近半数抑制浓度,故后期选用10 mmol/L 浓度的二甲双胍作用72 h 进行实验。见表2。
表2 二甲双胍对胃癌BGC823 细胞存活率的影响(±s)Table 2 Effect of metformin on survival rate of gastric cancer BGC823 cells(±s)
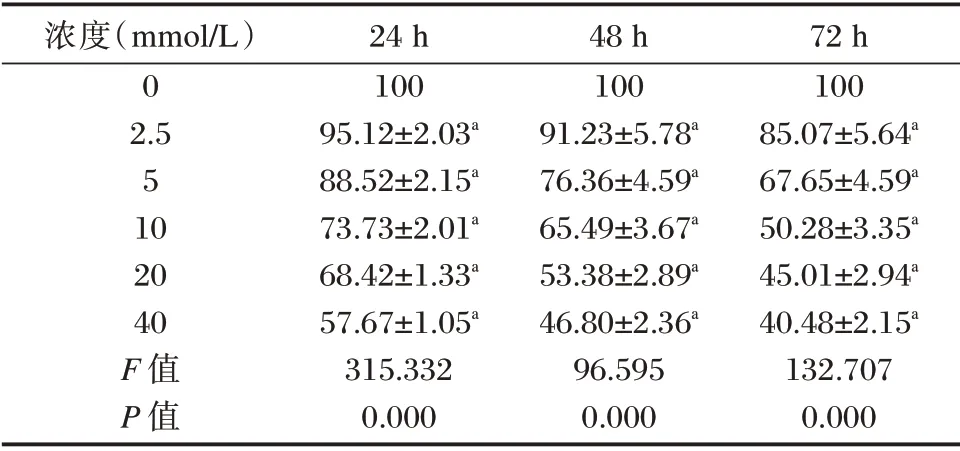
表2 二甲双胍对胃癌BGC823 细胞存活率的影响(±s)Table 2 Effect of metformin on survival rate of gastric cancer BGC823 cells(±s)
注:与0 mmol/L 相比,aP<0.05。
72 h 100 85.07±5.64a 67.65±4.59a 50.28±3.35a 45.01±2.94a 40.48±2.15a 132.707 0.000浓度(mmol/L)0 2.5 5 10 20 40 F 值P 值24 h 100 95.12±2.03a 88.52±2.15a 73.73±2.01a 68.42±1.33a 57.67±1.05a 315.332 0.000 48 h 100 91.23±5.78a 76.36±4.59a 65.49±3.67a 53.38±2.89a 46.80±2.36a 96.595 0.000
2.3 二甲双胍单独或联合miR-145 对胃癌BGC823 细胞增殖凋亡的影响
与未处理组相比,二甲双胍组、miR-145 组和二甲双胍+miR-145 组细胞的存活率显著降低,凋亡率显著升高,且二甲双胍+miR-145 组的作用强度明显大于二甲双胍组或miR-145 组(P<0.05)。见图1和表3。
表3 各组BGC823 细胞存活率和凋亡率的比较(±s)Table 3 Comparison of BGC823 cell survival rate and apoptosis rate in each group(±s)
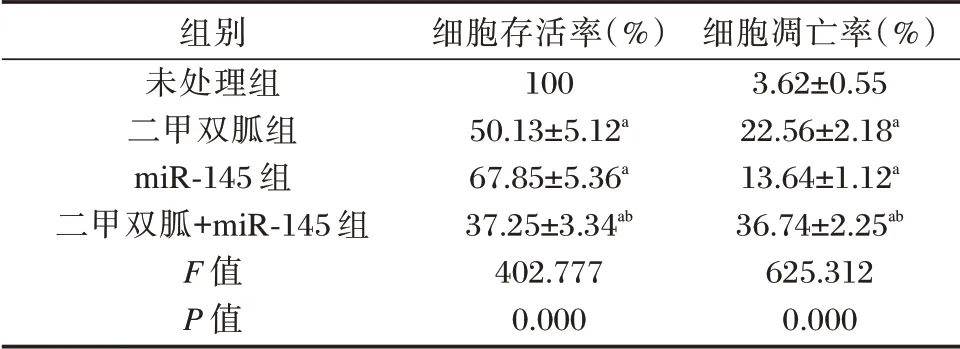
表3 各组BGC823 细胞存活率和凋亡率的比较(±s)Table 3 Comparison of BGC823 cell survival rate and apoptosis rate in each group(±s)
注:与未处理组相比,aP<0.05;与二甲双胍组相比,bP<0.05。
组别未处理组二甲双胍组miR-145 组二甲双胍+miR-145 组F 值P 值细胞存活率(%)100 50.13±5.12a 67.85±5.36a 37.25±3.34ab 402.777 0.000细胞凋亡率(%)3.62±0.55 22.56±2.18a 13.64±1.12a 36.74±2.25ab 625.312 0.000
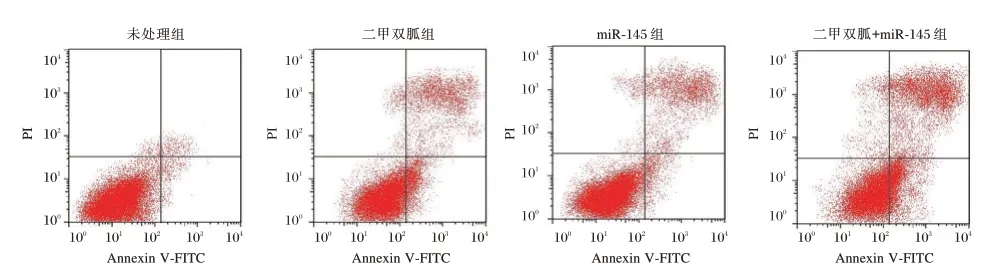
图1 流式细胞仪检测各组细胞的凋亡Figure 1 The apoptosis of cells in each group was detected by flow cytometry
2.4 二甲双胍单独或联合miR-145 对胃癌BGC823细胞中CyclinD1、Bcl-2 和p-AKT 蛋白表达的影响
与未处理组相比,二甲双胍组、miR-145 组和二甲双胍+miR-145 组中三种蛋白的表达水平均显著降低,且二甲双胍+miR-145 组显著低于二甲双胍组或miR-145 组(P<0.05)。见表4。
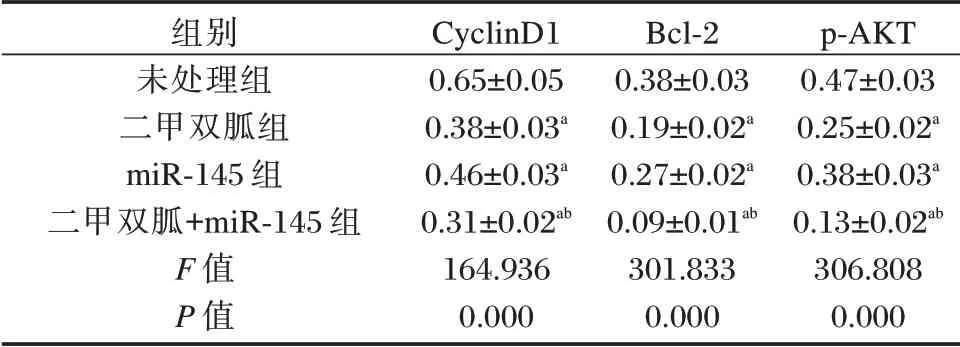
表4 各组BGC823 细胞中CyclinD1、Bcl-2 和p-AKT 蛋白的相对表达量Table 4 The relative expression of CyclinD1,Bcl-2 and p-AKT proteins in BGC823 cells of each group
3 讨论
肿瘤的发生发展是一个复杂的过程,miRNA在其中发挥着原癌基因或抑癌基因的调控作用。miR-145 是一种高度保守的miRNA,定位于5q32染色体上,可通过多种途径调控细胞的增殖和凋亡过程,参与肿瘤的发生与演变。miR-145 在肾细胞癌组织中的表达显著下调,与肿瘤的分期、肿瘤大小等密切相关[9];上调肝癌或宫颈癌细胞中miR-145 表达可通过抑制癌细胞的增殖、侵袭和迁移并诱导细胞凋亡[8,10]。另外,miR-145 还可通过抑制MRP1 表达增强乳腺癌对化疗药物阿霉素的敏感性[11]。可见,miR-145 与多种肿瘤的发生发展密切相关,其有望成为肿瘤治疗的潜在靶点。二甲双胍是常用的降糖药,同时其还对多种肿瘤表现出较好的抗肿瘤作用。例如,二甲双胍通过降低H3K27 三甲基化抑制卵巢癌细胞的增殖和迁移,促进癌细胞凋亡[12];同时,二甲双胍还可以通过调控miRNAs 表达参与抑制胰腺癌细胞增殖[13]。已有学者指出,miR-145 在胃癌组织和患者外周血中低表达,参与肿瘤细胞的恶性增殖、凋亡和转移过程[4,6];二甲双胍能够抑制胃癌的生长[14-15]。本研究结果与王钟林[8]等所得出的miR-145 联合二甲双胍具有协同抑制结肠癌HTC116 细胞增殖的结果相吻合,同时也与朱明霞等[16]研究指出的上调miR-145 表达可增强顺铂诱导胃癌细胞凋亡机制相吻合。这提示,上调miR-145 表达和二甲双胍联合具有协调抑制胃癌细胞生长的作用。
CyclinD1 是细胞周期G1 期进入S 期的正向调控因子,也是一种重要的原癌基因,其过度表达可引起细胞增殖失控,促进肿瘤的发生;Bcl-2 是公认的细胞凋亡抑制因子,可通过介导多种信号通路参与细胞的凋亡过程;AKT 是PI3K/AKT 信号通路的关键分子,p-AKT 是AKT 的活化状态,活化的AKT 可调控下游相关基因如CyclinD1、Bcl-2 的表达抑制细胞增殖和促进细胞凋亡,参与肿瘤的发生发展;CyclinD1、Bcl-2 和p-AKT 均在胃癌的发生发展过程中发挥着重要作用[17]。本研究结果发现,二甲双胍单独或与miR-145 mimics 联合均能够降低胃癌BGC823 细胞中CyclinD1、Bcl-2和p-AKT 蛋白的表达水平,且二甲双胍联合miR-145 mimics 的作用明显大于二甲双胍单独作用。已研究证实,在胶质母细胞瘤中miR-145 的丢失可导致细胞增殖分子Cyclin D1 表达过多[18];结果提示,miR-145 可通过抑制AKT 信号通路的活化增强二甲双胍抗胃癌的作用。
总之,二甲双胍联合miR-145 具有更强的抗胃癌作用,其可能通过抑制AKT 信号通路协调抑制胃癌细胞增殖并诱导细胞凋亡。本研究仅从体外细胞水平上阐述了二甲双胍联合miR-145抗胃癌的作用,后续还需从体内动物实验加以验证。
