甘草甜素通过调控COX-2/NF-kB通路治疗牙周炎的研究
2021-11-03张娜侯鑫张文时伯红
张娜 侯鑫 张文 时伯红
牙周炎是导致牙齿缺失的主要因素,其特征表现为牙周组织的炎性破坏[1-3]。牙龈卟啉单胞菌(Porphyromonas gingivalis,P.g)是导致牙周炎的主要病原体[4],其内毒素脂多糖(lipopolysaccharide,LPS)是主要的毒力因子,可诱导人牙龈成纤维细胞NF-κB 活化和炎症介质释放白细胞介素6(Interleukin 6,IL-6)和白细胞介素8(Interleukin 8,IL-8)等炎性细胞因子,诱导牙周组织损伤[5]。环氧化酶-2(Cyclooxygenase-2,COX-2)作为将花生四烯酸转化为前列腺素(Prostaglandin E2,PGE2)的关键酶,能诱导生成大量的PGs,在炎症反应中发挥重要作用[6]。而抑制COX-2 的表达可减少骨吸收[7]表明COX-2 在牙周损伤中发挥重要作用。甘草甜素是从甘草中分离出来三萜类成分,又称甘草酸,通过分解为甘草次酸及葡萄糖醛酸发挥作用,主要表现为抗炎、抗变态反应和免疫调节。其中抗炎是甘草酸类最主要的药理作用[8-9]。本实验拟通过检测甘草甜素对LPS 刺激的人牙龈成纤维细胞(HGFs)的抗炎作用及其分子机制,探讨其在牙周炎治疗中的作用。
1 资料与方法
1.1 一般资料
取于2017年1月至2月山东大学口腔医院就诊需拔除埋伏阻生齿的健康志愿者6 名(16~20岁,3 名男性和3 名女性;平均年龄18 岁),收集其术中切除的少量牙龈组织,研究经志愿者知情同意,本实验经院伦理委员会批准同意。
1.2 试剂与仪器
甘草甜素(纯度>98%)(国家药品和生物制品控制研究所),牙龈卟啉单胞菌脂多糖(San Diego公司,美国),牙龈卟啉单胞菌脂多糖(Invitrogen公司,美国),细胞增殖试剂盒(MTT)(上海罗氏制药有限公司),IL-6 ELISA 试剂盒(eBioscience公司,美国),COX-2,β-actin,p-p65 等蛋白一抗抗体(Cell Signaling Technology 公司,美国)。
1.3 方法
1.3.1 人牙龈成纤维细胞的分离培养及细胞活性的测定
将牙龈组织块放入预先准备好装有DMEM 培养基(含10%胎牛血清)的无菌瓶中。通过组织块法培养的人牙龈成纤维细胞,经传代、分离、纯化至第四代,得到纯度高、活性好的HGFs。将牙龈成纤维细胞与不同浓度梯度的甘草甜素剂量为30、60、120、240 μg/mL,共培养48 h,次日镜下观察可见细胞已经贴壁。按实验分组依次添加2×甘草甜素100 μL、2×牙龈卟啉单胞菌脂多糖100 μL。轻轻摇晃96 孔细胞培养板,使培养基混合巧匀,放入细胞培养箱;共培养后48 h 后取出,吸尽每孔内的培养基,加入MTT 溶液,每孔30 μL,再次放入细胞培养箱中解育4 h;将DMSO 中溶液注入到孔板中,每孔150 μL,放入细胞培养箱中孵育过夜;次日,取出96孔细胞培养板,肉眼观察可见紫色甲瓒晶体已完全溶解。用酶标仪测定波长570 nm 处的吸亮度值。
1.3.2 酶联免疫吸附试验(ELISA)检测培养基中细胞因子IL-6 和IL-8
实验分为对照组、LPS 组及低中高三个干预组。对照组由400 μL1%胎牛血清混合培养基构成,脂多糖对照组由200 μL 2×脂多糖+200 μL1%胎牛血清混合培养基构成,干预组则由200 μL 不同浓度2×甘草甜素+200 μL 2×脂多糖构成。细胞贴壁后,吸去孔板中的细胞培养基,用微量移液器往实验组培养孔中注入2×甘草甜素,200 μL/孔。再往空白对照组、脂多糖对照组及药物对照组中添加1%胎牛血清混合培养基,其中空白对照组400 μL/孔,脂多糖对照组200 μL/孔。盖上培养板的盖子,标记时间,放入细胞培养箱中培养,并开始计时;22 h 后,取出细胞培养板,用微量移液器将每孔中的上清液转移至Eppendorf 管,并在管身标记组别以示区分。采用ELISA 检测培养基中细胞因子IL-6和IL-8的产生。
1.3.3 蛋白免疫印记实验(Westernblot)检测各组COX-2 和NF-κB 蛋白水平
①裂解细胞,提取总蛋白:取出细胞培养板,胰酶消化细胞,4℃,离心,500 r/m×3 min,收集细胞,每孔细胞加400 μL 的细胞裂解混合液,于冰上裂解30 min,每5 min 来回摇动培养板一次。细胞裂解完毕后,移至1.5 mL 的EP 管中。于4℃,12 000 rpm 离心5 min。将离心后的上清液分装转移到0.5 mL 的EP 管中放于-20℃保存。②提取核蛋白:用冷PBS 洗涤细胞两遍,转移至预冷的1.5 mL 的EP 管中。4℃,500 prm 离心3 min。弃上清液,加入5 倍体积的预冷的Buffer A,最大转速涡旋剧烈振荡30 s,放置冰上15 min;加入上液体1/20 体积的Buffer B,剧烈祸旋振荡10 s,冰浴1 min,4℃,16 000 prm,离心5 min,沉淀即是核蛋白粗提物;在沉淀中加入预冷的Buffer 最大转速涡旋剧烈振荡15 s,放置冰上40 min,每间隔10 min 涡旋剧烈振荡15 s;4℃,16 000 prm 离心10 min,将上清液转移至新的EP 管中,即得细胞核蛋白产物;上述提取的蛋白进行蛋白定量(BCA 法),分装并保存于-80℃。③蛋白变性:将提取的细胞蛋白与蛋白上样Buffer按1∶1 比例充分混匀后,在100℃加热5 min 使蛋白变性。④蛋白表达检测:采用Westernblot 检测各组COX-2 和NF-κB 蛋白水平。
1.4 统计学方法
采用SAS 9.4 软件进行数据处理;计数资料采用()描述,两组间采用t检验;多组间采用方差分析,对于细胞活性、IL-6 及各组蛋白的表达等均数的多重比较采用SNK(Student-Newman-Keuls)检验,P<0.05 为差异有统计学意义。
2 结果
2.1 不同浓度甘草酸对人牙龈成纤维细胞活性的影响
剂量为30、60、120 μg/mL的甘草甜素对HGFs的细胞活力无明显影响,差异无统计学意义(P>0.05)。剂量为240 μg/mL的甘草甜素明显抑制了HGFs的细胞活力,差异有统计学意义(P<0.05)。见图1。
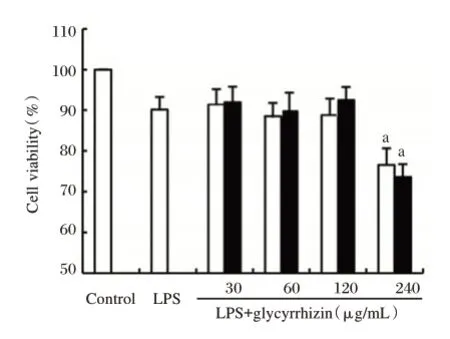
图1 不同浓度甘草酸对人牙龈成纤维细胞活性的影响Figure 1 Effects of different doses of glycyrrhizic acid on the activity of human gingival fibroblasts
2.2 甘草酸对LPS诱导的IL-6和IL-8产物的抑制作用
与对照组相比,LPS 组IL-6 和IL-8 的浓度显著増高,差异有统计学意义(P<0.05)。与LPS 组相比,干预组的IL-6 和IL-8 表达水平随着甘草甜素的浓度的增加显著降低,差异有统计学意义(P<0.05)。见表1。
表1 甘草酸对LPS 诱导的IL-8 和IL-6 的抑制作用(±s)Table 1 Inhibitory effect of glycyrrhizic acid on IL-8 and IL-6 induced by LPS(±s)

表1 甘草酸对LPS 诱导的IL-8 和IL-6 的抑制作用(±s)Table 1 Inhibitory effect of glycyrrhizic acid on IL-8 and IL-6 induced by LPS(±s)
注:与对照组相比,aP<0.05;与LPS 处理组相比,bP<0.05;与低剂量干预组相比,cP<0.05;与中剂量干预组相比,dP<0.05。
组别对照组LPS 处理组低剂量干预组中剂量干预组高剂量干预组F 值P 值IL-6(ng/mL)0.06 ± 0.01 0.73 ± 0.11a 0.54 ± 0.09ab 0.33 ± 0.05abc 0.12 ±0.03bcd 472.32<0.001 IL-8(ng/mL)0.05 ± 0.01 0.69 ± 0.09a 0.42 ± 0.07ab 0.27 ± 0.05abc 0.13 ± 0.04abcd 543.53<0.001
2.3 甘草甜素对COX-2/NF-κB 表达的影响
与对照组相比,LPS 组的COX-2 蛋白表达明显上调,差异有统计学意义(P<0.05);与LPS 组相比,干预组的COX-2 蛋白表达水平明显降低,差异有统计学意义(P<0.05)。见图2。
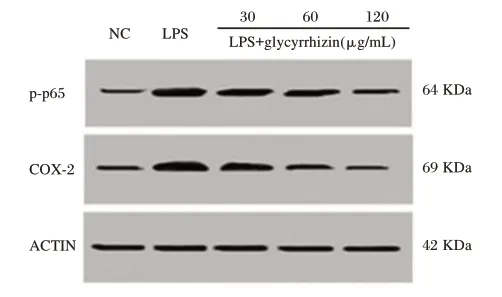
图2 甘草甜素对COX-2/NF-κB 表达的影响Figure 2 The Effect of glycyrrhizin on COX-2/NF-κB expression
3 讨论
牙周炎是一类由附着于牙面的牙菌斑中的微生物所引起的牙周组织的慢性炎症,临床表现为牙周支持组织的炎症、牙周袋形成、附着丧失和牙槽骨的吸收破坏,最终导致牙齿的松动、脱落,对患者口腔功能和生活质量造成了严重的影响[1-4]。牙龈卟啉单胞菌是其主要致病菌,其LPS 可诱导人牙龈成纤维细胞炎症介质释放[4]。说明牙龈卟啉单胞菌脂多糖能成功诱导人牙周膜细胞分泌IL-6 和IL-8 介导牙周炎症反应。这些炎症介质中白细胞介素6(IL-6)和白细胞介8(IL-8)等炎性细胞因子在疾病发生发展过程中起到了重要的病理作用[10-14],具有诱导牙周组织损伤的能力。IL-6 参与牙周炎活动期的炎症和免疫反应,通过诱导破骨细胞的生成、聚集以及破骨活性的发挥,从而加剧牙周组织的破坏。本研究结果与以往发现一致,LPS 能够显著增强人成纤维细胞IL-6 及IL-8 的表达。
目前临床常用的抗菌药物中以防腐剂和抗生素缓释剂占主导,如氯己定漱口水和派力奥(盐酸米诺环素软膏),这些药物的长期、大量使用易诱发过敏和毒副作用的产生,国际上对抗生素的应用亦持谨慎态度,因此寻找一种安全有效、无毒副作用的治疗方式对与维护患者的机体健康和提高生活质量具有重要的临床意义[15-16]。甘草甜素是从甘草中分离出来三萜类成分,又称甘草酸,可水解产生两分子葡萄糖醛酸和一分子(18β2)甘草次酸,主要作用为抗炎、抗变态反应,免疫调节。本实验采用甘草甜素治疗,发现其抗炎作用呈现剂量依赖性,随着剂量增强能显著抑制IL-6、IL-8 的表达[17]。
COX-2 在牙周损伤中发挥重要作用[6-7]。本研究发现LPS 能显著增加COX-2 的蛋白表达。甘草甜素治疗能显著抑制COX-2 的表达,而且随甘草甜素浓度的增高,COX-2 表达水平降低。LPS 能诱导NF-κB p65 的磷酸化,甘草甜素的治疗显著抑制LPS 诱导的NF-κB p65 磷酸化,且呈剂量依赖性。核转录因子-κB(nuclear factor kappa B,NF-κB)是细胞核内重要的核转录因子,在细胞刺激介导的细胞信息转录调控中起关键作用。NF-κB 在细胞中主要以p50/p65 二聚体形式存在,其中p65 亚基含有转录激活结构域。NF-κB 介导的信号通路参与体内多种反应过程,被认为是经典的炎症相关信号通路[18-19]。本研究发现LPS 能显著增加P65 的蛋白表达。而甘草甜素治疗能显著抑制P65 的表达。
目前国内尚无特异性针对牙周致病菌治疗和预防牙周病的药物,本研究以甘草甜素牙周局部给药的方式改善牙周病变部位的微环境,达到控制牙周炎症的效果。但由于口腔的微生物环境复杂,牙周病的感染往往是多种细菌的协同混合感染,并涉及局部和全身的诸多易感因素,本实验模拟了牙周主要致病菌之一牙龈卟啉单胞菌的感染情况,实验条件相对单尚不能完全模拟人体牙周炎的感染环境,且标准菌株与临床患者口腔中分离的野生菌株在致病能力上仍有一定差异,因此甘草甜素应用于牙周病患者口腔内的抗菌效果还有待进一步深入研究。
