基于5个PI3K通路相关基因构建肺腺癌预后预测模型
2021-11-03于丽华王宏秦丽王伟娜崔东燕赵书平
于丽华 王宏 秦丽 王伟娜 崔东燕 赵书平★
中国人群的肺癌发病率以及死亡率也呈逐年升高的趋势,肺腺癌(Lung adenocarcinoma,LUAD)在我国最为常见[1]。早期LUAD 患者尚有手术机会,而晚期患者,往往只能采用靶向治疗、放化疗、免疫治疗等以延长生存时间[2]。尽管如此,远处转移和耐药问题依旧是患者不良预后的主要原因[3]。所以,进一步寻找可用于预测LUAD 患者的预后和死亡风险的肿瘤标志物,仍然是目前首要任务。磷酸肌醇3-激酶(Phosphoinositide 3-kinase,PI3K)信号下游包含多条信号通路,参与调节各类细胞生理过程。此外,众多研究发现PI3K 通路在肿瘤的发生发展中也发挥着重要的作用[4]。例如,Heavey 等人发现非小细胞肺癌的侵袭和转移与PI3K/蛋白激酶B(Protein kinase B,Akt)/哺乳动物雷帕霉素靶蛋白(Mammalian target of rapamycin,mTOR)通路的异常激活与密切相关[5]。虽然PI3K 通路被证明与肿瘤相关,但可否采用PI3K 下游基因构建预后预测模型,用于肿瘤复发预测仍是盲点。本研究通过分析公共数据库表达谱数据,利用单因素和多因素Cox 回归分析构建了一项基于PI3K 通路相关基因的预后预测模型。
1 材料与方法
1.1 数据来源
通过系统检索PI3K 通路下游基因列表,并从The Cancer Genome Atlas(TCGA)数据库中提取相应基因的表达谱数据(数据下载于2020年10月1日),及相应患者的临床信息[主要包括总体生存率(Overall survival,OS)、生存状态(Survival status)、年龄(Age)、性别(Gender)、肿瘤分期(Tumor stage,T 分期)等,共包括497 例LUAD 病例和54 例对照。
1.2 筛选差异表达基因和基因富集
应用R 统计软件中的“limma”软件包对数据进行差异分析,与PI3K 通路下游基因列表取交集,以log2FoldChange≥2 或≤-2,校正P-value <0.05 为条件,同时对差异基因进行富集分析。
1.3 构建预后预测模型
研究首先采用单因素Cox 回归分析关联差异表达的PI3K 通路基因与OS,并提取多因素Cox 回归分析中各基因的系数用于预后模型的构建,公式=(0.189 042 561×F2RL1 表达值)+(0.159 601 144×TWIST 表达值)-(0.289 521 135×FGR 的表达值)-(0.223 936 656×KLF4 表达值)+(0.250 520 925×CEP55 表达值),基于中位风险值,将患者分为高、低风险两个亚组。
1.4 统计学分析
计数资料以n(%)表示,行χ2检验;利用Kaplan-Meier(K-M)和log-rank 分析检验模型中高、低危组的生存状态差异;绘制受试者工作特征(ROC)曲线,计算曲线下面积(AUC),检验模型准确性;采用多因素Cox 回归分析探究该模型预测LUAD 患者预后是否受其他因素影响。以P<0.05为差异有统计学意义。
2 结果
2.1 筛选差异表达的PI3K 通路相关基因
分析共纳入出154 个PI3K 通路相关基因,分析共筛选出34 个差异表达的PI3K 通路基因。对获取的差异基因进行富集分析,结果显示这些基因多富集于PI3K 等信号通路。见表1、图1。
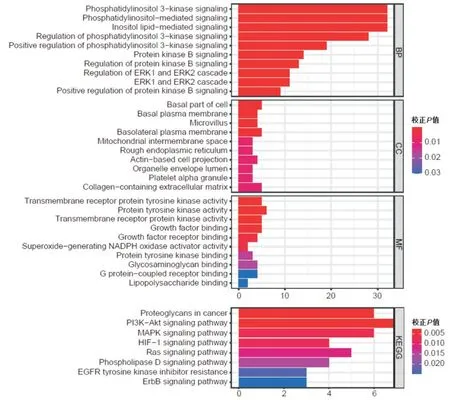
图1 差异表达基因的富集分析Figure 1 The enrichment analyses of the differentially expressed genes
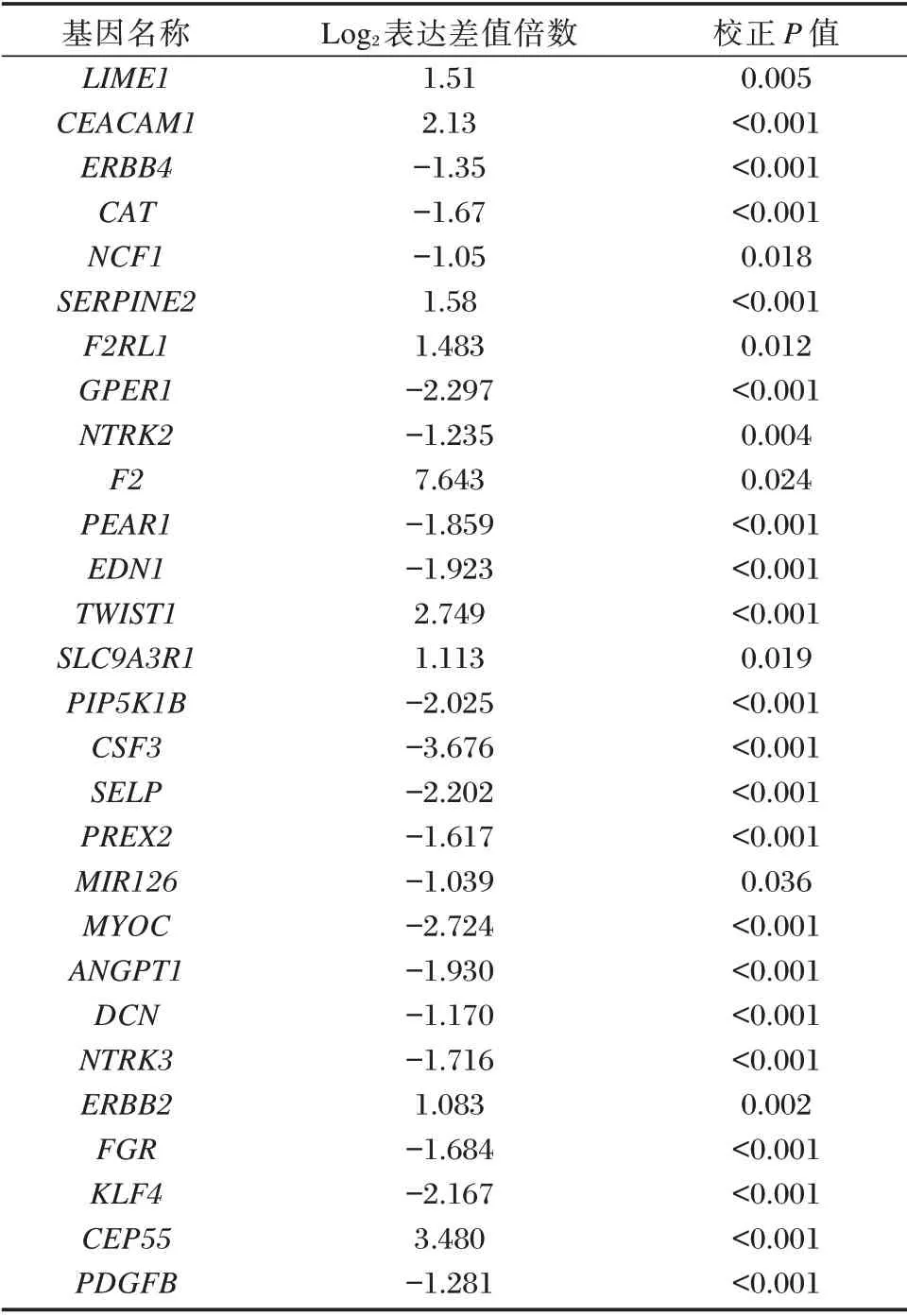
表1 差异表达PI3K 通路相关基因Table 1 The differentially expressed PI3K pathway-related genes
2.2 基于差异表达的PI3K 通路相关基因构建预测模型
将有配对临床资料的LUAD 样本与差异表达基因相结合,剔除表达量较低或对结果影响较大的样本,最终纳入436 例患者表达谱数据进一步行单因素Cox 回归分析,结果显示有11 个基因与OS 相关,差异有统计学意义(P<0.05)。将11 个基因纳入多因素Cox 回归分析,筛选出5 个基因用于建模(F2RL1、TWIST、FGR、KLF4 和CEP55),差异有统计学意义(P<0.05)。其中,KLF4、CEP55、F2RL1和TWIST为高风险基因,FGR为保护性基因。见图2、表2。
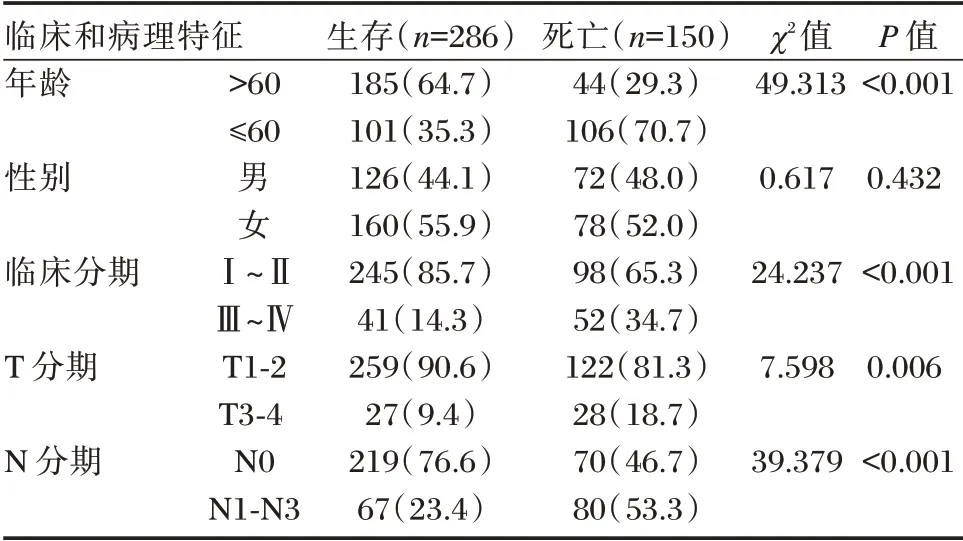
表2 436 例LUAD 患者的临床病理特征[n(%)]Table 2 The clinicopathological features of the enrolled 436 LUAD cases[n(%)]
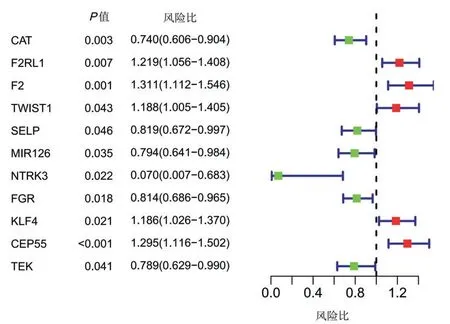
图2 单因素Cox 回归分析结果Figure 2 The results of univariate Cox regression analysis
2.3 评估预测模型的有效性
患者中位风险评分为0.963 667,以此为依据将患者分为低风险(218 人)和高风险组(218 人)。结果显示,患者生存时间随着风险评分升高逐渐缩短(图3A),且死亡人数(图3B)则呈上升趋势;图3C 可见模型中KLF4、CEP55、F2RL1和TWIST的表达在高危组患者中明显增高,FGR的表达在低危组患者中明显增高;K-M 分析结果显示,风险评分与患者不良预后呈显著正相关(图3D);ROC曲线分析结果发现预测模型的预测价值最高(图3E,AUC=0.735)。见图3。
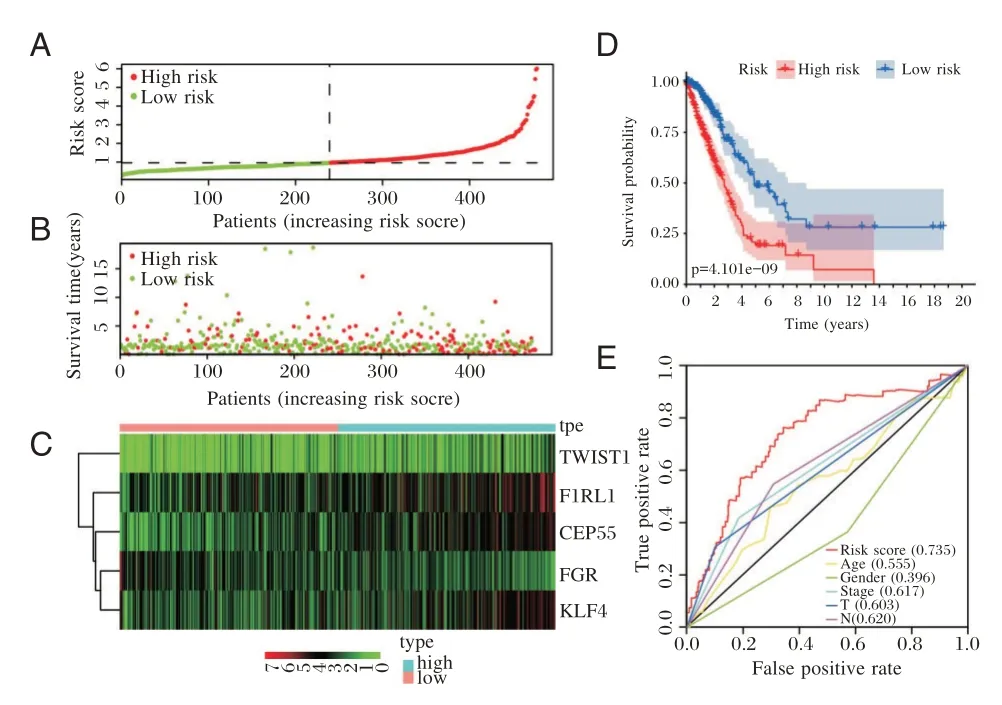
图3 建模基因分布与模型准确性评估Figure 3 Modeling gene distribution and evaluation of model accuracy
2.4 模型可作为LUAD 患者独立预后因子
单因素Cox 回归分析表明LUAD 患者的T 分期、N 分期、临床分期、风险评分与OS 相关(P<0.05);多因素Cox 回归分析表明预测模型可作为患者OS 评估的独立预测因子(P<0.05);T 分期、N 分期对患者预后的预测是独立的(P<0.05)。见表3、表4。
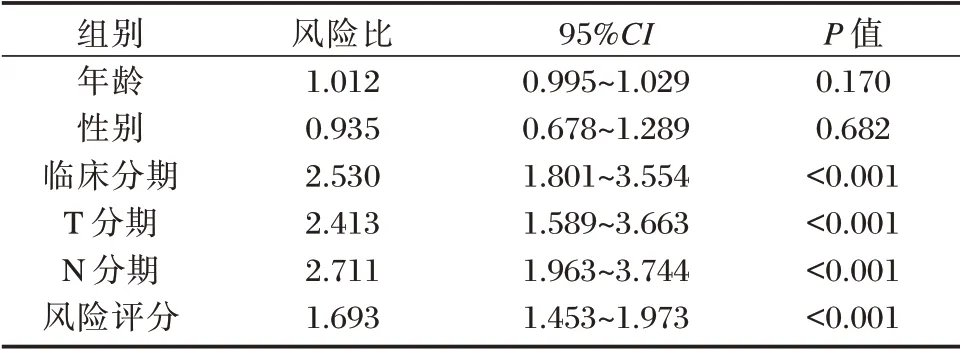
表3 单因素Cox 回归分析Table 3 Cox regression analyses of univariate
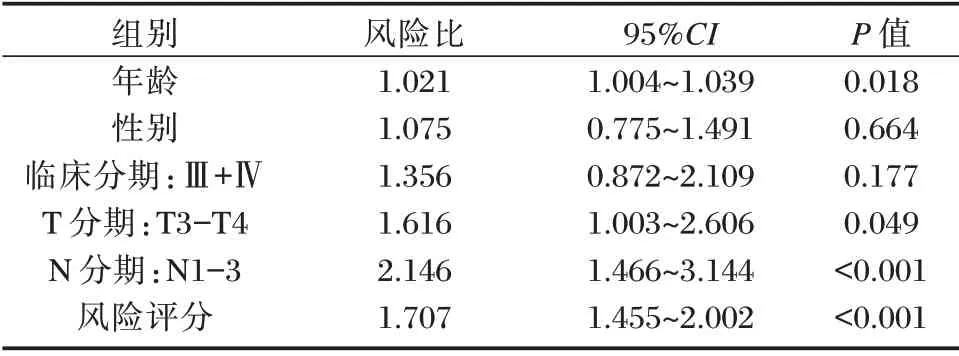
表4 多因素Cox 回归分析Table 4 Multivariate Cox regression analysis
2.5 预测模型与临床病理特征的关系
使用R 软件的“beeswarm”分析参与模型构建的基因与临床病理特征之间的关系,结果显示,CEP55与患者年龄(P=0.006)、生存状态(P=0.005)、性别(P=0.007)、N 分期(P=4.128e-04)、stage 显著相关(P=0.003),F2RL1 与患者年龄(P=0.005)、生存状态(P=0.018)显著相关,FGR 与患者生存状态(P=0.006)、T 分期(P=0.021)、stage(P=0.038)显著相关,见图4。
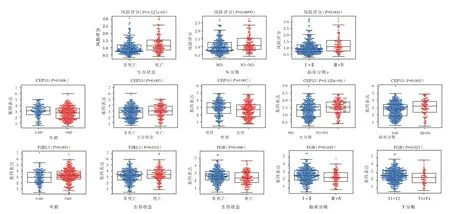
图4 建模基因与临床参数的关系Figure 4 The correlation between modeling genes and clinicopathological factors
3 讨论
近年来,大量研究证实LUAD 的发生和进展与PI3K 信号通路密切相关,但有关该通路基因是否可作为LUAD 患者预后评估标志物的研究尚处于初步阶段。本研究分析了PI3K 通路基因与LUAD 患者预后的关系,筛选出了能够独立预测LUAD 患者预后的关键基因,并以此为依据构建了预后预测模型,系列分析证实了该预测模型的预测能力。同时,多因素Cox 回归分析揭示该模型对LUAD 患者的预后评估作用不受其它临床病理参数的干扰。
当前模型共纳入5 个PI3K 通路相关基因。F2RL1基因位于5 号染色体上,其编码蛋白PAR2是一种G 蛋白偶联受体,可以启动多种细胞内信号转导。在慢性粒细胞白血病中,PAR2 的高表达预示着患者预后不良。研究发现,PAR2 可上调BclL12 表达,而Bcl2L12 可通过抑制Mdm2 与p53蛋白启动子结合,抑制p53 的转录活性,减少肺癌细胞凋亡进程[6]。研究还发现,F2RL1 与吉非替尼耐药密切相关。抑制PAR2 表达,可以阻断ERK通路磷酸化及上皮-间质转化,上调吉非替尼治疗敏感性[7]。TWIST 最早在果蝇中被发现调节胚胎中胚层分化和肌细胞形成,现在更多关注的是其在上皮间充质转化和肿瘤侵袭中的作用。研究发现,Twist 在肺癌组织中较癌旁组织显著高表达,且Twist 表达与肺肿瘤的分化程度密切有关。肺腺癌细胞系高表达Twist 后,上皮细胞呈梭形、纺锤体改变;此外,高表达该基因的肺腺癌细胞侵袭和迁移能力显著增强,但增殖能力相对减弱[8]。不仅如此,过表达TWIST 可抑制E-钙蛋白和β-连环蛋白的表达,同时增强AKT2 蛋白活性,促进肿瘤的侵袭和转移[9]。KLF4基因含有KLF 超家族的锌指蛋白结构,参与真核细胞转录调控作用。据报道,KLF4基因在乳腺癌中高表达可促进肿瘤增殖[10],但却在胃癌、前列腺癌等肿瘤中起到抑瘤作用[11]。研究还发现KLF4 在肺癌组织中较癌旁组织表达降低,过表达KLF4 能够显著抑制肺癌细胞增殖,引起细胞G1 期阻滞;机制研究发现,KLF4可通过激活p21 和抑制cyclin D1 表达来抑制肿瘤进展,同时其还与Sp1 竞争结合cyclin D1,进而抑制cyclin D1 表达,发挥肿瘤抑制作用[12]。CEP55位于染色体10q23.33 内,是一个55 kDa 的中心体蛋白,在大多数肿瘤中可检测到CEP55 的异常高表达。Jiang 等人[13]发现CEP55 在非小细胞肺癌肿瘤组织中表达显著上调,且与患者预后不良显著相关。Liu 等人[14]也发现,沉默CEP55 表达可显著抑制肺癌细胞增殖和促进肿瘤细胞凋亡;沉默CEP55 可显著降低肺癌细胞中CDK4、p21 和Bcl-2表达,上调凋亡前蛋白、Bad、caspase-3 和PARP 的表达,这提示CEP55 可作为肺癌治疗的潜在作用靶点。综上,这些结果更加提示了这些预后相关基因在肺癌发生和进展过程中的关键作用。
综上,本研究通过系统分析构建了一项由5 个PI3K 通路基因组成的LUAD 患者预后预测模型。经过分析与验证,充分说明该预后模型预测效率以及准确率较高,能够有效指导患者预后的预测,协助制定更为精准的治疗方案。
