马铃薯卷叶病毒RT-LAMP检测方法的建立研究
2021-11-03甘肃省定西市农产品质量安全监测检测站康明蛟
甘肃省定西市农产品质量安全监测检测站 康明蛟
马铃薯作为平时人们经常食用的食物,其质量和健康问题非常重要,而病毒会导致其自身性质退化。马铃暮卷叶病毒可简称为PLRV,对马铃薯来说,PLRV是影响其自身品质的一种病毒,且影响极大,相关部门和专家学者在马铃薯研究方面一直以来都比较关注该病毒的检测方式和相关对策,其目的就是能够为马铃薯产业发展提供保障,并为人们提供品质良好的马铃薯。PLRV检测的方法有很多,其中常见的就有ELISA、RT-PCR、多重RT-PCR以及本次重点探究的RT-LAMP等等[1]。本文将以建立PLRV的RT-LAMP检测方法为基准,对其相关事项展开深入分析,进而能够为马铃薯品质的保障提供合理化的科学依据[2]。
1 材料与方法
1.1 材料
此次实验将会应用到PLRV、马铃薯A病毒、马铃薯M病毒、马铃薯X病毒、马铃薯Y病毒以及马铃薯S病毒,这些样品都属于阳性,而阴性样品则是以马铃薯脱毒种薯病毒检测和安全评价工程技术研究中心实验室保留的一种离体组培苗和马铃薯卷叶症状的植株叶片。
除此之外,还选择了植物RNA提取试剂盒,RNA酶抑制剂和M—MLV反转录酶、重组Taq DNA聚合酶、UNG酶、dNTPMix、Bst3.0DNAPolymerase、甜菜碱(Betaine)、焦炭酸二乙酯、GeneFinderTM、硝基四氮唑蓝、DAS—EUSA试剂盒购等材料。
1.2 方法
1.2.1 病毒RNA提取
根据植物RNA提取试剂盒操作的方法来提取病毒RNA,并测定抽提病毒RNA的浓度,随后要在80℃的环境下进行保管,以便后续使用。采取病毒粒子吸附法来分离病毒RNA。
1.2.2 引物设计和合成
这项操作是按照Gen Bank提出的PLRVCP基因序列AY307123.1,且依照保守区域ORF3为靶标基因,通过使用PrimerExplorer4.O软件来将6个位点设计多组RT-LAMP引物,且将Ju和Ahmadi采用的2组引物融入其中,再通过反复筛选,最终选择适合扩增效率高的Pb组引物,可见表1,以此应用在RT—LAMP检测当中。而RT—PCR检测方法则引用SN/T2627—2010∽1的引物序列,详情可见表2,本次实验的引物均由生物工程北京股份有限公司合成提供[3]。
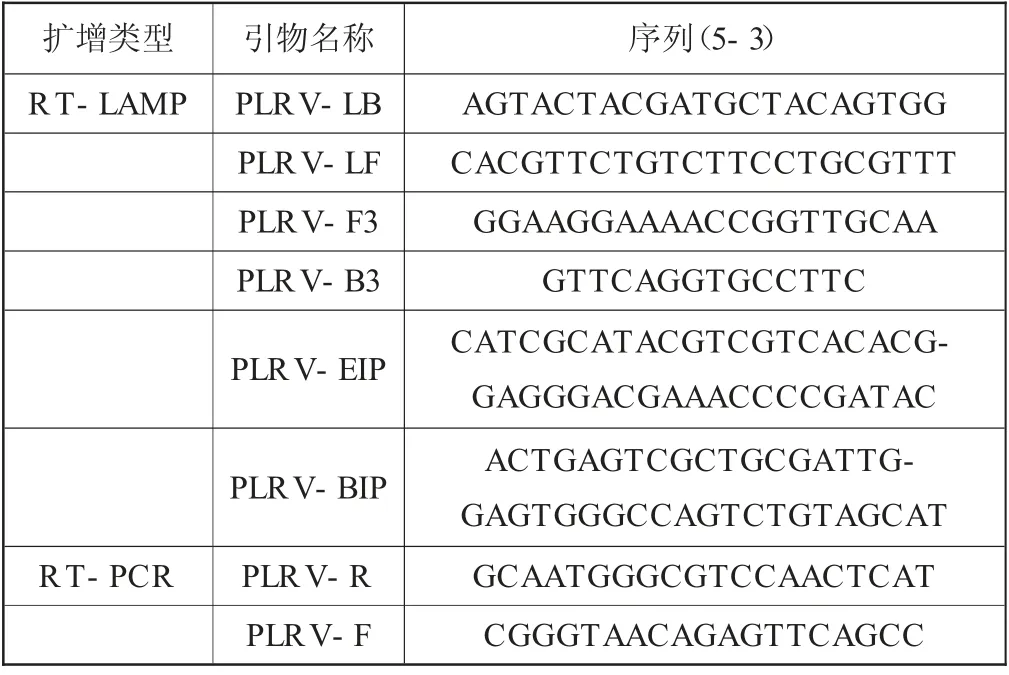
表1 马铃薯卷叶病毒RT-LAMP检测引物

表2:马铃薯卷叶病毒RT-LAMP检测引物
1.2.3 RT—LAMP反应体系
以报道过的RT-LAMP反应条件确定初步反应体系,并根据单因素试验,来选择引物组和引物比,并严格把控其浓度、反应温度以及反应时间,且还需考虑到Mg、Betaine、Bst3.ODNA聚合酶、uNG、s YBR GreenI浓度多因素来形成反应体系。
1.2.4 特异性验证
对于马铃薯生长发育来说,PLRV、PVM、PVX、PVY、PVS以及PVA都是其在培育过程中极易出现的病毒,且并发率极高,由此可见,培育马铃薯的技术型要求较高,不仅要考虑土壤因素,在培育技术方面也要考虑到其各种病毒的病发率,而RT—LAMP检测法所建起的反应体系,在这几种病毒中都能够适用,特别是其阳性样品,检测结果更加准确[3]。在检测之后可将RT—LAMP扩增产物通过2%琼脂糖凝胶电泳进行研究,且将扩增产物加入1L1000×SYBR GreenI,振荡摇匀,就能够看到其反应结果[4]。
1.3 实验仪器
此次实验除了上述材料和方法以外,还会用到以下几个实验器材:①VORTEX-GENIE2/2T漩涡混匀仪②iCEN-24台式高速离心机③君意-JY600C电泳仪④Tanon-3500R琼脂凝胶成像系统和笔式紫外灯。
2 结果
2.1 RT-LAMP体系的建立
关于RT-LAMP方法的建立,首先要通过构建RT-LAMP反应体系扩增PLRV,以此来形成LAMP产物特殊阶梯状条带,且空白对照与阴性对照不会形成条带,经过实验研究发现RT-LAMP检测结果和RT—PCR一致。但RT—LAMP反应产物若加入浓度较高的(1000×)SYBR GreenI,则其样品的颜色会发生变化,阳性为绿色,阴性则为褐色。若是加入浓度较低的(50×)SYBR GreenI,就要在紫外灯的帮助下来进行观察,通常来说,这样会使阳性颜色变为荧光色,而阴性则不具备发出荧光色的特性。所以,RT-LAMP体系的建立,可通过以上两种方式来确定。
2.2 特异性验证
探究RT-LAMP检测方法建立时,通过特异性验证能够看出在PLRv阳性对照下,PLRV的感染样品在RT-LAMP的加持下,显示为阳性,而阴性对照与没有感染的PLRv样品则表现为阴性,从这点就能够看出RT-LAMP检测方法和其他马铃薯病毒间不存在交叉性,其表现只是以特异性扩增PLRV为主[5]。
3 讨论
在引物筛选方面,一定要选择相符的引物来都构建RT-LAMP反应体系,这是其应用的关键所在,若是反应体系不够稳定,或是无法建立,也就不能充分发挥这种检测方法的作用和效能。在实验过程中,当出现引物扩增不稳定的情况时,很有可能是由于引物识别、匹配以及定位方面不够精确,存在一定的限制,进而影响到整个RT-LAMP反应体系的稳定性,但从此次实验研究中发现,存在另一种原因,那就是由于环引物加速方面的缺失,从而使得扩增效率降低所致。因此,要想加强RT-LAMP反应体系的稳定性,使其在实际应用中能够更加快速地获取精准的检测结果,最好是以PLRVCP基因保守序列0RF3为主,这样能够对不同区域进行引物,进而加强引物扩增率。
此次研究考虑到RT-LAMP检测方法自身的特点和优势,通过深入探究其反应体系,进而简化该项技术的相关程序,以此来提升其应用的高效性和便捷性,且在其成本较低、灵活度较高的特性加持下,能够更加快速、直接且高效地对马铃薯卷叶病毒进行检测。由此也能够看出,要想使这种方法应用到实际当中,使其作用得到体现,其反应体系的建立十分重要,特别要重视反应体系的稳定性,这样才能够使检测效果的准确性得到提升,以此来为马铃薯产品的品质提供保障。因此,关于这种检测方法的应用及建立,可通过与其他检测方法对比,并探究其扩增产物的效率,进而体现出其体系的稳定性。实验结果判别的方式也比较简单,在浓度较高的SYBE GreenI加持下,通过观察颜色变化就能够得出相应的结论,但此次研究考虑到成本费用方面的因素,主要是以浓度较低的SYBE GreenI为主,并通过应用紫外灯来确保实验结果的准确性。
4 结论
总的来说,此次研究通过对马铃薯卷叶病毒RT-LAMP检测方法建立进行研究,能够看出这种方法应用效果良好,且其特点和优势都较为明显,在实际操作当中,不仅简便,且其检测时效较强,灵活度高,同时,还具备低成本、高成效的特点,是一项技术性较强的检测方法,这种方法的应用能够更好地检测马铃薯是否带有病毒,以此来保证马铃薯的品质,为该产业和相关行业的发展提供了保障,值得大力推行。在实际工作当中,相关部门和专家学者们还应对其不断进行研究,以此来推动RT-LAMP检测方法实现长期稳定的发展,进一步证实其应用的效果,使其能够得到更加广泛的应用[6]。
