吡蚜酮和毒死蜱在稻田中的残留行为及膳食风险评估
2021-11-02张春荣孔丽萍吴园园宣彩迪许振岚
郭 钤,张春荣,孔丽萍,吴园园,宣彩迪,林 琴,许振岚,汤 涛
(浙江省农业科学院农产品质量安全与营养研究所/农产品质量安全危害因子与风险防控国家重点实验室/农业农村部农药残留检测重点实验室,杭州310021)
吡蚜酮是瑞士诺华公司于1988年开发的防治蚜虫和粉虱的新型杂环类杀虫剂,其制剂在我国被广泛应用于水稻、棉花、蔬菜、果树等多种作物的害虫防治。其作用方式独特,主要影响昆虫进食行为,使昆虫拒食而死。该药在稻田使用时,其对水稻褐飞虱不仅具有触杀作用,还具有一定的内吸作用[1-2]。吡蚜酮的使用也可能对食品安全、生态环境以及人类健康构成潜在风险[3]。已有研究结果表明,一定剂量的吡蚜酮可导致动物体重增长缓慢,肝、肾和脾等和体重的比值增高,血液红细胞数目下降[4],对大鼠具有发育毒性,也可能存在潜在的内分泌干扰效应,并引起小鼠和大鼠的肝脏肿瘤[5]。毒死蜱作为一种高效、广谱的有机磷类杀虫剂,由美国陶氏化学公司于1965年研发成功,其具有良好的触杀、胃毒和熏蒸作用,常用于水稻、小麦、棉花、果树、蔬菜、茶树等多种作物的病虫害防治,尤其是防治褐飞虱的理想药剂[6-7]。毒死蜱能够抑制乙酰胆碱酯酶,改变微生物群落结构和代谢反应,同时对蜜蜂、家蚕、鱼类、鸟类、赤眼蜂为高毒[8-9]。美国加州农药监管机构将毒死蜱列为“有毒空气污染物”并限制其使用,我国于2016年底开始禁止毒死蜱在蔬菜上使用[6]。
吡蚜酮和毒死蜱在水稻上复配使用,不但能提高防治褐飞虱的效果,同时也能延缓抗药性的产生。目前,吡蚜酮和毒死蜱在棉花、芥蓝、烟草、蔬菜、花生、甘蔗和茶叶中的残留消解研究已有相关报道[10-17],而吡蚜酮和毒死蜱作为复配剂使用后,在水稻上的残留行为还未有报道。笔者以建立的分析方法为基础,开展了稻田施用吡蚜酮和毒死蜱复配制剂后,2种农药在稻田系统中的残留行为研究,并基于获得的稻米中的残留数据,评估了2种农药的膳食暴露慢性风险,以期指导吡蚜酮和毒死蜱在水稻上的安全合理使用。
1 材料与方法
1.1 仪器与试剂
Waters 2695高效液相色谱仪(含2996 PAD检测器),美国沃特世科技有限公司;Trace GC Ultra气相色谱仪(含FPD检测器、磷滤光片),美国热电公司;SPS202F型电子天平,梅特勒-托利多测量技术有限公司;FA 1004型分析天平,上海天平仪器厂;SHZ-D型循环水真空泵,巩义市予华仪器有限公司;DHZ-DA全温型大容器恒温振荡器,太仓市实验设备厂;R201型旋转蒸发仪,上海申胜生物技术有限公司;12通道固相萃取装置,美国Supelco公司;THU-35C砻谷机,苏州佐竹机械有限公司;DFY-500D食品粉碎机,浙江屹立工贸有限公司。
吡蚜酮标准品(纯度98.40%)、毒死蜱标准品(纯度99%),上海安谱实验科技股份有限公司;30%吡蚜酮·毒死蜱悬乳剂(吡蚜酮质量分数10%,毒死蜱质量分数20%),浙江钱江生物化学股份有限公司;色谱纯乙腈和甲醇,德国默克公司;分析纯氨水,杭州高晶精细化工有限公司;分析纯乙酸乙酯和甲醇,杭州双林化工试剂有限公司;色谱纯庚烷磺酸钠,北京百灵威科技有限公司;分析纯氯化钠和无水硫酸钠,兰溪屹达化工试剂有限公司;硅胶SPE小柱(1 000 mg,6 mL),北京振翔科技有限公司。
1.2 田间试验
按照《农药登记残留田间试验标准操作规程》[18]和NY/T 788—2018《农药残留试验准则》[19]进行。于2016—2017年在浙江省杭州市、山东省济南市和湖南省长沙市开展了30%吡蚜酮·毒死蜱悬乳剂在水稻上的消解动态及最终残留试验。每个小区30 m2,每处理重复3次,同时设立清水空白对照小区。2016年浙江、山东、湖南3地水稻品种分别为“秀水09”、“豫粳6号”、“中浙优1号”,2017年3地品种分别为“浙408”、“豫粳6号”、“先农1号”。
1.2.1 消解动态试验
于水稻分蘖期,按有效成分270 g/hm2(制剂用量为600 g/hm2,用水量为450 L/hm2)分别均匀喷施水稻植株。于施药后2 h及1、3、5、7、14、21、28、35、42 d,以随机多点采样法采集植株、稻田水和土壤样品。
1.2.2 最终残留试验
于水稻生长中期,分别按照推荐使用剂量(180 g/hm2)和1.5倍推荐使用剂量(270 g/hm2)施药,施药次数分别为3次和4次,施药间隔期为7 d,处理间设保护隔离区。分别距最后1次施药14、21、28 d时,采集水稻全株和土壤样品。
1.2.3 样本采集和实验室样本的制备
水稻:在小区内随机剪取土表以上的全株5 kg,小区边行和每行距离2端0.5 m内不采样,水稻整株用脱粒机直接脱粒后,将稻秆剪成1 cm以下的小段,混匀,四分法留样;稻谷经砻谷机脱壳,获得的糙米和稻壳再分别用高速粉碎机研磨粉碎,混匀。稻秆、糙米和稻壳均留样约100 g,共2份。
田水:在消解动态试验小区内,随机选取10个采样点,混合取水样500 mL,共2份。
土壤:在小区内,随机选取8个采样点,采集0~10 cm深度土层的土壤约2 kg,除去碎石、杂草和植物根茎等杂物,混匀,留样200 g,共2份。
所有田间样品均于采集8 h内处理完毕,并于-20℃下保存备用。
1.3 分析方法
1.3.1 仪器条件
液相检测条件:Waters SunFireTM C18色谱柱(250 mm×4.6 mm,5 μm);流动相为乙腈/0.005 mol/L庚烷磺酸钠水溶液(10/90,V/V);流速为1.0 mL/min;进样量为20.0 μL;柱温为30℃;检测波长为299 nm。
气相检测条件:Varian CP-Sil 24 CB毛细管柱(30 m×0.25 mm,0.25 μm);进样量为1.0 μL;进样口温度为240℃;检测器温度为250℃;柱温为初温80℃,保持1 min,以50℃/min的速率升至240℃,保持3 min,再以50℃/min的速率升至260℃,保持2 min;载气(N2)流量为2 mL/min;空气流量为115 mL/min;氢气流量为90 mL/min。
1.3.2 样品前处理
1.3.2.1 样品提取
(1)植株样品。称取2.5 g植株样品,放入250 mL锥形瓶中,加入50 mL的乙腈氨水混合液(乙腈/水/氨水,90/9/1,V/V/V),在30℃、180 r/min的条件下振荡提取40 min,减压抽滤,滤渣再用上述方法提取1次,合并滤液于250 mL平底烧瓶中,40℃水浴条件下减压浓缩至近干,4 mL丙酮超声1 min溶解后,待净化。
(2)糙米、谷壳及土壤样品。称样量分别为10、5、10 g,同植株样品处理方法。
(3)水样。量取稻田水40 mL过滤入250 mL分液漏斗,然后加入40 mL乙酸乙酯充分振摇萃取,重复2次,合并乙酸乙酯相于平底烧瓶中,40℃水浴条件下减压浓缩至近干,4 mL丙酮超声1 min溶解后,待净化。
1.3.2.2 样品净化
硅胶SPE小柱经5 mL丙酮活化后,将待净化液上样并用6 mL丙酮洗脱,合并淋出液与洗脱液用于测定毒死蜱,然后用10 mL甲醇洗脱小柱并用真空泵抽干(1 min),收集洗脱液用于测定吡蚜酮。于40℃水浴条件下,分别将2种洗脱液减压浓缩并氮吹至干,毒死蜱样品用丙酮定容至5 mL,待GC-FPD分析,吡蚜酮样品用流动相定容至2 mL,超声1 min后过0.45 μm滤膜,待HPLC-PAD分析。
1.4 标准溶液配制及标准曲线绘制
准确称取0.010 2 g吡蚜酮标准品,以甲醇溶解并定容至100 mL,配制成100 mg/L吡蚜酮标准储备溶液。用流动相配制成0.01、0.05、0.10、0.50、1.0、5.0、20.0 mg/L吡蚜酮系列浓度标准工作溶液。准确称取0.010 1 g毒死蜱标准品,以乙腈溶解并定容至100 mL,配制成100 mg/L毒死蜱标准储备溶液。用丙酮稀释配制成0.01、0.05、0.10、0.50、1.0、5.0、20.0 mg/L毒死蜱系列标准工作溶液。以化合物质量浓度为横坐标,对应峰面积响应值为纵坐标绘制标准曲线。
1.5 添加回收试验
在糙米、谷壳、稻杆、土壤和稻田水空白样品中添加3档浓度水平的吡蚜酮及毒死蜱标准溶液,静置30 min,提取和净化操作同“1.3.2”。每个添加水平重复5次,以上述实验条件测定回收率。
1.6 膳食风险评估
长期膳食摄入风险根据规范残留试验中值(STMR/STMR-P)或最大残留限量(MRL),按式(1)计算其国家估算每日摄入量(NEDI),按式(2)计算风险概率(RQ)[20-22]。


式中:STMRi为农药在某种食品中的规范残留试验中值,mg/kg;Fi为一般人群对该食品的消费量,kg;bw为中国人均体重,kg(一般以63 kg计);RQ为风险概率;ADI为农药的每日允许摄入量mg/(kg bw)。
当RQ≤100%时,表示其风险可以接受。RQ值越小,风险越小;当RQ>100%时,表示有不可接受的慢性风险。RQ值越大,风险越大。
2 结果与分析
2.1 方法有效性评价
在0.01~20 mg/L,吡蚜酮和毒死蜱的峰面积与其质量浓度间均呈良好的线性关系,吡蚜酮的线性方程为y=381 374.679 8x-5 163.423 2(R2=1.000),毒死蜱线性方程为y=15 962 252.286 6x+295 843.986 4(R2=0.999 6),吡蚜酮和毒死蜱的仪器检出限(LOD)分别为0.2 ng和0.01 ng。添加回收试验结果(表1)表明,吡蚜酮在糙米、谷壳、水稻植株、土壤及田水中的平均回收率为74%~92%,相对标准偏差为0.5%~3.2%;毒死蜱在糙米、谷壳、水稻植株、土壤及田水中平均回收率为85%~98%,相对标准偏差为0.5%~4.1%。吡蚜酮在糙米、谷壳、水稻植株、土壤、田水中的定量限(LOQ)分别为0.02、0.04、0.08、0.02、0.002 mg/kg;毒死蜱在糙米、谷壳、水稻植株、土壤、田水中的LOQ值分别为0.05、0.1、0.2、0.05、0.001 mg/kg。方法的准确度和精密度能满足试验样品中吡蚜酮和毒死蜱的检测要求。
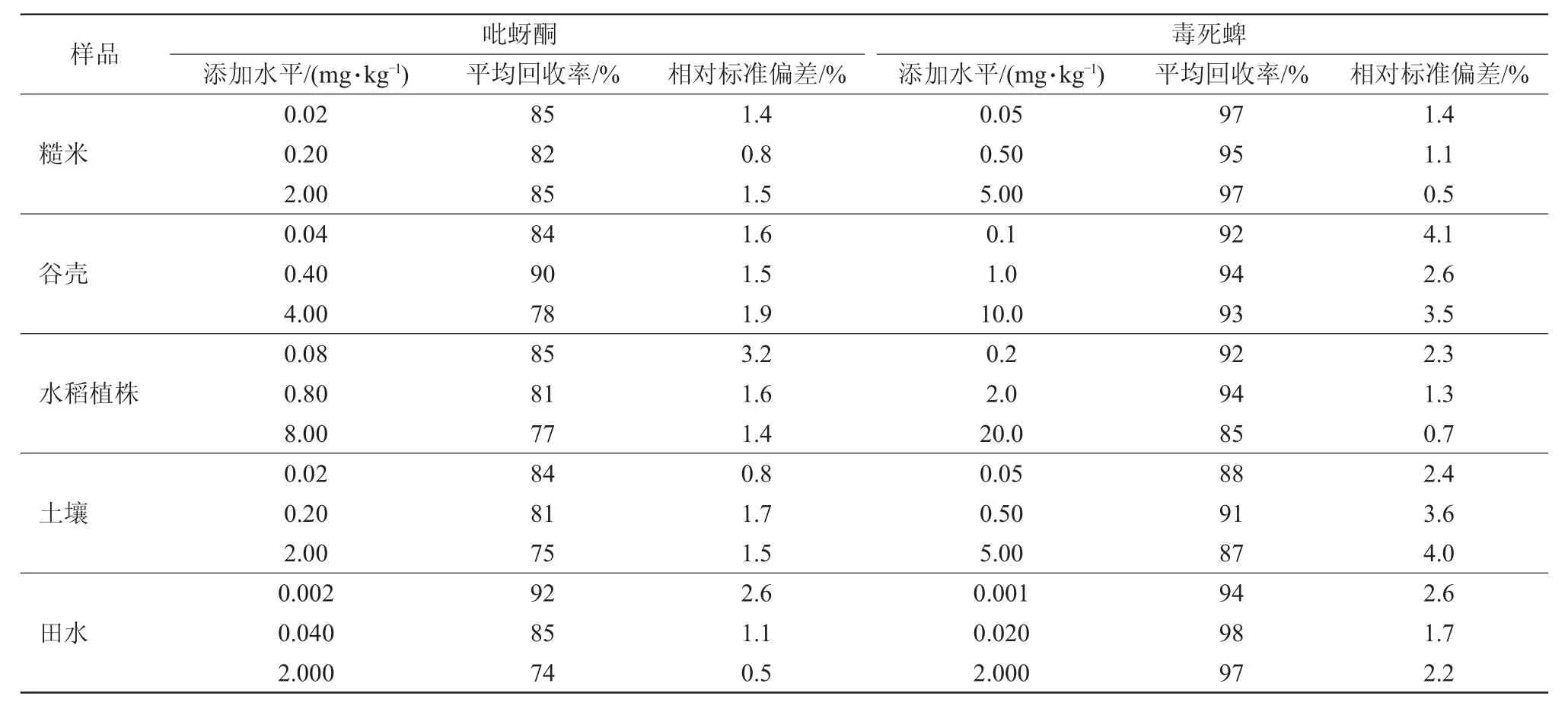
表1 吡蚜酮和毒死蜱在稻田样品中的添加回收率及相对标准偏差(n=5)
2.2 吡蚜酮、毒死蜱在水稻植株、田水和土壤中的消解动态
以30%吡蚜酮·毒死蜱悬乳剂270 g/hm2喷施1次,吡蚜酮和毒死蜱在3地植株中的原始沉积量分别为0.38~1.91 mg/kg和1.27~5.09 mg/kg;在稻田水中的原始沉积量分别为0.085~0.21 mg/L和0.022~0.14 mg/L。对消解动态数据进行回归处理,消解动态曲线均符合一级动力学方程(表2~5),2种农药的降解趋势均为先快而后变慢,最后逐渐趋于平缓。吡蚜酮和毒死蜱在水稻植株上消解较快,到第7 d时吡蚜酮消解率达81.4%,到21 d时毒死蜱消解率达90.9%,消解半衰期分别为1.8~9.1 d和1.2~3.4 d;在田水中14 d时吡蚜酮降解率在82.7%以上,21 d时毒死蜱降解率在90.9%以上,消解半衰期分别为0.76~17.7 d和1.7~7.0 d。李佳等[23]报道吡蚜酮在水稻植株和田水中的半衰期分别为11 d和7 d左右,柳王荣等[24]报道毒死蜱在水稻植株和田水中的半衰期分别为4.4~5.8 d和0.90~1.4 d,本研究结果与此基本一致。

表2 吡蚜酮在水稻植株中的消解动态
土壤中吡蚜酮仅2016年在山东点有检出,其原始沉积量为0.024 mg/kg,1 d和3 d检测值分别为0.076 mg/kg和0.033 mg/kg,5 d后均未检出(沉积量小于0.02 mg/kg);毒死蜱仅2017年在湖南点土壤中(第5 d实测值0.073 mg/kg)和2017年在山东点土壤中(原始沉积量0.11 mg/kg,1 d实测值0.062 mg/kg)有检出,其他采样时间点均未检出(沉积量小于0.05 mg/kg)。与水稻植株和田水相比,土壤中吡蚜酮和毒死蜱检出浓度较低,主要原因与实验设计有关。本研究未在土壤表面单独施药来测定其土壤消解动态,而是在稻田施药后,采集相应的土壤样品测定。水稻植株的拦截、田水和土壤中的吸附分配等因素均是土壤中吡蚜酮和毒死蜱检出浓度较低的主要原因[25]。

表3 毒死蜱在水稻植株中的消解动态
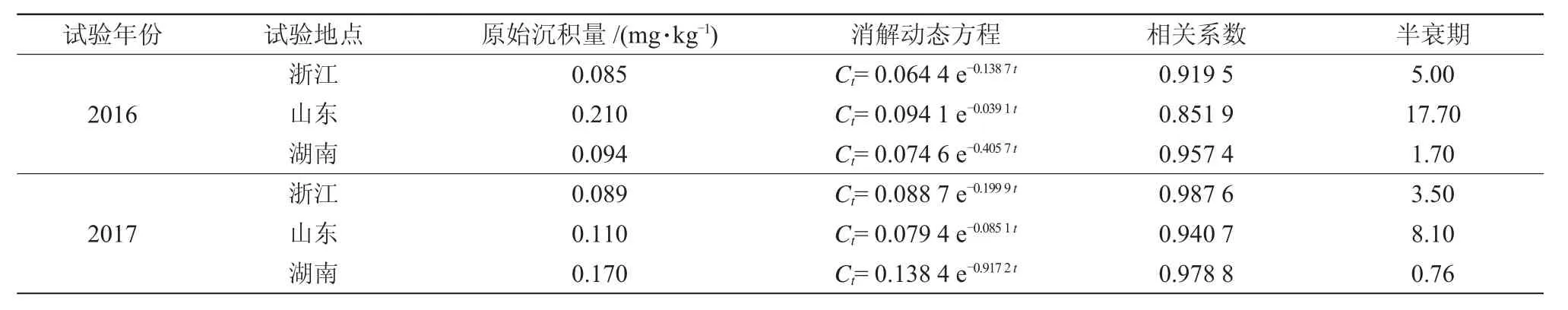
表4 吡蚜酮在田水中的消解动态
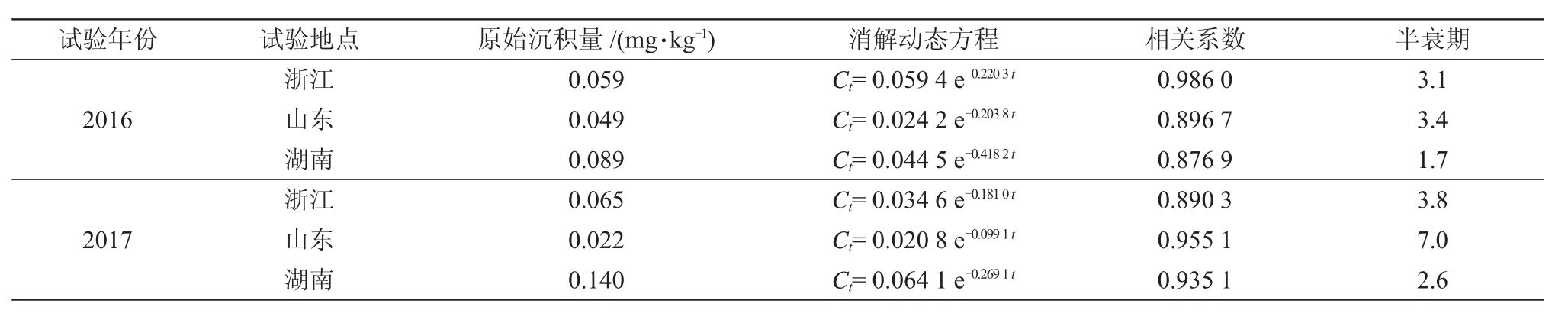
表5 毒死蜱在田水中的消解动态
2.3 吡蚜酮、毒死蜱在水稻及土壤中的最终残留量
2016、2017年浙江、湖南和山东三地不同施药剂量、施药次数和采收间隔期,糙米、谷壳和稻秆中吡蚜酮和毒死蜱最终残留量检测结果见表6、7。糙米中吡蚜酮的最终残留量在采收间隔期为14 d时小于0.02~0.15 mg/kg,采收间隔期21 d和28 d时均小于0.02 mg/kg,低于我国规定的MRL值(0.2 mg/kg);谷壳、水稻植株上吡蚜酮的最终残留量分别为小于0.040~0.19 mg/kg和0.080 mg/kg。糙米中毒死蜱的最终残留量在采收间隔期为14、21和28 d时为小于0.05~0.15mg/kg,低于我国规定的MRL值(0.5 mg/kg);谷壳、水稻植株上毒死蜱的最终残留量分别为小于0.10~1.4 mg/kg和0.20~1.1 mg/kg。结果表明,吡蚜酮和毒死蜱在糙米、稻壳、植株上的残留量均表现出随施药浓度及施药次数的增加而升高,随时间延长而降低的趋势。郑坤明等[26]研究表明,高粱田中施用吡蚜酮(有效成分225 g/hm2),于末次施药后21 d,高粱中吡蚜酮最终残留量小于0.002~0.009 mg/kg,与本研究结果一致。毒死蜱在稻田土壤中均未检出(小于0.050 mg/kg),吡蚜酮在稻田土壤中残留量较低(小于0.020~0.026 mg/kg),28 d后均未检出。
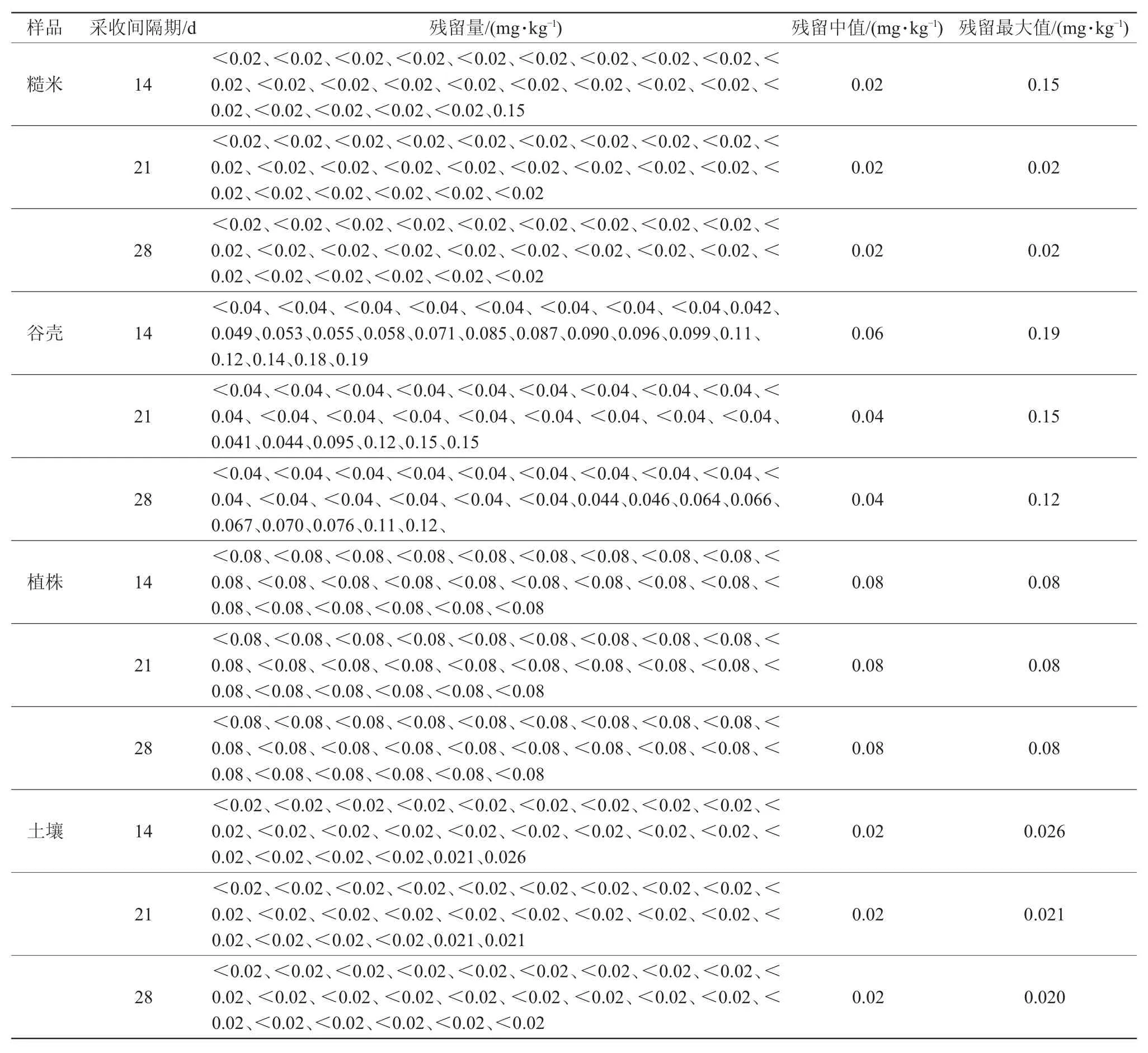
表6 吡蚜酮在糙米、稻秆、谷壳和土壤中最终残留量(n=3)

表7 毒死蜱在糙米、稻秆、谷壳和土壤中最终残留量

(续表7)
2.4 膳食摄入风险评估结果
GB 2763中规定吡蚜酮和毒死蜱的ADI值分别为0.03 mg/kg bw和0.01 mg/kg bw[27]。以中国不同人群的膳食结构为基础[28],按照推荐使用剂量(180 g/hm2)施药3次,距末次施药14 d时,在糙米中吡蚜酮和毒死蜱的残留中值分别为0.02、0.05 mg/kg,结合吡蚜酮和毒死蜱在我国的登记使用情况[29]和已制定的最大残留限量(MRLs),按照“1.6”中的公式计算其国家估算每日摄入量(NEDI)和风险概率(RQ)。
计算得出吡蚜酮的国家估算每日摄入量(NEDI)为1.595 mg,风险概率(RQ)为84.4%;毒死蜱的国家估算每日摄入量(NEDI)为0.602 mg,RQ值为95.6%;吡蚜酮和毒死蜱RQ值均小于1,处于可接受水平。其中糙米中吡蚜酮残留对膳食摄入风险的占比为0.25%,毒死蜱残留对膳食摄入风险的占比为1.9%,2种农药均不会对一般人群健康造成不可接受的风险。因此,按照有效成分180 g/hm2的剂量使用30%吡蚜酮·毒死蜱悬浮剂不会对一般人群造成慢性膳食摄入风险。
3 结果与讨论
笔者采用建立的分析方法,研究了稻田施用吡蚜酮和毒死蜱复配制剂后的残留行为,并采用试验数据及查询数据评估了吡蚜酮和毒死蜱对人群的膳食暴露风险。吡蚜酮和毒死蜱在水稻植株和田水中消解速率较快,吡蚜酮在水稻植株和稻田水中的半衰期分别为1.8~9.1 d和0.76~17.7 d,毒死蜱的半衰期分别为1.2~3.4 d和1.7~7.0 d,本研究结果与之前的研究报道基本一致[23-24]。将吡蚜酮和毒死蜱复配制剂喷施至水稻田后采集土壤检测,结果表明吡蚜酮和毒死蜱在土壤中的检出量较低,主要原因是一方面与植株和田水的拦截[25]有关;另一方面吡蚜酮和毒死蜱在水稻-田水-土壤系统中的行为特征与分布还受水体酸碱度、土壤有机质含量、土壤孔隙结构和田间管理措施等影响[30],同时微生物的降解也是土壤中吡蚜酮和毒死蜱检出浓度较低的重要因素[31]。
在水稻吐穗期,按照推荐使用剂量(180 g/hm2)施药3次,距末次施药14 d时,在糙米中吡蚜酮和毒死蜱的残留中值分别为0.02和0.05 mg/kg,最终残留量最高均为0.15 mg/kg,均低于我国制定的糙米中吡蚜酮和毒死蜱的MRL值(分别为0.2和0.5 mg/kg)[27]。结合试验获得的数据和查询数据,采用食品中农药残留风险评估指南中长期膳食摄入评估的方法估算了2种农药的膳食风险,其中糙米中吡蚜酮残留对膳食摄入风险的占比为0.25%,毒死蜱残留对膳食摄入风险的占比为1.9%,基本不会对一般人群健康造成不可接受的风险。本研究的膳食风险评估结果也验证了前人的研究报道,即吡蚜酮和毒死蜱对人群膳食风险较低,但对生态环境风险较高,特别是对水生态系统的风险[32]。因此,关于稻田中施用吡蚜酮和毒死蜱,后续的研究应重点关注吡蚜酮、毒死蜱及主要代谢物在稻田系统中的残留、分布、迁移等环境归趋行为特征,以及通过降雨等因素由稻田漫溢至附近地表水中的浓度、对敏感生物的毒性和水生态风险评估等方面。
