化学动力学实验的原位混样装置
2021-11-01廖知常王雪飞田志远陈波珍
廖知常, 高 美, 高 鹏, 王雪飞, 田志远, 陈波珍
(中国科学院大学化学科学学院,北京 100049)
0 引 言
化学反应动力学是物理化学的主要内容之一,其相应的教学实验在授课中扮演重要角色。光学检测具有便捷、快速的特点,是常用的动力学过程跟踪手段,在许多传统实验中采用光学表征技术来记录动力学曲线[1-4]。这些实验有一个共同的特点,就是将两种或多种溶液混合,同时迅速启动检测,并且整个过程要求温度恒定。但是,已有的实验方案均无法有效地确保共混与检测有效地衔接以及整个过程温度的恒定。以“丙酮碘化”实验为例,其原理是通过测量单质碘的吸收光度来跟踪丙酮和碘的反应进程,变换反应物的浓度可以换算反应级数和速率常数,改变反应温度获得反应活化能[5-6]。该体系的反应速率对温度非常敏感,微小的温差也会引起动力学曲线的变形。传统的实验设计先后用2 个水浴来给反应液恒温[1,7-8],操作步骤简述如下:先将丙酮和盐酸的混合液以及碘水分别置于恒温水浴中,启动反应前将两者混均,然后快速转移至比色皿中,用分光光度计做时间扫描,分光光度计的样品架接有循环恒温水浴。如此操作有两处会引起体系温度的失恒:将试样由恒温水浴转移至比色皿的过程中会有短暂的室温暴露;恒温水浴与恒温样品架间的温度难以绝对一致。由此造成的结果是吸光度衰减曲线总伴有一个前期的平台,这是反应在温度变化的状态下进行的表现,平台区的数据无法用于动力学参数计算。另外,受限于实验条件,丙酮实验的溶液配制多采用移液管,试剂用量超过15 mL,而实际检测仅需几mL,造成不必要的浪费。
停-留技术是常用的反应动力学研究手段,其原理是将参与反应的两种溶液分别注入导管,然后快速注入同一微量容器(<1 mL),同时开启观测[9-10]。这种技术的特点是反应体系混合和测量在同一容器中,压缩死时间。基于该理念,本文设计了原位共混装置。首先,丙酮和盐酸直接在比色皿中混合,将比色皿置于恒温样品架上并保持不动,以达到所需反应温度。用加样器吸取碘水,然后将吸头浸入比色皿中,静置,待整个体系温度平衡后用移液器将碘水快速注入比色皿,随即测量。这种原位恒温、原位混合的实验方法完全消除了温度涨落造成的数据失真,并将试剂用量控制在3 mL以内。
1 实验方法
1.1 试剂与仪器
盐酸标准液(1.007 mol/L)和碘标准液(0.100 7 mol/L)购于北京北方伟业计量研究院;分析纯丙酮(北京化工厂);超纯水(Millipore,18 MΩ)。
吸收光谱仪(德国耶拿SPECORD 200 UV-Vis);精密数字温度计(南京桑力SWJ-Ic);超级恒温槽(上海舜宇恒平科学仪器有限公司CH1006);石英比色皿1 cm;移液器1 mL、200 μL。
1.2 原位混合器
图1 是本文设计的原位混样器示意图,在一根细的软管(导气管)两端配有接口,可分别与移液器和吸头对接,吸头可直接伸入比色皿中。其工作原理为:调节移液器刻度至所需体积(本文中为100 μL),经过软管吸取碘溶液于吸头中,再次转动移液器调节旋钮至将120 μL刻度,这时在吸头进样口处就会有一段空气,且由于液体表面张力作用空气不会上升;然后将装有碘溶液的吸头浸入盛有盐酸和丙酮的混合溶液的比色皿中,静置,待内外溶液热平衡后,通过移液器将碘液快速推出并反复抽排使反应液快速均匀混合,启动反应;移走吸头,开启测量。
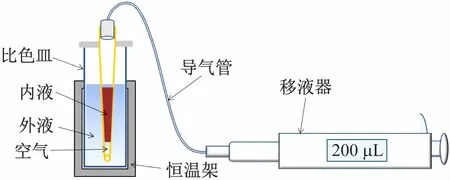
图1 原位混样装置示意图
1.3 实验步骤
“丙酮碘化”实验的传统操作步骤可参考相关教材和文献[1,7],此处做简要介绍,将盐酸和丙酮的水溶液在锥形瓶中混合,水浴恒温一段时间;上述溶液加入碘液混匀后快速转移至比色皿,测量吸光度随时间的变化。与之相对应,设计新的操作步骤:①将0.15 mol/L盐酸、0.33 mol/L丙酮和60 mol/L 碘的溶液在25 ℃水浴中预热;②取1.8 mL 盐酸溶液、1 mL 丙酮溶液及100 μL 纯水加入比色皿,置于光谱仪恒温架上;③用混样器吸取100 μL 碘溶液并浸入比色皿中的溶液中,静置5 min;④设置光谱仪波长510 nm,测量时间为7 min,间隔30 s记录;⑤通过移液器将碘液快速注入比色皿,并反复吸排使得溶液混合均匀后,取出原位混样器并开始动力学测量。
2 结果与讨论
确保原位混样器内部溶液不泄露引发反应是该装置是否可用的前提。为此,将吸有碘液的吸头插入盛有纯水的比色皿,间隔1 min测一次吸光度,连续跟踪10 min,以验证碘液不会泄露。图2 为510 nm处吸光度随时间的变化关系。图中结果显示,比色皿中水的吸光度值从始至终没有明显变化,说明在实验设定的时间内,空气柱有效地隔断了内外液体,吸头中的碘液没有因泄露或扩散混入水中。证明本文设计的混样器不会引入系统误差,可以用于后续实验。

图2 吸光度随时间的变化曲线
进一步将所设计装置用于反应动力学实验,同时也重复现有教材的步骤作为对比。就同一浓度配比的反应液分别用两种方案各重复测试3 次,对比它们的动力学曲线。由图3(a)可见,3 次测试的动力学曲线的初始部分均有一段弯曲的平台,并且3 次测试的曲线的斜率略有差异,实验重复性较差,不利于后续动力学参数的准确计算[11]。出现这种现象的原因是由于丙酮碘化反应的反应速率对温度非常敏感,微小的温度变化就会引起动力学曲线的变形。依据传统操作,先将丙酮和盐酸的混合液及碘液分别置于恒温水浴中预热,接着将两者混匀启动反应后,迅速转移至比色皿中,再放回分光光度计的恒温样品架中进行动力学测试。如前文所述,在此过程中反应体系的温度会出现系统性波动,主要来自来:①将试样由恒温水浴转移至比色皿的过程至少有10 s的室温暴露期;②用于预热的恒温水浴与比色皿所处恒温样品架间有一定的温度差。因此,当溶液由锥形瓶倒入比色皿后的一段时间内体系温度并不稳定。图中3 次平行实验数据均出现前期的低速率,表明该时期溶液温度较低,这应该归因于反应液暴露于室温造成的热损失。并且这种热损失会因环境温度、操作熟练程度而异。根据实验原理,动力学曲线应为直线,通过拟合其斜率来计算反应速率。因此,图3(a)中前期约120 s的数据无法用于线性拟合。
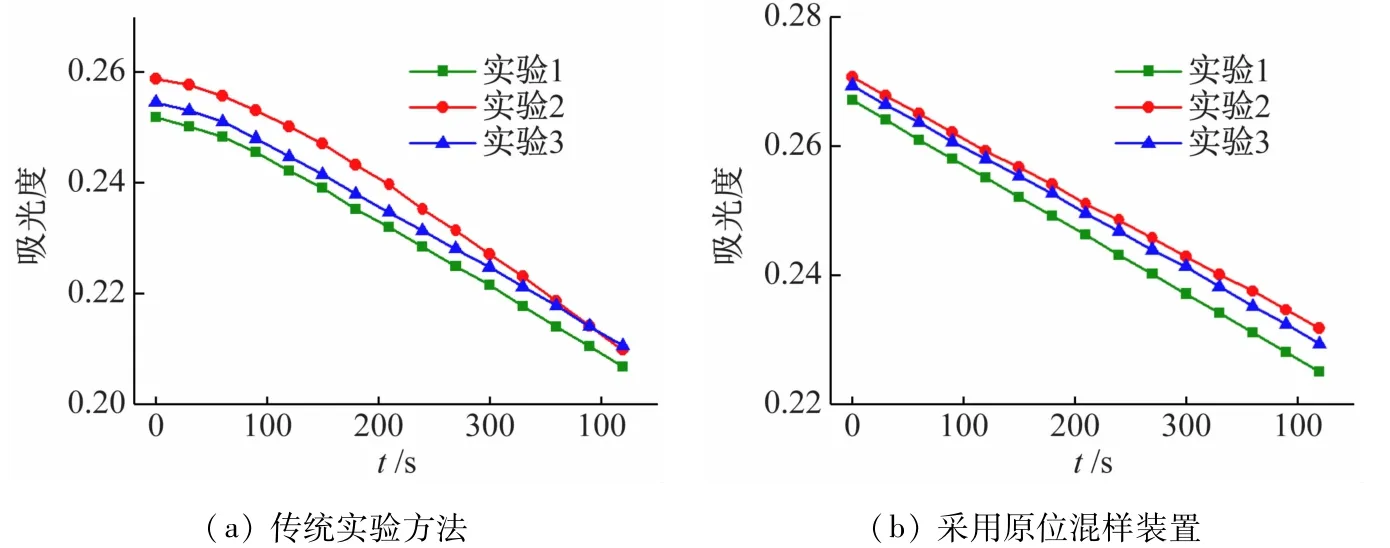
图3 25 ℃下丙酮碘化动力学曲线
图3(b)是采用新设计的混样装置的测量结果。操作过程中,首先将充有碘液的吸头浸入盛有丙酮和盐酸的比色皿中于同一环境下恒温,确保两者没有温度差;然后在比色皿不移开恒温架的状态下将两种溶液混合并原位测量,完全避免室温暴露。从图中可以看出,改进后测试的动力学曲线呈完整的直线,并且平行3 次测试的数据有较好的重复性。充分表明这种原位的混样装置能有效地避免热损失。
值得一提的是,采用该装置后实验操作更加简单,有效地避免了人为误差。并且所需反应液的总量由原来的15 mL 减少为3 mL,大大节约试剂用量,降低实验的成本,也有效减少实验废液的产生,符合绿色化学的发展趋势[12]。进而,本文设计的原位混样装置不仅限于丙酮碘化实验,也不限于教学实验,凡是涉及化学动力学检测,反应进程超过30 s的体系均可采用这种加样方式[13-14]。特别是对反应条件有严格限定的体系,如光照(塑料吸头改为石英管)、温度等[15-16],该装置的原位共混功能均可发挥作用。生化实验的酶促反应,需要精准确定反应的开启时间,并定时测量反应进程中的产物浓度[17],采用本文报道的方法可将时间精度提升至秒级。
3 结 语
针对化学动力学实验,设计了一种溶液原位共混装置,该装置借助液体的表面张力在细管内保留一段空气柱,将管内管外的溶液隔离开来,使其不会发生混合,但两者温度相同。该装置可将内部溶液快速排出,启动反应,原位测量。实践证明,采用新的实验装置,动力学曲线更加完整,更好地呈现反应机理,化学试剂的用量减少数倍。更重要的是将现代动力学测量技术的理念引入教学课堂,增加实验趣味性,学生也体会到实验装置在科学实践中的重要性,提升学习兴趣。
