稀土钕掺杂介孔生物玻璃的微球调控实验
2021-11-01刘雨,张英
刘 雨, 张 英
(1.苏州大学a.纺织与服装工程学院;b.材料与化学化工学部,江苏苏州 215123;2.现代丝绸国家工程实验室,江苏苏州 215123;3.南通家纺产业技术研究院有限公司,江苏南通 226000)
0 引 言
药物的控制释放有利于提高药物疗效,减少用药次数,是生物医用材料领域的研究热点之一[1-3]。与传统的生物玻璃材料相比,介孔生物活性玻璃微球(Mesoporous Bioactive Glass Nanospheres,MBG)具有规整有序的孔道,较高的比表面积,良好的生物活性,在药物传输方面受到广泛关注[4-5]。我国稀土资源丰富,储量居世界之首。稀土是镧系元素的通俗名称,元素包括镧、铈、钕等17 种元素[6]。稀土具有独特的理化性质,在工业及科技领域有广泛应用[7]。在稀土元素中,钕(Nd)元素化学性质较活泼,越来越引起人们的关注。在镁或铝合金中添加少量Nd,可提高合金的耐高温性能和气密性[8];掺杂Nd 的激光器可代替手术刀用于摘除手术或消毒伤口[9];农药中适量的Nd元素能促进作物的生长,提高农作物的抗病性[10]。钕铁硼(NdFeB)磁能积高,被称作当代“永磁之王”,以其优异的性能广泛用于电子行业[11-12]。但将Nd 用于MBG的研究尚且比较有限,本实验采用溶胶-凝胶法制备Nd 掺杂介孔生物玻璃(Nd/MBG),研究不同Nd掺杂比对Nd/MBG微球药物控制释放能力及其生物安全性的影响,探讨其在药物载体领域的应用潜力。
1 实验部分
1.1 主要试剂
十六烷基三甲基溴化铵(CTAB)、乙酸乙酯(EA)、正硅酸乙酯(TEOS)、磷酸三乙酯(TEP)、四水硝酸钙(CN)、无水乙醇(EtOH)、氨水(NH3·H2O)、胰酶、高糖培养基(DMEM)、胎牛血清(FBS)。
1.2 样品制备
取1.2 g的CTAB加入EtOH和NH3·H2O中,搅拌溶解后依次加入TEOS、TEP 及不同量的CN 和Nd2O3。反复离心冲洗,60 ℃干燥24 h,650 ℃空气下煅烧3 h,得不同Nd掺杂比的Nd/MBG微球(表1)。

表1 Nd/MBG微球样品的主要成分
1.3 形貌表征
Nd/MBG微球的形貌结构用冷场扫描电子显微镜(SEM,S-4700,日本)和透射电子显微镜(TEM,FEI Tecnai G-20,美国)表征。表面元素、基团变化用X 射线光电子能谱(XPS,XSAM800,美国)及傅里叶变换红外光谱仪(FTIR,Nicolet iS5,美国)进行分析。比表面积、孔径分布和吸-脱附等温曲线用比表面测定仪(BET,ASAP2020(M +C),美国)表征。
1.4 矿化能力
称取0.05 g 的Nd/MBG 微球浸泡于50 mL 的模拟生理体液(SBF)[13],37 ℃恒温水浴震荡3 d,丙酮冲洗并干燥,SEM 与FTIR 分析Nd/MBG 表面羟基磷灰石(HA)的矿化能力。
1.5 药物装载
避光条件下,将50 mg Nd/MBG 微球加入到配置好的DOX 溶液中(0.25 mg/mL,6 mL),震荡24 h 后离心收集上清液,得到装载DOX 的Nd/MBG-DOX 微球。紫外可见分光光度计(UV-Vis,CARY50,美国)测定在480 nm吸光度值,计算DOX的装载率:
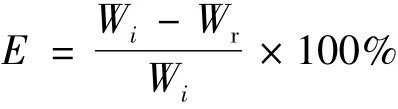
式中:Wi为DOX的初始量;Wr为未装载DOX的量。
1.6 药物释放
将Nd/MBG-DOX浸泡于7 mL 不同pH 值(pH =4.3、7.4、8.6)的PBS 溶液中,恒温水浴震荡,一定时间点取3.5 mL PBS 溶液,UV-Vis 测定吸光度,计算DOX的累积释放量:
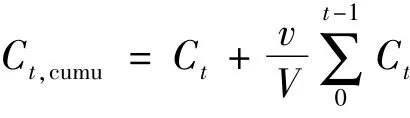
式中:Ct为对应时间的DOX 浓度;v 为介质体积3.5 mL;V为体系总体积7 mL。
1.7 细胞毒性
取浓度为1 × 105个/mL的人骨肉瘤细胞(MG63)种植到96 孔板中,加入不同浓度(50、100、200 μg/mL)的Nd/MBG 微球及Nd/MBG-DOX 微球。培养1,3,5 d,CCK-8 试剂盒(CCK-8,Sigma,St.Louis,USA)检测细胞活力[19],不加材料组为空白对照组。
2 结果与讨论
2.1 Nd/MBG微球的表面形貌表征
从图1(a)TEM 可看出,Nd/MBG 微球为均匀的球形,粒径达到纳米级,表面存在微小的纳米孔隙。不同Nd掺杂量的Nd/MBG微球材料从内到外逐渐变得疏松。EDS 图显示微球中Si、P 和Ca 元素呈均匀分布,Nd 在MBG 中呈现高度分散的均匀分布(图1(b))。XPS结果显示,0 Nd/MBG微球中存在Si特征峰,未见Nd特征峰。掺杂Nd后的Nd/MBG微球中Si元素图形与未掺杂时相似,但元素的结合能变小,电子数变少,价态升高,表明此时的Si 以四价的形式存在的。Nd元素图谱中,980 和1 000 eV 处出现明显的3d 5/2和3d 3/2 的结合能谱峰,表明Nd3+的存在(见图1(c))。

图1 (a)不同Nd掺杂比的Nd/MBG微球的TEM图;(b)EDS能谱分析1 Nd/MBG微球表面Si、Ca、P和Nd元素分布;(c)0、2 Nd/MBG微球表面Si4 +、Nd3 +的XPS图谱
吸脱附等温线的形状与材料的结构有关[15],利用N2吸附-脱附测试检测Nd/MBG微球的孔径及结构变化(见图2)。不同Nd掺杂比的Nd/MBG微球的洗脱等温线均为Langmuir IV型等温线,具有H1 型迟滞回线,表明Nd/MBG微球具有介孔结构。通过BET方程计算,0 Nd/MBG的比表面积(SBET)、平均孔径(DP)和孔体积(VP)分别是400 cm2/g、2.7 nm和0.33 cm3/g,随着Nd掺杂量的增加,微球的SBET略有所减小,但DP略有所增加;1 Nd/MBG 的DP最高到4.5 nm;2 Nd /MBG的SBET、DP和VP分别为177 cm2/g、3.6 nm 和0.22 cm3/g。表明改变Nd 的掺杂量,可以调节Nd /MBG微球的大小及孔径。

图2 Nd/MBG微球的N2 吸附-脱附等温线及孔径分布曲线
2.2 Nd/MBG微球体外生物活性
将不同Nd 掺杂比的Nd/MBG 微球浸泡入SBF中,3 d后SEM和FTIR观察微球表面HA的沉积情况(见图3),考察Nd/MBG微球体外生物活性。结果表明,所有Nd/MBG 微球未浸泡SBF 前,均表现出规则的球形形态,分散均匀,表面存在介孔结构。浸泡3 d后,各组Nd/MBG微球表面均有大量HA 生成。其中0 Nd/MBG微球表面HA 呈无规则的薄片状,掺杂Nd的Nd/MBG微球表面HA 分布更均匀,且呈三维立体花簇状。FTIR结果显示,0 d 时,Nd 掺杂前后的Nd /MBG微球主要特征峰无明显变化,表明Nd 的添加不会对MBG的组成和结构造成明显影响。浸泡3 d后,样品在507 cm-1处出现了明显的强峰,对应HA 中的P—O—基团的特征峰,表明Nd/MBG 微球表面有HA生成,具有生物活性。
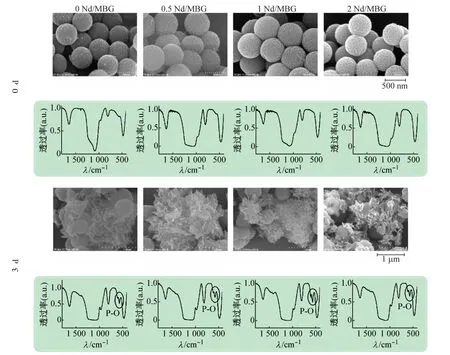
图3 在SBF中浸泡0和3 d后Nd/MBG微球SEM和FTIR谱图
2.3 药物的装载释放
阿霉素(Doxorubicin,DOX)是一种蒽环类广谱抗肿瘤药物,具有明显的抑癌作用。但DOX难溶于水且不具有靶向性,体内易被P-糖蛋白外排。如果大量使用药物,可能会引起不良反应[16-17]。实验采用Nd /MBG微球装载DOX,24 h后0 Nd/MBG微球的装载率为86.3%,表明Nd/MBG微球能在短时间内与溶液中的DOX充分接触吸附。增加Nd的掺杂量,DOX装载效率略有所下降,但仍保持在70%左右。表明Nd /MBG微球有良好吸附能力,有利于提高DOX 给药效率,减少因药物过量使用而引起的不良反应(见表4)。
装载DOX的Nd/MBG-DOX微球的释放行为会受到释放环境的影响。不同pH 条件下,Nd/MBG-DOX微球显现出不同的控制释放能力。pH =8.6 时,Nd /MBG-DOX微球的最大释放率为36%,最小释放率为13%(见图5(c));pH =7.4 时,最大释放率为39%,最小释放率为15%(见图5(b));pH =4.7 时,最大释放率高达82%,最小释放率为53%(见图5(a))。相同pH条件下,不同Nd 掺杂比的Nd/MBG-DOX 微球DOX累计释放率不同。pH =8.6 时,0 Nd/MBG-DOX微球在25 h内释放率达到30%,250 h后到40%。掺杂Nd后释放率降低,其中1 Nd/MBG-DOX 微球累计释放量最低,250 h 后为15%(见图5(c))。pH =4.3时,各组掺杂Nd的Nd/MBG-DOX微球在最初25 h内都能快速释放DOX,并随着时间延长显示出良好的控制释放能力。250 h 后,0.5,1,2 Nd/MBG-DOX 累计释放率分别达为70%、60% 和58%(见图5(a))。Higuchi模型计算Nd/MBG-DOX 微球的DOX 累计释放量。相同Nd掺杂比的Nd/MBG-DOX微球,DOX在不同pH环境中的释放量顺序为pH =4.3 >pH =7.4>pH =8.6。相同pH 条件下,DOX 动力学释放速度顺序有所不同。pH =8.6 时,0 Nd/MBG-DOX >0.5 Nd/MBG-DOX >2 Nd/MBG-DOX >1 Nd/MBG-DOX;pH =7.4 时,0 Nd/MBG-DOX >2 Nd/MBG-DOX >1 Nd/MBG-DOX >0.5 Nd/MBG-DOX;pH =3.4 时,0 Nd/MBG-DOX >1 Nd/MBG-DOX >0.5 Nd/MBG-DOX>2 Nd/MBG-DOX。表明Nd/MBG-DOX 微球在不同pH值下具有差异化的延迟释放能力,在递送过程中有利于DOX在肿瘤部位的积累,减少耐药现象的发生。
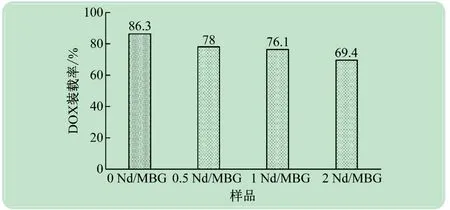
图4 Nd/MBG微球装载DOX的效率

图5 Nd/MBG-DOX 微球在不同pH 溶液中DOX 的累计释放曲线及Higuchi释放模型
2.4 细胞活力
采用CCK-8 试剂盒检测不同浓度的Nd/MBG 和Nd/MBG-DOX微球对MG63 细胞生长的影响。当浓度50 μg/mL,1 d 时各Nd/MBG 微球组的OD 值基本与control组持平,表明Nd/MBG微球能够支持细胞生长。Nd/MBG-DOX组OD值略小于Nd/MBG组,表明Nd/MBG-DOX微球能够释放DOX,影响MG63 细胞的生长。3 d时,各Nd/MBG微球组的OD值较第1 d都有所上升,表明该浓度下细胞生长良好。而Nd/MBGDOX组OD 值低于各Nd/MBG 组,且存在显著性差异。5 d时,Nd/MBG微球组生长趋势与前3 天类似,说明该浓度下Nd/MBG 微球能够支持MG63 细胞生长,细胞毒性小。Nd/MBG-DOX 微球能释放DOX,明显抑制MG63 细胞的增殖(见图6(a))。当浓度为100 μg/mL 时,在培养初期,各Nd/MBG 组对细胞的增殖没有产生明显的影响,表明该浓度下Nd/MBG 微球仍能够支持MG63 细胞生长,细胞毒性较小。Nd /MBG-DOX组细胞生长趋势也与浓度50 μg/mL 时相似,说明Nd/MBG-DOX微球释放的DOX能抑制MG63细胞的增殖。随着培养时间的延长,1 Nd/MBG 微球在第5 d时表现出抑制细胞增殖的情况(见图6(b))。当浓度增加为200 μg/mL 时,Nd/MBG 微球组的OD值较control组明显降低,表明浓度过高的Nd/MBG微球有细胞毒性,不利于细胞生长。5 d 时,各Nd/MBG微球组的OD值较第1 d 略有所上升,但细胞毒性明显。相同条件下,Nd/MBG-DOX 微球能够释放DOX,显著抑制MG63 细胞生长(见图6(c))。研究结果显示当浓度低于100 μg/mL 时,Nd/MBG 微球相对无毒性,是比较安全的载体。Nd/MBG-DOX 微球能够缓慢控制药物释放,起到抑制癌细胞生长的作用。
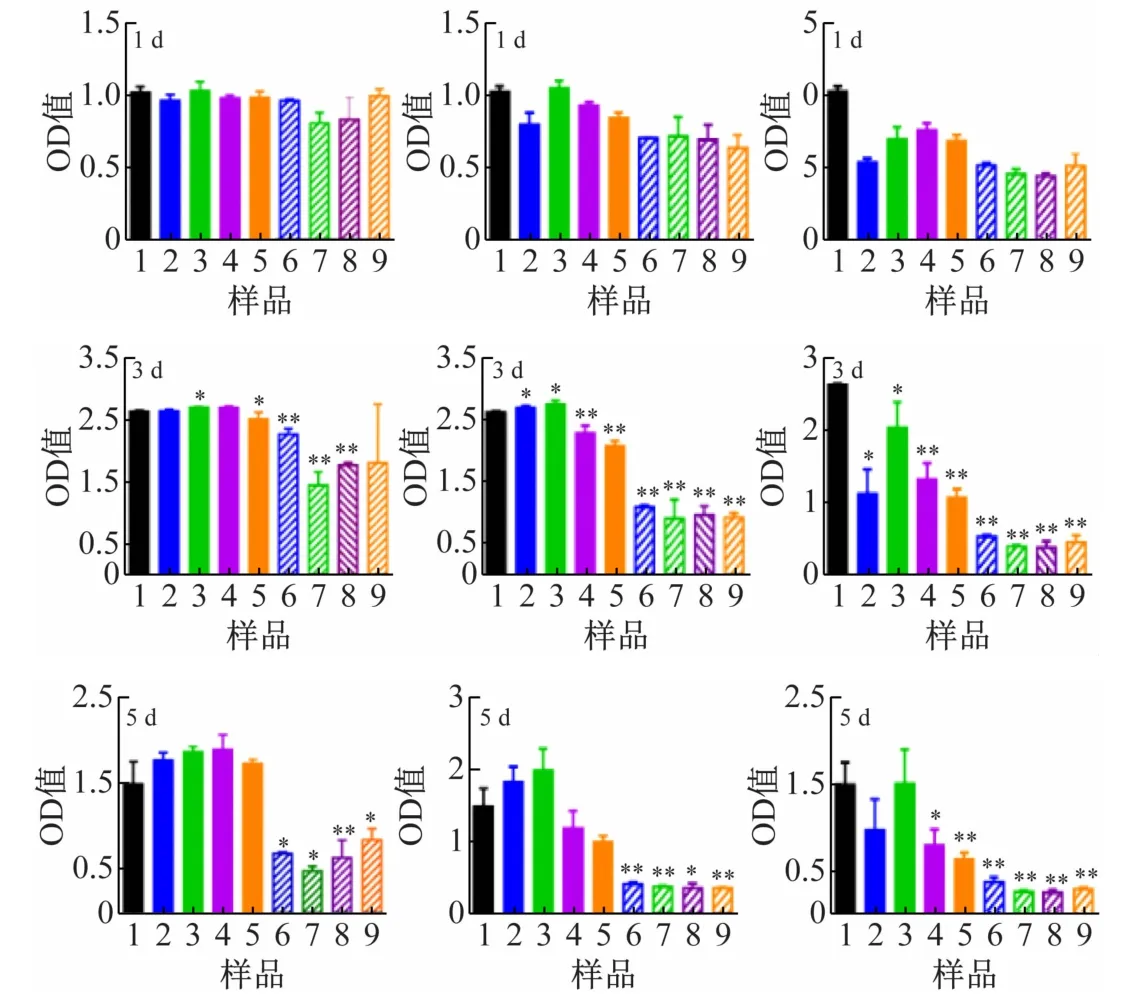
图6 不同浓度的Nd/MBG 微球和Nd/MBG-DOX 微球对MG63细胞活力的影响(1:空白对照样;2:0Nd/MBG;3:0.5Nd/MBG;4:1Nd/MBG;5:2Nd/MBG;6:0Nd/MBGDOX;7:0.5Nd/MBG-DOX;8:1Nd/MBG-DOX;9:2Nd/MBG-DOX)(a):50 μg/mL,(b):100 μg/mL,(c):200 μg/mL(*:P <0.05,**:P <0.01)
3 结 语
本实验采用溶胶-凝胶法制备不同Nd 掺杂比的Nd/MBG微球,大小均匀,表面存在微小的纳米孔隙。通过改变Nd 掺杂比,可以调控Nd/MBG 微球的表面形貌特征。其中,1 Nd/MBG 微球具有更大的比表面积、平均孔径和孔体积。Nd/MBG 微球能够体外矿化生成HA,具有生物活性。Nd/MBG 微球能够装载DOX,且在不同pH 环境下表现出差异化的延迟释放能力。相同Nd掺杂比的Nd/MBG-DOX微球,在pH =4.3 环境中的累积释放量最大。不同Nd 掺杂比的微球,pH =3.4 时,2 Nd/MBG-DOX 的延迟释放能力最强。体外细胞培养结果显示,Nd/MBG 微球对MG63骨肉瘤细胞的生物安全性具有剂量依赖性。当浓度低于100 μg/mL 时,细胞培养时表现出较高的安全性。Nd/MBG-DOX微球能够控制DOX 的释放,在递送过程中有利于DOX在肿瘤部位的积累,减少耐药现象的发生。研究结果表明,通过改变Nd 掺杂比调控制备的Nd/MBG微球,具有良好的药物控释能力和生物安全性,在药物载体领域具有潜在应用价值。
