宫颈鳞状细胞癌新辅助化疗耐药相关的miRNA分析
2021-10-30王毅军陈安儿史慧薇钟惠珍江元陈雪珍施政郑晨旸赵玲军
王毅军,陈安儿,史慧薇,钟惠珍,江元,陈雪珍,施政,郑晨旸,赵玲军
宫颈癌是最常见的妇科恶性肿瘤之一,早期宫颈癌治疗以手术为主,而早期巨块型宫颈癌(局部肿瘤直径>4 cm的Ⅰb2 ~Ⅱa2 期)可先行一定疗程的化疗,待肿瘤病灶缩小后再行切除,以提高手术切除率。部分患者对新辅助化疗不敏感,因此新辅助化疗前对肿瘤化疗敏感性进行预测显得尤为重要。研究有关新辅助化疗敏感性的影响因素和预测方法,以实现“可预见性”的新辅助化疗,在目前新辅助化疗远期疗效未明的情况下显得十分必要。miRNA 功能丧失或增强,可导致蛋白水平的表达改变,影响药物吸收、代谢、分布通道上的基因表达及靶向参与临床功能,并可能导致持续耐药。通过研究miRNA 如何影响个体对特定药物的反应程度,对提高药物疗效和安全性,指导患者的个体化用药有重要意义。本研究收集接受新辅助化疗的巨块型宫颈癌患者,分析化疗敏感组与耐药组肿瘤组织中miRNA的表达差异,现报道如下。
1 资料与方法
1.1 组织来源 收集2014 年1 月至2017 年12 月在宁波市妇女儿童医院采用TC(紫杉醇+卡铂静脉化疗)方案进行新辅助化疗的Ⅰb2 ~Ⅱa2 期宫颈鳞状细胞癌患者,术前接受2 个疗程的新辅助化疗。化疗疗效评价标准:(1)完全缓解(CR):肉眼观肿瘤完全消失,且无新病灶;(2)部分缓解(PR):肿瘤缩小≥50%,且无新病灶;(3)病情稳定(SD):肿瘤缩小<50%,无新病灶;(4)病情进展(PD):肿瘤无缩小或有新病灶。CR 和PR 归为有效(敏感),SD和PD归为无效(耐药)。根据化疗的疗效将患者分为新辅助化疗敏感组和耐药组,其中敏感组4 例和耐药组3 例,将两组肿瘤组织进行miRNA芯片检测。所有参与患者在参加本实验前均签署知情同意书,医院伦理委员会批准了本次实验所有样本的使用协议。
1.2 主要试剂及仪器 主要试剂:RNA 6000 纳米试剂盒(Agilent)、ULSTMmicro-RNA 标记试剂盒(kreatech)、截留分子量100K 的超滤离心管(Pall Corp)、超滤离心浓缩管(GE)、无RNA酶水(Sigma)、预杂交溶液、杂交试剂盒、microRNA 微阵列、基因表达洗涤Buffe I、基因表达洗涤Buffe II、基因表达洗涤Buffe III(Phalanx)。主要仪器:微小RNA 表达芯片(miRNA OneArrayTM 芯片,台湾华联生物)、2100 生物分析仪(Agilent)、超微量分光光度计(Thermo Fisher)、凝胶记录系统(Alpha Innotech)、微量离心仪(Eppendorf)、PCR 系统(Applied Biosystems)、杂交炉(COCONO)、微阵列扫描仪(MolecularDevices Corporation)、恒温箱(Benchmark)。
1.3 方法
1.3.1 组织标本的采集与保存 宫颈癌组织标本是在患者化疗前留取,并经病理组织学证实,标本离体后存放于- 80 ℃低温冰箱中保存。
1.3.2 miRNA 芯片实验步骤
1.3.2.1 RNA提取及质检 选取每份样本组织约100mg,用Trizol法提取总RNA,经质检完好,每一样品的总RNA含量需5 g以上、OD 260/OD 280≥1.6、OD 260/OD 230≥1.0达到标准,即进行标记杂交试验。
1.3.2.2 微小核酸分离纯化 利用NanoSep®100K 的孔径分离微小RNA,将大片段核酸保留于管柱中,离心过的小片段核酸即为纯化后的微小核酸(<200nt)。
1.3.2.3 ULS荧光标定步骤 将ULS试剂剧烈震荡混和后离心,冰上备用;将分离纯化后的小核酸溶液,加入10×ULS标定溶液,混和后离心;置于PCR 上,设定85 ℃,15 min,置于冰上待纯化;将K REApure TM管柱取出,旋开1/4圈转盖,将管柱下方封口折断置入2 ml 收集管,13000r/min 离心1min,去除离心后收集管内溶液;加入300 l 纯水,13 000 r/min离心1 min;抛弃2 ml 收集管及溶液,将KREApureTM管柱置入1.5ml离心小管;加入小核酸溶液于管柱上,13000r/min离心1min 后抛弃管柱,测定溶液荧光吸收光谱(OD),计算荧光标定值,避光置于冰上,等待杂交反应。
1.3.2.4 miRNA 芯片(miRNA OneArray TM)反应流程(1)前杂交处理:将芯片置入无水酒精,静置20 s;取出置入Ebox,用纯水清洗,上下摇晃3min,置入已预热好的前杂交溶液,于42 ℃烘箱静置2h;取出置入已装入新鲜纯水的E-box清洗,上下摇晃3 min 后,取出芯片离心甩干,避光备用。(2)杂交反应:miRNA 芯片完成前杂交反应后,与具有黏性的On eArrayDouble Chamber黏合,黏合区域须符合探针布放区域,并翻转确认Chamber胶框完全密合;将荧光标定的小核酸样品与2×miRNA OneArray Hyb Buffer 混合,并加入适量纯水至总体积为90 l。样品进行PCR 加热,95℃,2min,从一端样品注入口加入样品,注入后将注入口以圆形黏性贴将Chamber 两端封口。将芯片置于37 ℃杂交烘箱中,2 r/min 垂直转速,14 ~16 h。将芯片取出,予37 ℃清洗溶液(buffer I)进行拆除Chamber,然后按如下步骤清洗,bufferI37℃,80r/min,5min;buffer II 37 ℃,80 r/min,5 min;再进行一次buffer II 25℃5 min 后,以buffer III 室温5 min 清洗,最后再离心将芯片甩干。避光,AXON4000B 荧光扫描仪扫描。
1.4 统计方法 采用SAM 4.01 微阵列显著性分析软件进行分析,采用IPA 软件分析其相关的靶基因,构建micro-RNA-基因网络图,数据比较采用t检验,P <0.05 为差异有统计学意义。
2 结果
2.1 差异miRNA 筛选结果 敏感组与耐药组有14 个miRNA表达差异均有统计学意义(均P <0.05),其中有12 个miRNA在TC方案新辅助化疗耐药组中表达上调,2 个miRNA 表达下调,两组倍比变化在- 0.69 ~2.61,见表1 ~2,差异表达miRNA 聚类图见封三彩图1。

表1 在耐药组中表达上调的miRNA
2.2 目标miRNAs 的选择 IPA 网络调控分析发现参与该调控网络的关键分子主要有PTEN、TRPS1、FBXW7、BAP1、ZEB2、RB1、TP53、CDKN2A、TGFBR2、CSF1、CTNNB1、CDK4、TIMP3、FAS。本研究耐药组中表达上调的12 个miRNA 中有4 个miRNA(hsa-miR-200c-3p、hsa-miR-21-5p、hsamiR-26a-5p、hsa-miR-92a-3p)的靶基因是PTEN。在耐药组中上调表达的miR-21-5p、miR-24-3p、miR-34c-5p参与Notch信号通路的调节,Notch信号通路是调控网络主要信号通路之一(封三彩图2)。

3 讨论
宫颈癌是女性发病率最高的恶性肿瘤之一,年轻的巨块型宫颈癌患者可行新辅助化疗,再行手术治疗,但是存在部分耐药的患者。因此寻找与新辅助化疗敏感性相关的肿瘤标志物显得十分重要,本实验对新辅助化疗敏感组和耐药组宫颈癌组织进行微小RNA 表达芯片检测,比较差异表达的miRNA,预测其靶基因,为筛选出与新辅助化疗耐药相关的分子标记物打下基础。
miRNAs 是一类内源性非编码单链小RNA,调控细胞的多种功能,参与细胞药物代谢过程,这说明其可能与化疗药物敏感性相关。Huang 等[1]报道,miR-15a和miR-16 表达上调能明显增强化疗药物喜树碱(CPT)引起的Hela细胞的自噬和凋亡,miR-15a/16 能诱导自噬而抑制宫颈癌细胞的增殖,增强CPT 的化疗作用。本研究结果发现其中有12 个miRNA 在化疗耐药组中表达上调,2 个miRNA 表达下调,其中在耐药组中上调表达的4 个miRNA在恶性肿瘤中研究的比较多,分别是miR-200c-3p、miR-21-5p、miR-26a-5p、miR-92a-3p,这提示其可能参与调控宫颈癌新辅助化疗耐药。
miRNA 对细胞功能有重要的调控作用,与肿瘤的转移、侵袭、凋亡及增殖等密切相关,并通过与上、下游基因之间的调控影响肿瘤细胞对化疗及放疗的敏感性[2-3],研究发现miR-200c与恶性肿瘤的发生发展、侵袭转移及化疗耐药等密切相关[4]。本研究在miRNA 芯片筛选的基础上,根据两组中差异表达的miRNA,获得与宫颈癌新辅助化疗耐药相关的基因列表,通过IPA 预测miRNA相关的靶基因,和miRNA一起构建miRNA-基因网络图。本研究结果发现耐药组中表达上调的12个miRNA中有4个miRNA(hsa-miR-200c-3p、hsa-miR-21-5p、hsamiR-26a-5p、hsa-miR-92a-3p)的靶基因是PTEN,PTEN是其中重要的分子。PTEN是一种抑癌基因,其异常表达还与肿瘤的多药耐药密切相关。有研究表明,在卵巢癌细胞株C13K中,miRNA-214与PTEN非编码区结合,下调PTEN蛋白的表达,导致细胞对顺铂耐药[5]。还有研究表明肿瘤细胞对顺铂、多柔比星、紫杉醇等化疗药物耐药的关键因素之一是激活了PI3K/Akt,PI3K 抑制剂可以逆转肿瘤细胞对化疗药物的耐药,而PTEN是调控PI3K/Akt 通路的重要基因[6]。这提示PTEN 可能参与调控宫颈鳞状细胞癌新辅助化疗耐药。
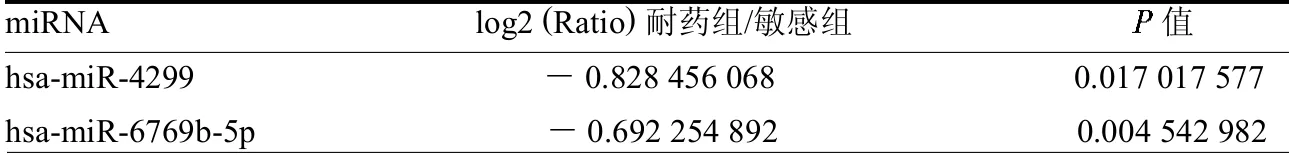
表2 在耐药组中表达下调的miRNA
本研究通过IPA 分析发现在耐药组中上调表达的miR-21-5p、miR-24-3p、miR-34c-5p 参与Notch 信号通路的调节,miR-21-5p参与了Notch信号通路的调控,miR-24-3p 的靶基因FURIN 参与了Notch信号通路的调控,miR-34-5p的靶基因Notch1、Notch2、DLL1、JAG1,其中Notch-1、Notch-2 是Notch受体,DLL1、JAG1 是Notch 配体,NOTCH 信号通路是调控网络主要信号通路之一。Notch 通路与PI3K/AKT通路之间的相互作用在肿瘤中成为研究热点。有研究发现联系PI3K/AKT、Notch 通路之间的一个重要节点是PTEN,不同的Notch 分子对PTEN 的作用及所产生的生物学效应也并不相同[7]。这提示PTEN 和Notch信号通路可能参与调控宫颈鳞状细胞癌TC 方案新辅助化疗耐药,但其具体的作用及调控方式尚需在体外细胞实验及动物体内实验中进一步证实。
综上所述,对这些差异表达的miRNA、其靶基因及参与调控的信号通路进行深入的研究,有助于进一步了解化疗耐药的分子机制,为寻找耐药相关的分子标志物和基因治疗的新靶点提供依据。
