肠上皮细胞中SDC-1、LRG1的表达与UC患者屏障功能损伤的相关性研究
2021-10-30张雪芹王凤仙张晖敏
张雪芹,王凤仙,张晖敏,唐 源
云南省曲靖市第一人民医院消化内科,云南曲靖 655000
溃疡性结肠炎(UC)属于非特异性肠道炎性病变疾病之一[1],患者主要表现为腹痛及腹泻的频繁发作。流行病学调查显示[2],随着居民饮食结构的显著改变,溃疡性结肠炎的发病率呈现逐年上升的趋势。有研究认为[3],在UC的进展中,病灶部位的炎性反应及应激反应发挥着重要作用,通过对肠上皮细胞内皮功能的不断破坏,肠上皮的屏障功能显著受到破坏,进一步加重患者的临床症状。多配体蛋白聚糖1(SDC-1)是重要的Ⅰ型跨膜蛋白,在正常的生理情况下,SDC-1主要表达于肠道上皮细胞的细胞膜。研究显示,SDC-1可通过对肠道黏膜组织的修复及免疫功能的调节作用,进而维持正常的肠道黏膜的屏障功能[4]。富亮氨酸α-2 糖蛋白 1(LRG1)在肠黏膜组织的血管生成中具有显著的意义。同时对于炎性因子的凋亡、迁移及信号转导中发挥重要作用[5]。本研究主要通过肠上皮细胞中SDC-1、LRG1的表达与UC患者屏障功能损伤的相关性分析,为临床诊断及治疗效果评估提供科学依据。
1 资料与方法
1.1一般资料 本研究采用前瞻性研究方法,选择2018年1月至2020年5月在本院进行诊断及治疗的UC患者120例作为研究对象,其中,男65例,女55例,年龄36~60岁,平均(48.25±10.25)岁,平均体质量指数(BMI)为(24.59±3.61)kg/m2,平均病程(15.23±2.06)月,根据简化UC活动指数(CDAI)分析[6],CDAI在150以下则为缓解期,否则为进展期。缓解期患者56例,进展期患者64例。另选取同期本院治疗的肠息肉患者120例作为对照组,两组患者的性别、年龄及BMI之间比较,差异无统计学意义(P>0.05)。纳入标准:(1)均符合溃疡性结肠炎诊断标准并经纤维镜病理确诊[7];(2)均知情同意。排除标准:(1)近期采用糖皮质激素治疗患者;(2)近期采用免疫抑制剂治疗患者;(3)合并急性或慢性感染患者;(4)肝肾功能异常未能进行纤维镜检查患者。所有患者均签署知情同意书,并经本院伦理委员会论证通过。
1.2研究方法 患者的肠上皮细胞SDC-1、LRG1水平检测:采用纤维结肠镜对UC及结肠息肉患者的病灶部位进行采集,采用石蜡包埋对以上标本进行处理,连续切片处理,切片的厚度为2 μm,通过对以上切片进行常规脱蜡及水化处理后,采用枸橼酸盐缓冲液进行抗原修复,使用3%的过氧化氢进行阻断过氧化氢酶,同时滴加山羊血清后在室温下密闭30 min,使用SDC-1抗体1∶200(北京博奥森生物技术有限公司,生产批号:20150211)及LRG1抗体1∶100(上海艾博抗贸易有限公司,生产批号:20150820)后,在4 ℃下进行孵育过夜,在反应增强液中进行室温下孵育20 min,使用辣根过氧化物酶标记的二抗在室温下孵育20 min,随后采用二氨基联苯胺进行显色,采用1%的乙醇对以上标本进行分化,使用苏木精进行复染,采用梯度乙醇进行脱水,同时采用二甲苯进行透明处理,封片。在400倍显微镜下对患者的胶片进行观察,在观察过程中,取5个视野,每个视野对100个肿瘤细胞进行计数,根据染色深度以及阳性细胞比率对肠道上皮细胞的SDC-1、LRG1水平进行检测。SDC-1以及LRG1表达情况结果评估:阳性表达率在5%以下则为0分,阳性表达率在6%~<25%则为1分,阳性表达率在26%~<50%则为2分,阳性表达率在51%~<75%则为3分,阳性表达率在≥75%以上则为4分。染色强度分析:无染色情况则为0分,染色为浅黄色则为1分,染色为黄色则为2分,染色为棕黄色则为3分,阳性表达率及染色强度的乘积则为SDC-1及LRG1表达量[8]。两组患者的肠道屏障功能检测:采用RIRP裂解液对以上标本的研磨处理液进行裂解,同时在1 000 r/min离心10 min后,取上层液体,采用酶联免疫吸附试验法对以上液体进行一氧化氮(NO)、半乳糖凝集素3(galectin-3)、密封蛋白(OCLN)、galectin-1、紧密连接蛋白1(ZO-1)、扣带蛋白(cingulin)等情况进行比较。
1.3观察指标 分别对观察组患者及对照组患者、缓解组及进展组患者的SDC-1、LRG1水平、NO、galectin-3、OCLN、galectin-1、ZO-1及cingulin水平进行比较,分析肠上皮组织SDC-1、LRG1水平与NO、galectin-3、OCLN、galectin-1、ZO-1及cingulin水平的相关性。
2 结 果
2.1两组患者的SDC-1、LRG1水平比较 观察组患者的SDC-1、LRG1水平显著低于对照组,差异有统计学意义(P<0.05)。见表1。

表1 两组患者的SDC-1、LRG1水平比较
2.2不同严重程度UC患者的SDC-1、LRG1水平比较 缓解组患者的SDC-1、LRG1水平显著显著高于进展组,差异有统计学意义(P<0.05)。见表2。

表2 不同严重程度UC患者的SDC-1、LRG1水平比较
2.3两组患者的肠道屏障功能比较 观察组患者的NO、galectin-3、OCLN、galectin-1、ZO-1及cingulin水平显著低于对照组,差异有统计学意义(P<0.05)。见表3。

表3 两组患者的肠道屏障功能比较
2.4不同严重程度溃疡性结肠炎患者的肠道屏障功能比较 缓解组患者的NO、galectin-3、OCLN、galectin-1、ZO-1及cingulin水平显著低于对照组,差异有统计学意义(P<0.05)。见表4。

表4 不同严重程度UC患者的肠道屏障功能比较
2.5相关性分析 通过相关性分析,患者的SDC-1、LRG1水平与NO、galectin-3、OCLN、galectin-1、ZO-1以及cingulin水平呈正相关。见表5。
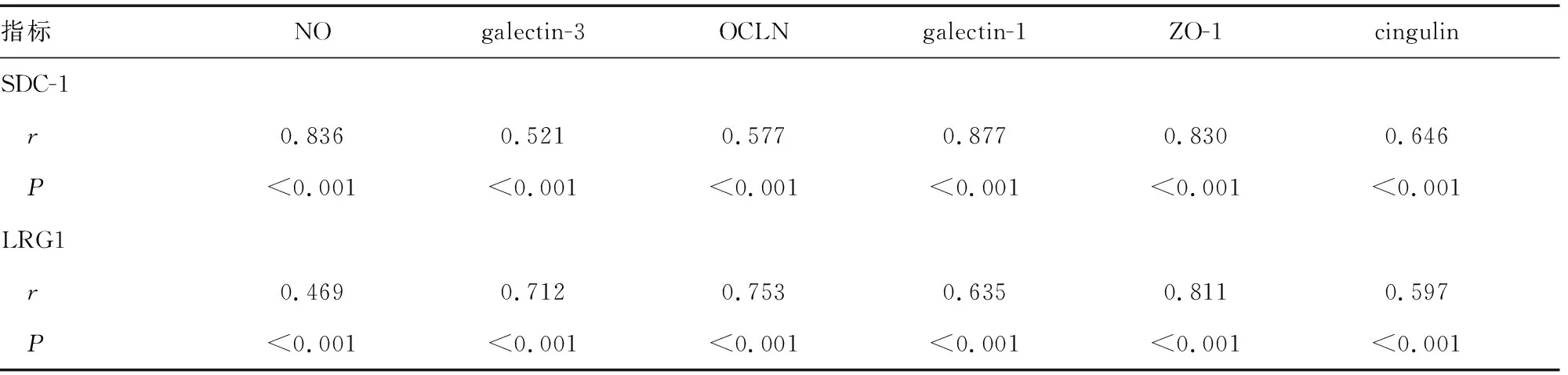
表5 相关性分析
3 讨 论
目前对于UC的发病机制的研究尚不明确,有研究认为[9],UC患者的自身免疫系统、肠道屏障及炎性反应水平的平衡显著相关性。随着疾病的进展,局部病灶部位的炎性反应水平的显著升高,肠道黏膜组织的氧化应激反应水平显著升高,肠黏膜组织的氧自由基水平显著升高,进一步形成恶性循环[10]。
SDC-1又被称之为CD138,作为硫酸乙酰肝素蛋白聚糖家族的重要成员,在正常的生理作用下,肠黏膜组织的SDC-1水平较高,较高的SDC-1水平通过对肠黏膜组织的修复及局部病灶部位的免疫功能的调节作用,同时对于肠黏膜组织的上皮细胞的紧密结构具有显著的维持作用[11]。而在溃疡性结肠炎患者的病变过程中,大量的炎性细胞及其分泌的促炎性细胞因子,造成正常的肠黏膜细胞在其胞外域进行脱落,同时失去活性[12]。同时随着患者的SDC-1水平的下降,肠道组织的修复功能显著下降[13]。本研究中,通过对UC患者及结肠息肉患者的SDC-1水平进行比较,UC患者的SDC-1显著低于肠息肉患者,且随着患者疾病的进展,患者的SDC-1显著下降,也在一定程度上验证了以上研究。耿丽等[14]通过对UC患者的SDC-1水平的比较,随着疾病的进展,患者的SDC-1水平显著下降,与本研究一致。
有研究报道显示[10],LRG1在肠道上皮细胞的黏附、炎性细胞的迁移及信号转导过程中发挥重要作用。而在肠道黏膜的自我修复过程中,局部病灶部位的毛细血管发挥重要作用,既是肠道黏膜细胞修复营养物质传送的重要依据,也是炎性因子及其他有害因子新陈代谢的重要途径。而近年来的研究发现[15],LRG1与肠道新生血管的新陈代谢显著相关。其主要通过对患者的转化生长因子的有效刺激性作用,进一步对转化生长因子的转录因子的刺激性作用,激活白细胞抑制因子蛋白,对于局部炎性反应水平的降低具有积极的意义。而在本研究中,UC患者的LRG1水平显著低于结肠息肉患者,同时随着患者的病情加重,患者的LRG1显著下降。霞明等[16]对溃疡性结肠炎患者的LRG1水平比较,随着患者的疾病进展,患者的LRG1显著下降,与本研究一致。
而在对患者的肠道屏障功能的分析中,随着患者的疾病进展,NO、galectin-3、OCLN、galectin-1、ZO-1及cingulin水平显著上升,在对疾病的进展中,病灶部位的氧化应激反应显著升高,机体的NO大量释放[17]。galectin-3、galectin-1是肠道上皮细胞之间的极性状态及紧密连接状态的重要指标,随着疾病的进展,患者的肠上皮细胞的凋亡情况显著,而细上皮细胞的紧密程度显著下降,galectin-3、galectin-1也随之下降。OCLN、ZO-1及cingulin水平也是肠道黏膜组织的完整性的重要依据,而随着疾病的进展,局部病灶部位的炎性反应及氧化应激反应水平的显著升高,肠道黏膜组织的完整性显著破坏[18]。而在相关性的分析中,溃疡性结肠炎患者的SDC-1、LRG1水平与肠道黏膜组织的完整性呈正相关。提示,通过对患者的SDC-1、LRG1水平的检测,通过对患者的肠道黏膜组织的完整性分析,可进一步对患者的病情以及治疗效果进行评估。
综上所述,肠上皮细胞中SDC-1、LRG1的表达与UC患者屏障功能损伤显著相关,可作为临床诊断的重要依据。
