基于液相芯片筛查与肝癌相关血清自身抗体的研究
2021-10-28陈子恩陈嘉童王徐飞陈文莉
肖 静,杨 舒,闻 琦,陈子恩,陈嘉童,王徐飞,陈文莉,龙 飞*,彭 涛
(1.广州医科大学 基础医学院 广州霍夫曼免疫研究所,呼吸疾病国家重点实验室,广东 广州511436;2.广东省人民医院 广东医学科学研究所 感染科,广东 广州510080)
自身抗体是由于机体内表位扩展、性质改变或隐蔽抗原释放等原因所产生的针对自身正常组织抗原的相应抗体,其异常表达通常与自身免疫性疾病发生密切相关。近年来,随着关于病毒性肝炎、肝硬化、肝癌等患者体内检测到自身抗体的报道越来越多,自身抗体与肝脏疾病的发生正逐渐成为近年来的一个研究热点[1-2]。本文利用液相芯片技术制备多重自身抗体液相芯片,对肝炎、肝硬化、肝癌患者以及正常人的临床血清进行自身抗体检测分析,筛查与肝癌相关的自身抗体,并对其肝癌诊断的临床价值进行初步评估,为今后自身抗体作为肝癌辅助诊断标志物提供一定的理论依据。
1 资料与方法
1.1 一般资料
肝病临床血清样本来源于广东省人民医院2015年12月到2017年12月份收治的患者,均告知患者研究目的并签署知情同意书。包括40例肝炎患者,其中男30例,女10例,年龄18-78岁;32例肝硬化患者,其中男25例,女7例,年龄22-75岁;48例肝癌患者,其中男40例,女8例,年龄24-83岁;30例健康体检者作为正常对照组,其中男19例,女11例,年龄20-84岁。肝癌样本符合2005版《肝癌诊治指南》诊断标准[3],肝炎、肝硬化符合2005版《病毒性肝炎防治指南》诊断标准[4]。同时收集了南方医科大学附属医院的10例系统性红斑狼疮(SLE)患者的血清样本验证方法学,SLE患者均符合1997年美国风湿病学会制定的分类标准[5]。将收集于血清分离管的全血标本室温放置1 h,然后1000×g离心20 min,取上清分装至新的EP管中,置于-80℃保存。
1.2 实验方法
采用Bio-Rad公司液相芯片偶联试剂盒得到20种自身抗体偶联微球,用分析液(含1% BSA的PBS溶液)将偶联微球稀释混匀至1管,50 μL/孔加入到96孔板,用PBST洗涤2遍。使用样品稀释液将临床血清、质控样本(人源IgG)以及阴性对照以1∶100 稀释,50 μL/孔加入到96孔板,37℃避光震荡1 h,清洗2遍后,加入50 μL/孔生物素标记抗人IgG抗体,37℃避光震荡0.5 h,清洗2遍再加入50 μL/孔SA-PE,37℃避光震荡15 min,清洗3遍后重悬微球,Bio-Plex 200液相芯片系统读取荧光值(MFI)。
为避免非特异吸收信号的干扰,采用特异性结合指数(SBI)评价自身抗体IgG水平:SBI=(待测样本MFI值-阴性对照MFI值)/(质控样本MFI值-阴性对照MFI值)[6]。
生化指标包括谷丙转氨酶(ALT)、谷草转氨酶(AST)、白蛋白(ALB)、γ-谷氨酰转肽酶(GGT)、采用Beckman coulter AU5821全自动生化分析仪进行测定。甲胎蛋白(AFP)和高尔基蛋白(GP73)采用本实验室建立的液相芯片联合检测GP73和AFP体系进行测定[7]。
1.3 统计学处理
2 结果
2.1 多重自身抗体液相芯片检测体系验证
利用SLE临床血清样本对所建立的多重自身抗体液相芯片检测体系进行验证,结果显示,Smith、U1-snRNP作为SLE的血清特异性自身抗体,其在SLE组中显著高于正常对照组。与SLE血清相关的自身抗体,SSA/Ro和La-SSB也表现出在SLE组中显著高于正常对照组。而Scl-70、Mi-2、tTG、EJ、TPO、LKM-1这些SLE非特异性自身抗体在SLE组和正常对照组中则无显著性差异。说明所建立的检测体系结果可靠(表1)。
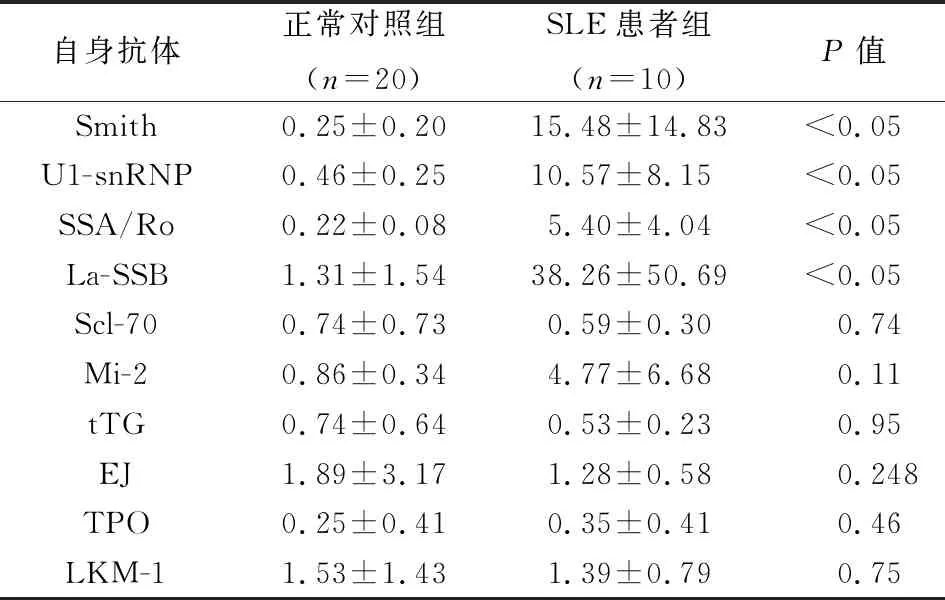
表1 正常对照组与SLE患者自身抗体IgG表达水平比较分析
2.2 自身抗体在肝炎、肝硬化、肝癌和正常对照组的表达水平比较
肝炎、肝硬化、肝癌组的SSA/Ro、tTG、LC1、PR3、Scl-70、Mi-2、MPO、SSA/Ro以及TIF1-γ自身抗体在肝炎、肝硬化、肝癌组中的表达均显著高于正常对照组,且肝癌组SSA/Ro显著高于肝炎和肝硬化组。SP100和P53自身抗体在肝炎、肝癌组中的水平显著高于正常对照组,且肝癌组中的水平显著高于肝炎和肝硬化组。U1-snRNP、GP73、P0和Smith自身抗体在肝癌组中表达水平显著性高于正常对照组以及肝炎和肝硬化组,而肝炎、肝硬化组与正常对照组无显著性差异。LKM-1、JO-1、EJ自身抗体在肝癌组的水平显著高于正常对照组,而在肝炎和肝硬化组中与正常对照组、肝癌组相比均无显著性表达差异。La-SSB、TPO、AFP自身抗体在肝炎、肝硬化和肝癌中的水平与正常对照组间无显著性差异(表2)。
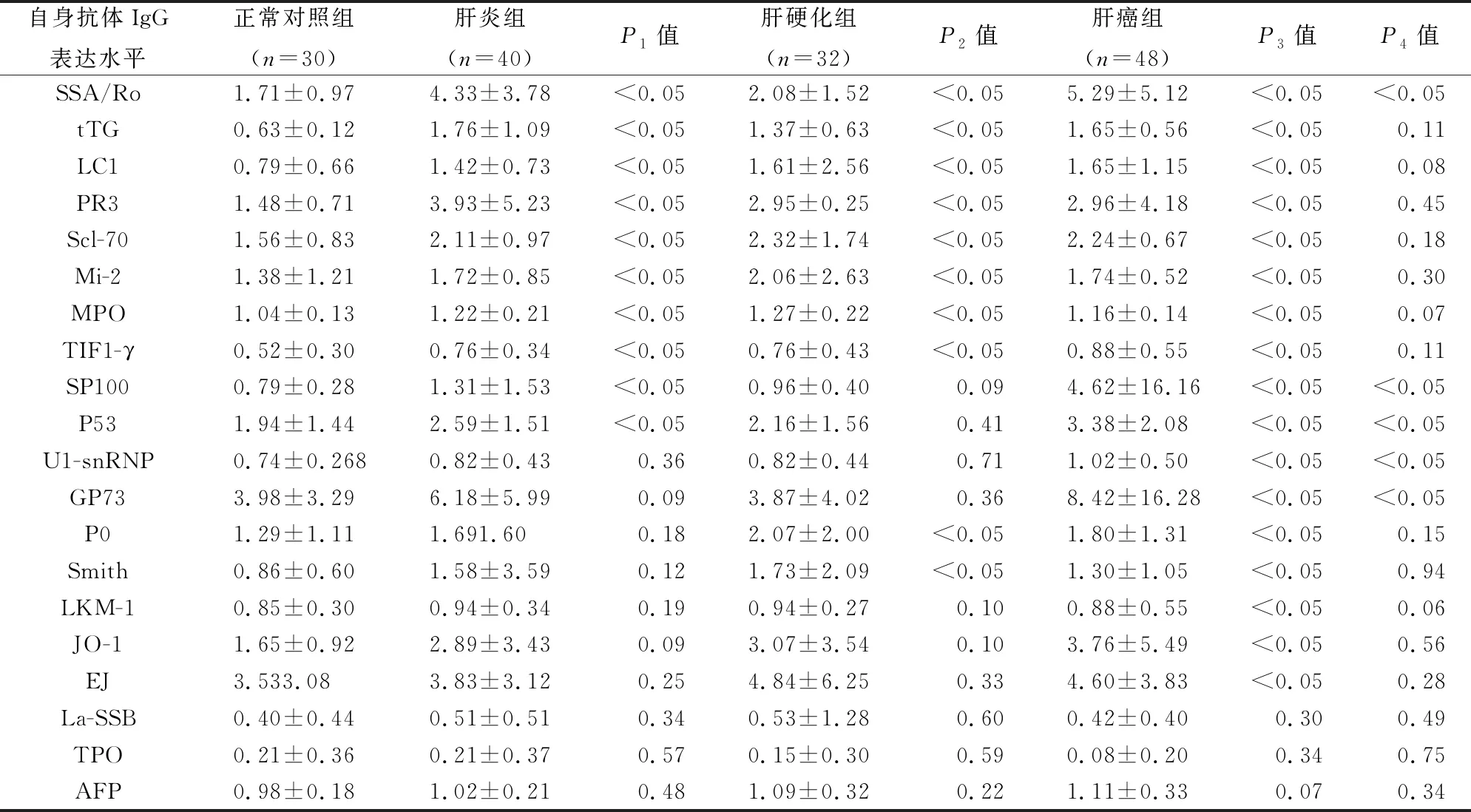
表2 正常对照组与肝炎、肝硬化和肝癌患者各自身抗体IgG水平比较分析
2.3 自身抗体对肝癌的诊断价值
ROC曲线分析结果显示,SSA/Ro、tTG、LC1、PR3、Scl-70、Mi-2、SP100的ROC自身抗体诊断肝癌的曲线下面积优于AFP,其中tTG的灵敏度和特异性最高(表3)。
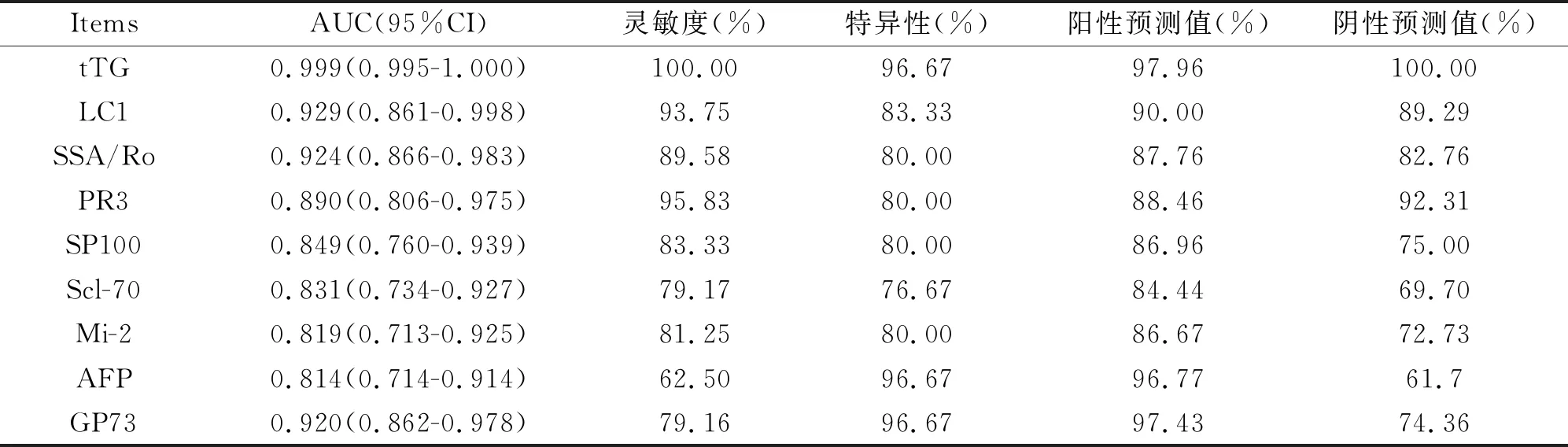
表3 自身抗体对肝癌的诊断效率
2.4 肝癌相关自身抗体与生化指标相关性分析
结果显示,肝癌相关自身抗体之间呈显著正相关,生化指标之间GGT与ALT、AST、GP73呈显著正相关;ALT与AST显著正相关;AST与ALB显著负相关;GP73与AFP显著正相关;而自身抗体与生化指标之间无显著相关性(表4)。
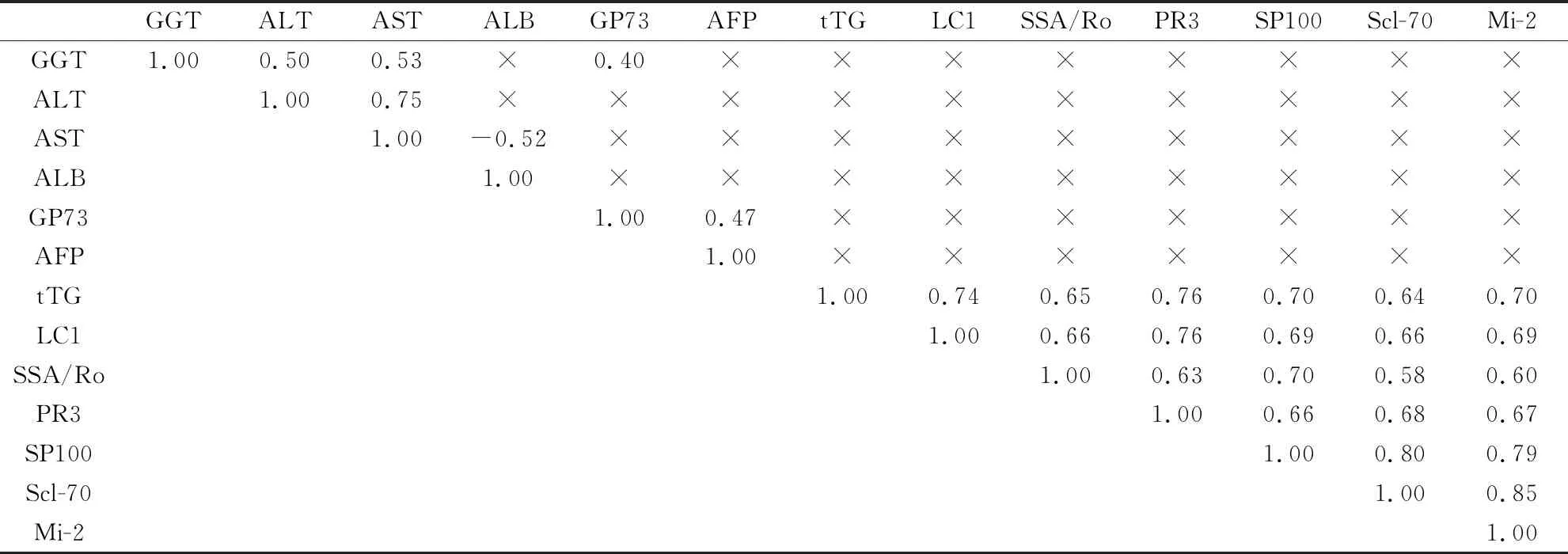
表4 肝癌相关自身抗体与生化指标的Spearman相关性分析
3 讨论
目前认为持续的炎症反应、免疫失调是肝癌发生发展的关键病理机制之一[8],肝癌的发生通常与病毒性肝炎、肝硬化、环境因素等密切相关。随着越来越多报道,一些慢性肝炎、肝癌患者血清中有异常的自身抗体表达,认为肝病与自身免疫反应密切相关[9-10]。研究认为HCV感染会导致机体内免疫调节系统紊乱可能破坏Ro蛋白等自身抗原的存在环境,从而引起SSA/Ro、Mi-2和Scl-70等ENA自身抗体大量产生[11],并且随着肝炎病情进展,ENA抗体阳性率可能持续升高[12],这与本研究抗SSA/Ro在肝癌中的水平显著高于肝炎和肝硬化结果一致,提示SSA/Ro异常表达可能与肝癌的发展进程有关。此外,病毒性肝炎可伴发周围神经病变,肝外表现可能与血管炎等有关[13],进而可能引起血管炎相关的PR3和MPO等自身抗体异常表达。抗LC1通常被认为是自身免疫性肝炎的标志物。有研究认为抗LC1阳性提示AIH患者可能伴随有其他自身免疫性疾病、重症肝炎或肝硬化等[14]。抗SP100自身抗体作为原发性胆汁性肝硬化的特异性自身抗体,其在肝癌组的水平显著高于正常对照及肝炎和肝硬化组,显示其在肝癌鉴别诊断方面的潜能。此外,值得注意的是本研究发现作为特异性血清抗体被用于乳糜泻大规模高危人群筛查的tTG自身抗体对肝癌诊断的灵敏度和特异度均很高,表现出良好的肝癌诊断潜在价值。乳糜泻可合并自身免疫性肝病,常伴发肝脏损伤,因此在慢性肝炎、自身免疫性疾病等多种疾病中均有一定抗tTG抗体阳性率[15-16]。
此外,相关性结果显示自身抗体之间呈显著正相关,说明在肝癌的发展进程中,通常存在多种自身抗体异常表达的情况,这可能与肝癌发展进程有关。在我国,约70%的肝癌是由病毒感染引起的病毒性肝炎发展为肝硬化、肝癌,这不仅发生肝脏的免疫病理损伤,还可诱发多种肝外自身免疫现象,引起免疫系统紊乱[17]。而自身抗体与生化指标之间无显著相关性则提示肝癌发展进程中所引起的肝损伤和肝外系统损伤可能是由不同机制所致,但其具体机制和临床意义有待进一步研究。
综上所述,本研究利用自身抗体多重检测液相芯片体系,筛选到SSA/Ro、tTG、LC1、PR3、Scl-70、Mi-2和SP100自身抗体在肝炎、肝硬化、肝癌中存在异常表达。这提示在肝癌的发展进程中不仅引起肝功能损伤,还引起患者机体免疫调节系统紊乱,进而导致多种自身免疫抗体水平异常表达。临床上自身抗体的检测有助于了解肝病患者病情状况,自身抗体异常表达提示需积极预防肝癌的发生。当然本研究存在一定局限性,如样本例数偏少,样本类型不多等,后续还需进一步扩大验证。
